运动性肌肉疲劳过程中大脑运动皮质区运动相关电位变化
2015-02-15郭峰
郭 峰
运动性肌肉疲劳过程中大脑运动皮质区运动相关电位变化
郭 峰
目的:观察健康成年受试者上肢指屈肌次最大随意等长收缩诱发运动性疲劳过程中大脑运动皮质区运动相关皮层电位(movement-related cortical potentials,MRCPs)的变化。方法:对疲劳组(n=15)和非疲劳组(n=13)受试者在进行200次的30% MVC的间断性等长握力收缩过程中的肌力、肌电以及脑电进行同步测量。将200次收缩分为4个模块,观察最大握力以及肌电均方根振幅(RMS)的变化。将200次收缩分为前、后2个大模块,分析在脑电信号中提取出的MRCPs电位。结果:研究表明,疲劳组受试者在指屈肌渐进性疲劳过程中最大握力(P<0.001)及其对应的肌电幅值(P<0.001)显著性下降,在4个运动模块中指深屈肌肌电的RMS幅值逐渐增加(P<0.01);运动皮质区的运动执行电位(motor potential,MP)和运动准备电位(readiness potential,RP)幅值随着疲劳发生发展显著增加。非疲劳组受试者以上指标没有显著性变化。与非疲劳组受试者相比,疲劳组受试者运动头皮运动区MRCPs有向头部前方和运动同侧移动的趋势。结论:在指屈肌次最大随意收缩诱发的渐进性疲劳过程中大脑运动皮质区运动相关皮层电位激活水平增高,激活面积弥散,且有向头部前方和运动同侧移动的特点,这可能是中枢为了弥补肌肉力量下降动员更多肌纤维而采用的中枢策略。另外,运动执行电位与肌肉疲劳密切相关,而运动前准备电位受肌肉疲劳影响较小。
运动性肌肉疲劳;握力;运动皮质区;事件相关电位;运动相关皮层电位
运动性肌肉疲劳引起的力量下降可能源于神经肌肉控制轴的不同位置,例如,肌细胞膜、神经肌肉接头、脊髓或者大脑皮质[33],其中,中枢疲劳在肌肉力量下降中起到了关键作用。对于疲劳的中枢机制来说,已经有研究者使用EEG(electroen cephalog ram)和fMRI(functional magnetic resonance imaging)去探索疲劳运动任务过程中大脑皮层的信息处理过程[1,22-24]。目前,研究者们开始把注意力转向了运动相关皮层电位(movement-related cortical potentials,MRCPs)的研究。MRCPs是一种与运动相关的事件相关电位。 MRCPs电位包含多种成分,主要包括运动前成分和运动后成分。运动前成分又可以称为准备电位(bereitschaftpotential,BP 或者readiness potential,RP),最初是由Kornhuber和Deecke[20]提出来的,这个成分主要与动作执行前的准备过程有关,而运动后成分与躯体感觉输入成分有关。RP电位以一种缓慢增加的负电位为特征,通常开始于运动前的-1 500 ms。它又可以分成3种成分,即早期RP成分,是肌电触发前的-1 000~-1 500 ms时间段内的电位;晚期成分negative slope (NS’),可以称之为负性斜率成分,为肌电触发前的-500 ms时间段内的电位;运动电位(motor potential,MP),这个电位主要对应着MRCPs电位的峰值成分或者最大负性峰值,通常取肌电触发后的50 ms内的电位幅值[20]。以上这些电位成分能够反映出随意运动的计划、准备以及早期的运动执行过程,这些成分通常出现在初级运动区、前运动区、辅助运动区以及枕后区和躯体感觉皮质区[3,4,7]。在这些区域,MRCPs电位成分的幅值和潜伏期可以直接反映中枢的运动命令。
目前,国内研究者鲜见开展对大脑运动皮质区MRCPs电位的研究,而研究主要集中在国外研究者。最近,有研究者研究发现,在重复性运动诱发肌肉疲劳的任务中,RP电位幅值显著增加,认为这种RP幅值的增加是对外周肌肉疲劳的一种补偿[9,18,23,26,30]。Schillings等人[26]发现,长时间重复性的运动诱发的RP电位幅值增加可能是由于长时间运动任务过程中认知需求增加引起的,而并不是肌肉疲劳引起RP电位幅值的增加。因此,重复性收缩诱发肌肉疲劳的实验设计可能会影响肌肉疲劳对MRCPs成分影响的判断。同时,以前还有一些研究者研究发现,在运动性疲劳过程中MRCPs幅值降低[25],认为这主要是由于运动过程中注意力下降和对运动任务的习惯化导致了电位幅值降低。因此,有关运动性疲劳时大脑运动皮层MRCPs幅值变化特征的研究结果并不一致,并且,针对这些结果的解释也存在差异。
本研究使用肌力、表面肌电(surface electromyography,sEMG)、MRCPs结合起来共同研究上肢小肌肉群运动疲劳过程中中枢神经系统的神经电生理学机制,预观察MRCPs不同成分在运动性疲劳过程中的变化情况。本研究假设运动相关皮质区的神经元活动会随着肌肉的疲劳而发生变化。
1 研究对象与方法
1.1 研究对象
最初选取了32名健康受试者为研究对象,这些受试者通过自我报告的形式确定全部为右利手。将这32名受试者分为疲劳组16人和非疲劳组16人,但疲劳组中有1人脑电信号干扰较大,非疲劳组中有3人脑电信号干扰伪迹较大,这4名受试者最后被排除研究之外。最后,疲劳组15人(年龄23.4±1.1岁,身高1.75±0.11 m,体重72.3±7.4 kg);非疲劳组13人(年龄22.7±1.7岁,身高1.77±0.16 m,体重70.3±9.4 kg)作为最终的研究对象。统计学分析表明,2组受试者在年龄、身高、体重方面都没有统计学差异(P>0.05)。同时,受试者没有神经肌肉系统疾病以及精神疾病。向受试者详细介绍本实验程序后,受试者同意参与本实验研究,并且承诺给予受试者一定的报酬。
1.2 实验方案
令疲劳组受试者的右手执行200次间断性的30%MVC等长握力收缩,每次收缩时间大约持续6 s,间歇时间大约4 s。将200次收缩划分为4个模块(Block 1,Block 2,Block 3,Block 4),每个模块包含50次收缩,在每个模块之间有不到1 min的休息时间,这段时间内主要进行最大随意收缩力(maximal voluntary contraction,MVC)的测试。受试者对30%MVC力量水平的控制主要通过实时显示在电脑显示器上的目标力水平线来完成,受试者可以通过实时显示在电脑显示器上的可视化力量反馈来控制目标力量的高低。受试者按照自我节奏(self-paced)进行收缩,尽可能精准地达到目标力水平并且持续6 s,同时保持间歇时间4 s。
在分析MRCPs时,为了获得更高的信噪比,研究者将200次收缩分为2个模块,每个模块包含100次收缩,初期模块(Early blocks,即Block 1 和Block 2)和后期模块 (Late blocks,即Block 3 和Block 4)。
对于非疲劳组受试者来说,收缩方式与疲劳组相同,同样也是以30% MVC的收缩强度间断性地收缩200次,每次收缩持续6 s,差别主要在于每次收缩之间的间歇休息时间,非疲劳组受试者有更充裕的间歇休息时间,大约为8 s。
1.3 实验具体程序
受试者调整自己的身体使其舒服地坐在椅子上,电脑显示器距离受试者90 cm,受试者右侧上肢贴着躯干同时肘关节屈曲大约90°,右侧上肢的前臂倚在椅子的扶手上,同时,手掌保持90°的内旋。为了减少其他肌肉的激活,允许受试者调整他们的身体,使身体其他部位处于放松状态,使肌肉收缩只发生在前臂握力肌群。实验开始前,首先让受试者熟悉一下实验过程,尤其是力量水平。
在正式实验前以及每个Block之间分别测试受试者的MVCs。测试MVCs时,令受试者尽自己最大的努力握握力计,持续5 s,并在测试同时给予口头鼓励,让受试者尽最大努力坚持。对于正式实验开始前的初始MVC,需要测试3次,然后,选择力最大的1次作为研究。但是,为了降低疲劳效应的影响,Block之间的MVC只测试1次。
本实验的数据采集和分析工作在沈阳体育学院的运动心理学实验室和国家体育总局重点实验室的电生理实验完成。
1.4 数据采集与处理
1.4.1 肌力测量与分析
为了实现本研究目的,研究者自制了数字电子握力计,在电子拉力/压力传感器(最大量程500 N)的基础之上,对其进行了改造,配置了拉力手柄,拉力手柄有调节器,可以根据不同受试者的手掌大小进行调节,使受试者在进行屈指运动实验时处于一个最舒服的发力位置,这种调节有利于受试者发挥出最大随意收缩力,正如运动生理学中提到的,只有骨骼肌肌纤维的肌小节的初长度处于一个最适长度时才能使肌肉产生最大的收缩效果。为了增加握力过程中的舒适感以及降低手与握力计拉杆之间挤压而产生的不舒服感,研究者在拉杆上增加了橡胶软垫。另外,编制了实时显示握力曲线软件,在受试者执行握力任务的同时,可以通过该软件实时显示其握力的力量水平。
在测试前,首先对握力计进行校正。在最大随意收缩测试时,使用语言鼓励受试者发挥最大力量去握握力计,进而得到受试者的最大握力力量。对于最大握力值,取力量曲线的平稳期(即力量上升和下降之间的平稳力量信号)的平均值。测试最大力量的同时也测量肌肉对应的肌电值,将得到的最大力量和其对应的肌电幅值作为基准值,用于标准化处理。肌力标准化处理的具体方法是将每一个Block内测试的肌力平均值与初始MVC相除,将力值用%MVC来表示。最后,再将标准化处理的肌力对所有的受试者取平均值。
1.4.2 sEMG信号测量与处理
1.sEMG信号测量
选取受试者右手前臂的指深屈肌为测试肌肉,该肌肉已经被很多研究者用于手指运动与大脑皮层控制的研究中。根据以往研究者的研究,指深屈肌的最佳位置在前臂距离肘关节远端3~5 cm,靠近尺骨内侧1~2 cm远处。另外,本研究为了进一步判断指深屈肌的准确位置,让受试者克服外界阻力屈曲第4指骨时的前臂指屈肌的肌腹最大隆起,帮助进一步判断指深屈肌的位置。肌电测试采用双极记录法,两个双极导联来自脑电测试系统,这样可以保证脑电与肌电同步测量。两个双极导联电极的中心位置距离为20 mm,在粘贴电极之前对其所对应的位置用去角质皮膏(NuprepTM,D.O.Weaver & Co.,USA)进行皮肤预处理,然后用75%的酒精擦拭去掉皮肤死皮,直至皮肤自然风干后再粘贴电极注入导电膏,这样可以显著降低皮肤阻抗。肌电信号的采样频率设置为1 000 Hz,带通滤波设置为0.1~200 Hz。
肌肉每次收缩记录到的sEMG信号通过均方根振幅法(root mean square,RMS)进行全波整流,整流的时间窗口宽度为0.1 s,然后再对每次收缩内的肌电信号RMS取平均值。最后,求出每一个受试者在每一个Block内的平均RMS, 4个Block对应4个平均的肌电RMS值。
2.sEMG信号标准化处理
同样,对于sEMG信号也要进行标准化处理。sEMG信号分析中一个最大的缺点就是肌电幅值受到探测条件的影响:它随着电极的位置、实验对象甚至同一块肌肉的不同测试时期而发生变化。克服这个幅值问题的一个方法就是使用相对参考值的标准化值(例如,一个作为参考的最大随意收缩值)。sEMG信号标准化的主要效应是消除探测条件的影响,将微伏级数据变换成所选择参考值的百分比,标准化过程不会改变肌电曲线形状,只是改变了Y轴的比例。sEMG信号标准化处理的另外一个好处就是可以将原始数据转化成为一个相对于参考值的百分比,在实验中所有的受试者之间可以进行比较分析,它消除了很多干扰因素,可以进行不同组之间的定量研究。目前,比较受欢迎的是最大随意收缩标准化方法,即记录受试者某块肌肉最大随意收缩过程中的肌电幅值,然后,将收缩过程中sEMG信号与最大随意收缩时的信号相除,具体方法与肌力标准化方法一致,只是肌电基准值对应的是最大肌力时产生的RMS值,将肌电值也用%来表示。将前面得到的4个Block内的平均RMS绝对值经标准化处理后表示为%RMS,最后分别对每组内的全部受试者%RMS取平均值。
1.4.3 EEG测量与分析
1.EEG测量
本研究使用美国64导联Neuroscan SynAmps脑电测试系统(version 4.5,NeuroScan,El Paso,Texas,USA)测量受试者在运动任务执行过程中连续的脑电信号。受试者在测试时佩戴64电极点的脑电帽(SynAmps2 Quik-Cap64,USA),电极分布符合10-10国际标准分布[16]。EEG采集使用单极记录方式,将右侧乳突(M2)设置为参考电极。另外,Neuroscan SynAmps记录系统中的一对双极导联用于测量sEMG信号,同时记录了水平眼电和垂直眼电。接地电极置于FPz 和 Fz电极之间的位置。
脑电信号的采样频率设置为1 000 Hz,放大器的带通滤波设置为0.01~100 Hz。在佩戴脑电帽之前,用碱性洗发水去掉头皮屑以及头皮上的油脂成分,然后用电吹风将头发吹干。准备工作完成后,配带脑电帽,令Cz位置对应头的中心点(鼻尖与枕后粗隆连线与左右两耳门连线的交叉点),将导电膏(Quick-GelTM,Compumedics,Inc.,Charlotte,NC,USA)注入到每一个电极中,使所有电极的阻抗都降到5 kΩ以下。在实验过程中,受试者要避免咬牙和乱动,如果受试者在测试过程中需要放松移动身体,可以在收缩间歇时进行调节,并且,在身体调整稳定片刻后再进行正式实验。
2.EEG信号分析
使用NeuroScan 4.5 (Compumedics USA,Inc.) 软件进行脑电信号的离线分析。首先,手动去除伪迹干扰,将带有严重肌电干扰的原始脑电片段手动去除。然后,使用相关法去除眼电伪迹[12]。
本研究观察大脑皮质相关区域的MRCPs电位特征,对于事件发生点来说,很多研究者选取肌电的触发点作为肌肉收缩事件相关点(即0时刻点)[20,28]。还有一些研究者将事件相关点设置为力阈值15 N、 20 N或者20%MVC的点[1,23],但本研究观察的是肌肉疲劳过程中中枢神经系统的变化。因此,以肌电触发激活点为事件相关0时刻点更适合研究疲劳时神经-肌肉的特征关系。
去除伪迹干扰完成之后,将不受干扰的连续脑电信号分成若干4 000 ms的时间段(肌电触发之前的-2 000 ms到肌电触发之后的2 000 ms时间段,-2 000~2 000 ms)。对每段脑电信号要进行基线提取,基线提取的时间窗设置为从-2 000~-1 500 ms,取500 ms内平均幅值。为了进一步降低噪声水平,将每段脑电进行低通滤波,低通截止频率设置为30 Hz。滤波后的分段脑电又使用阈值法再次进行伪迹去除,阈值设定为-80~80 μV,超过这个阈值范围的分段脑电将被去除。然后,将没有干扰的分段脑电进行叠加平均,得到初始MRCPs波形。最后,对初始的MRCPs波形再次进行了处理,将初始MRCPs电位进行整体再平均化参考,得到最终的MRCPs电位,用于统计分析。
在实验次最大随意握力收缩诱发的MRCPs电位中有明显的BP电位以及MP电位,在以往研究的基础之上[18],为了满足本研究的需要,研究者将肌电触发前-1 500~-100 ms看成运动前的准备活动过程。将肌电触发附近的0~150 ms时间窗作为MP电位。以上这两种成分被研究者认为与动作的准备和早期执行有关[1,3,4,28]。
1.5 统计学分析
使用社会学统计软件Spss 16.0对相关数据进行统计学分析。选取最大随意收缩力值(MVC),肌电值(RMS)作为独立变量来评价机体的疲劳情况,使用2×4双因素混合模型方差分析,其中,分组变量:疲劳组(Fatigue)和非疲劳组(Non-fatigue)作为组间变量;模块变量: Block 1、Block 2、Block 3以及Block 4作为组内变量。
对于疲劳过程中大脑皮质的MRCPs分析,使用一般线性混合模型2(分组变量,2个水平)×2 (模块变量,2个水平)×2 (额状面电极,2个水平:额中央区以及中央区)×3 (矢状面电极,3个水平:运动的同侧区、中线区以及运动对侧区)×2 (MRCPs成分,2个水平:RP和MP,受试者内变量)方差分析。6个电极为 FC1,FCz,FC2,C1,Cz,C2。研究者们一致认为,MRCPs电位主要发生器位于前辅助运动区,辅助运动区、前运动皮质区以及初级运动区[28]。以上电极位置的选取建立在峰值电位和以往研究的基础之上: FC1,FC2,FCz和Cz粗略覆盖辅助运动皮质区;C1和C2覆盖初级运动区。

2 结果
2.1 疲劳运动任务过程中肌力与sEMG的变化
疲劳组和非疲劳组受试者在未进行正式收缩前的初始MVC分别为307.7±82.8 N和 299.8±86.4 N,两组之间并没有显著的分组效应[F(1,26)=0.046,P=0.83]。200次收缩结束之后,两组受试者MVC分别下降到231.9±70.6 N(疲劳组)和265.1±73.5 N (非疲劳组)。以肌电激活点和失活点为基础,所有受试者持续收缩的时间为6.2±2.7 s,其中,疲劳组受试者的间歇休息时间为4.5±1.9 s,非疲劳组受试者间歇休息时间为8.2±1.3 s。
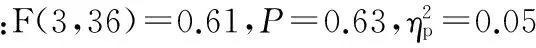
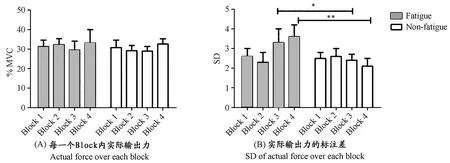
图1 本研究疲劳组与非疲劳组受试者在每一个block内实际输出力以及实际输出力的标注差的变化示意图Figure 1. The Actual Force Level over Each Block and SD of Actual Force over Each Block for Subjects in Fatigue and Non-fatigue Groups
注:* 表示P<0.05,** 表示P<0.001。

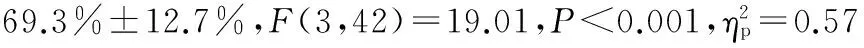
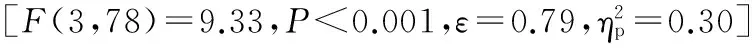

图2 本研究疲劳组与非疲劳组的最大随意收缩力、最大随意收缩力的肌电RMS、每个Block内平均肌电RMS示意图Figure 2. MVC (A),EMG RMS of MVC (B),and Average RMS of EMG over Each Block (C) for Subjects in Fatigue and Non-fatigue Groups

2.2 运动性疲劳过程MRCPs的变化
疲劳组和非疲劳组受试者在疲劳运动任务中,疲劳组受试者在运动后期模块时,MRCPs电位的激活强度和激活区域要比非疲劳组大(图3、图4)。
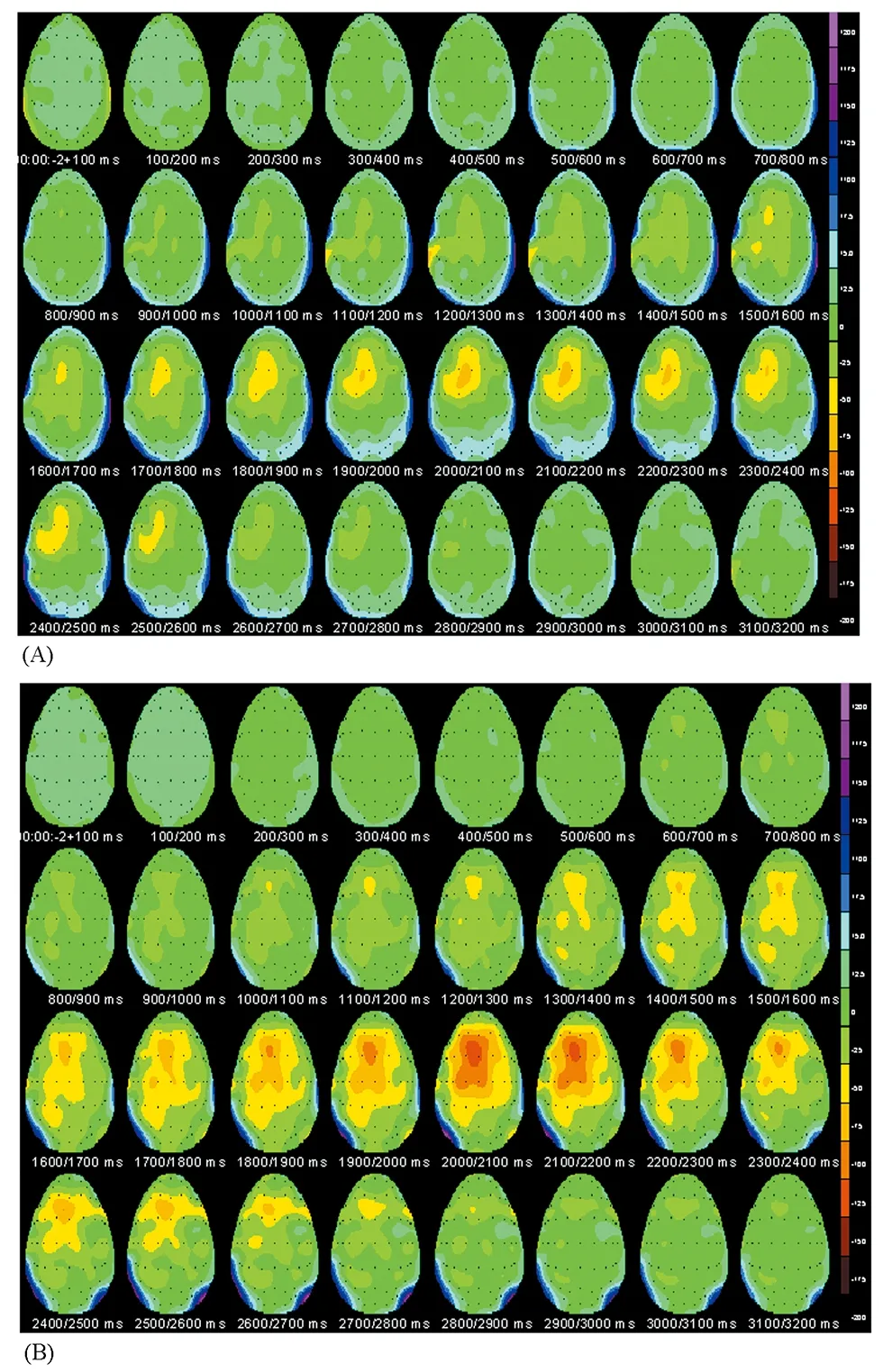
图3 本研究受试者总平均的头皮MRCPs的地形分布示意图Figure 3. Total Average Topography of MRCPs for All Subjects
注:从-2 000 ms开始到运动开始后的1 200 ms结束,每隔100 ms取一个平均值的脑电地形分布图。A图为非疲劳组全部受试者初期运动模块的平均地形分布图;B图为疲劳组全部受试者后期运动模块的平均地形分布图。


鉴于SAG×COR×Group存在显著的交互作用,因此,对肌肉疲劳过程中MRCPs不同成分的在头皮上的分布空间特点进行了描述。

注:F-Early block代表疲劳组初期模块;NF-Early block代表非疲劳组初期模块;F-Late block代表疲劳组后期模块;NF-Late block代表非疲劳组后期模块。

表1 本研究MRCPs幅值的5因素混合模型方差分析一览表Table 1 5-factor Mixed Model ANOVAs on MRCPs
注:COR表示额状面电极;SAG表示矢状面电极。

表2 本研究分组效应对不同模块的RP和MP幅值的影响一览表Table 2 Effects of Group on RP and MP Amplitude in Different Blocks
对于RP电位在额状面的电极分布来说,在肌肉未发生疲劳时,中央区域的RP幅值C1(-3.14±0.51 μV)要显著高于(P=0 .005) C2(-2.06±0.57 μV),但是当肌肉疲劳时,C2的RP负性电位幅值增加,最终使得C1(-3.38±0.62 μV)和C2(-3.14±0.61 μV)之间没有统计学差异。同样,额中央区也表现出与中央区一样的变化特点,也是随着疲劳的产生,RP电位产生向肢体运动的同侧运动。
对于MP电位来说,在矢状面上,不管疲劳组还是非疲劳组,在大脑运动区的对侧、中线以及同侧区域都存在显著性的电极效应。进一步统计分析表明,在肌肉未发生疲劳时,MP幅值在运动区靠前的位置(FC1和FCz) 要显著低于后面的位置(C1和Cz),P<0 .05;但是,当肌肉发生疲劳时,结果相反,运动区靠前位置(FC1和FCz)MP电位的幅值要显著高于后面位置(C1和Cz),P<0.03。说明当肌肉发生疲劳时,MP电位也似乎向运动区前方移动。
3 分析
3.1 运动性肌肉疲劳过程中肌力和sEMG的变化特征
目前,在体育运动中已经有研究者利用肌力同时结合sEMG测量综合评价肌肉疲劳[2,18],这种方法能够有效地评价和理解肌肉疲劳的过程与机制。从本研究结果可以看出,30%MVC的重复性握力收缩方案能够显著地诱发肌肉疲劳。非疲劳组受试者在间歇8 s的方案中并没有引起肌力和肌电显著性的下降,说明非疲劳组的运动方案没有引起受试者肌肉疲劳。
在本研究的运动任务中,疲劳组与非疲劳组受试者都执行30% MVC的次最大强度的握力收缩,要求受试者每次收缩持续6 s,两个实验组运动方案的差别主要在于每次收缩之间的休息时间不同,在本研究中要求疲劳组受试者每次收缩之间的间歇休息时间为4 s,而非疲劳组受试者的间歇休息时间为8 s。从受试者完成的情况来看,虽然两组受试者基本按照实验设计要求都能够达到30% MVC的目标力水平。但是,从本研究的数据能够看出,两组受试者在力输出的平台期时标准差相差比较大,非疲劳组受试者其输出力标准差较小,说明输出力稳定,变异小,而疲劳组受试者的力输出值变异较大。虽然两组在前两个Block平台期输出力的标准差没有统计学差异,但随着疲劳组受试者疲劳程度加深,在Block 3和Block 4两个模块时,疲劳组受试者平台期输出力的标准差显著大于非疲劳组,说明在疲劳后期,疲劳组受试者由于疲劳程度加深,力输出变得不稳定。输出力匹配失误可能与长时间牵拉肌腱中的腱器官而使其敏感性下降有关[13],这使对力量输出调整的能力减弱,所以导致本研究中后期受试者平台期肌力标准差变大。另外,从实验结果观察到,疲劳组受试者在最大随意收缩过程中,最大肌力以及最大肌力对应的标准化肌电RMS值随着疲劳发生发展而显著下降。肌肉疲劳是一种常见的生理现象,运动性肌肉疲劳是指由运动诱发的单块肌肉或者肌群的最大随意收缩力量下降的现象,还有研究者把它定义为机体不能够维持所需或者预定的力量水平。因此,通常将力量、功率或者力矩作为机体肌肉疲劳的直接测试指标,肌肉疲劳时这些指标下降。
在次最大随意收缩诱发肌肉疲劳的运动方案中,规定受试者200次收缩的每一次输出收缩力都要达到30%MVC的目标水平,随着运动的持续进行,肌肉内能源物质消耗得不到及时补充以及代谢产物的堆积,肌肉会发生疲劳。但是,受试者为了每一次收缩都能够达到目标力水平,他们需要不断激活脊髓处更多的运动神经元以便募集更多的肌纤维进而补偿疲劳的肌纤维,进而保证不变的输出力水平。因此,在本研究中发现,在次最大随意收缩中随着疲劳的发生,每个Block内的平均RMS表现为显著性地逐渐增加,次最大随意收缩过程中肌电活动的这种变化也被认为是肌肉疲劳的一种表现。
3.2 MRCPs电位头皮地形图分布
与以前相似的研究相比[23,24,31],本研究中由上肢指屈肌次最大随意等长收缩诱发的MRCPs电位空间分布样式似乎更加靠近内侧分布。这可能是由于握力等长收缩时需要动员前臂主动肌和拮抗肌同时参与收缩,才能产生一定的握力。根据肢体在运动区大脑皮质上的投影分布,越靠近上肢近端其在大脑皮质运动区上的投影越靠近内侧。另外,在肌肉发生疲劳时,可以看出RP电位和MP电位的地形图分布更加靠近头的前部以及运动的同侧。本研究中RP和MP电位的这种地形图变化得到Liu 等人[22]研究结果的支持,他们令受试者进行上肢间断性的最大随意收缩,直至发生疲劳。与此同时,采用溯源分析法对运动产生前的50 ms内的脑电信号进行了分析发现,与非疲劳组相比,这段时间内的脑源偶极子向大脑前部以及运动同侧大脑半球移动。但是,他们只对运动前准备阶段的脑源信号进行了研究,并没有对动作执行时的脑源进行分析。
从MRCPs电位的地形图分布来看,本研究发现,与非疲劳组受试者相比,疲劳组受试者感觉运动皮质区MRCPs的激活强度和激活区域变大。这一发现与fMRI的结果一致,Liu等人[21]设计了一个2 min最大握力收缩实验,发现,在运动的前1 min,感觉运动皮质的fMRI成像中激活像素数目增加,这种激活区域的扩大被认为是由于激活了额外的神经元引起的,进而补偿肌肉疲劳时引起的力量不足。在本实验中,随着肌肉的疲劳,受试者动员了大脑感觉运动区内更多的神经元区激活脊髓处更多的运动神经元,进而弥补疲劳引起的肌肉力量不足。所以,在本研究中,疲劳组受试者的头皮地形分布图表现出更大的激活区域,而且,有向运动同侧和大脑前部移动的趋势。另外,在本研究中,MRCPs电位的幅值也增加,这种变化可能也是补偿肌肉力量不足而产生的中枢变化。
3.3 运动性肌肉疲劳对运动皮质区MRCPs的影响
目前,研究者们发现,与随意运动相关的最明显的头皮电位是BP(Bereitschaftspotential)或者RP(Ready potential)[20,27]。这个电位开始于运动前,可以理解为运动之前的大脑皮质准备过程。在本实验研究中,与非疲劳组受试者比较,尽管疲劳组受试者在运动任务的早期时已经产生了明显的肌肉疲劳现象,但是,RP幅值并没有显著性差异。然而,随着运动任务的进行,在任务的后期时,RP幅值呈现出疲劳组和非疲劳组之间显著的差异,但也仅仅在FC1位置才表现出疲劳组受试者RP幅值显著高于非疲劳组受试者。Liu等人[23]研究发现,在最大随意收缩诱发的上肢肌肉疲劳任务中,受试者在运动任务的准备时相MRCPs电位幅值和脑电信号功率都没有显著变化。他们认为,该研究结果支持他们以前的假设,即动作准备时相的脑电信号不会随着疲劳而发生变化。基于此,学者提出了一个假设模型,认为,运动前准备时相的活动主要涉及注意力[27]。顶区、扣带回以及前额区的联合皮质被认为是调节注意力的主要皮质区域,并且很有可能就是注意力的发生源[10]。
导致运动前大脑产生活动的另一个原因可能源自准备相位信号,这个信号可能仅仅来自在运动动作之前才产生活动的相位神经元。这些神经元可能仅仅在运动之前简单地激活一下,目的是激活位于初级运动皮质区的输出神经元发出神经冲动让执行神经元去执行运动任务。这些时相细胞可能位于次级和/联合运动皮质内。例如,Cadoret 和Smith[5]发现,在猴子大脑的辅助运动区和扣带回运动区的很多神经细胞在肌力产生之前放电率增加,但是在力量维持阶段,其中大多数细胞是处于安静状态的。他们在这两个区域记录到的细胞,高于60%的细胞是在手指肌力产生前表现为时相性放电(即该神经细胞只在运动前产生电活动),只有10%的神经细胞在肌肉持续收缩阶段是强直性激活的(即在持续收缩阶段神经细胞持续产生电活动),大约有13%的神经细胞为时相性兼强直性放电,它们在运动前和持续运动阶段都一直放电。可能位于次级和/联合皮质区与注意力相关的相位放电的神经元在疲劳运动任务中不容易疲劳,因为,它们总是在运动之前简单地被激活一下,然后就休息,所以,不容易疲劳,这可能可以解释为什么在疲劳过程中,运动前各个电极位置的RP电位没有明显变化。
已经有学者[1,11,18,26]通过比较重复性运动的初期和后期两个模块发现,运动后期模块运动电位的RP成分显著高于运动初期模块。在他们的实验设计中,肌肉疲劳也是通过重复性的次最大随意收缩诱发的。Schillings 等人[26]认为,这种重复性的运动本身可能会导致RP幅值增加,因为,在重复性运动中,受试者的认知需求增加可能会导致RP电位幅值增加。在Schillings等人的研究中发现,受试者在执行70%MVC的握力收缩实验时,中央运动区的RP电位幅值显著增加,同时发现,外周肌肉仅仅产生了很小的疲劳。由长时间运动引起的RP电位幅值这种变化可能被解释为由身体运动过程中认知需求增加引起的,认知需求增加弥补了在重复性收缩过程中大脑皮层效率的下降,而不是肌肉疲劳引起的RP幅值变化。这个观点也受到Freude和Ullsperger[11]研究的支持,他们发现,受试者在执行80%MVC和20%MVC的重复性收缩时,RP电位曲线围成的面积显著增加,但是,在50%MVC强度时并没有变化,研究者推测在80%MVC和20%MVC收缩强度下,RP幅值增加可能与受试者“参与意图”增加有关,因为相对来说,在这种力量水平下完成这些收缩对于受试者来说难度更大,需要付出更多地运动意图,而50%MVC收缩强度对于受试者来说比较容易完成, 不需要付出那么多地注意力或者不需要较高的意图参与其中。因此,更多的用力认知成分增加可能是导致RP电位幅值增加的原因。
在本研究中,RP电位幅值在运动早期时,疲劳组和非疲劳组之间没有显著性差别可能与在运动早期用力的认知成分没有差别有关,而与疲劳无关,因为,在运动方案早期的时候,疲劳组受试者与非疲劳受试者相比,已经明显发生了疲劳;在运动后期疲劳组,受试者RP电位幅值要显著高于非疲劳组,这可能与疲劳组受试者在肌肉疲劳时完成同样的目标输出力时相对来说难度更大了有关,例如,在肌肉疲劳时受试者依旧要保持精确的收缩时机、准确的力量水平以及保持工作记忆,这可能需要受试者付出更多的用力认知成分,所以导致后期RP电位幅值显著增加。
本研究非疲劳组受试者的RP电位在整个重复性次最大随意收缩过程中并没有发生显著变化,暗示30%MVC强度的收缩,间歇休息8 s的重复性运动可能不会诱发更多的用力认知成分参与其中,正如Jahanshahi等[15]指出的,RP电位幅值对不同的实验设计表现出不同的敏感性。
研究者发现,在动作触发时总是伴随一个峰值负电位,有研究认为,该电位与运动动作执行有关[27]。Hallett[14]将MP电位看成是NS’电位后续发展的一部分,他们也认为该电位与动作早期执行有关。Cunnington等人[6]取运动前-1 500~-500 ms作为MRCPs的早期成分,来反应运动前的准备活动。取动作开始附近的MRCPs峰值负电位作为晚期成分。研究还发现,在执行运动任务时该峰值成分很明显而在运动想象时未出现。所以,他们认为,该峰值负电位与实际运动执行有关。Cunnington等人[6]认为,运动触发附近的MRCPs峰值电位反应的是大脑对运动动作的执行。Woldag等人[32]发现,在积极主动的运动中出现了MP电位,但是,在被动运动中没有MP电位,说明MP电位与随意运动执行有关。
本研究发现,MP电位幅值随着肌肉疲劳的发生和发展显著增加。目前,已有研究者对肌肉疲劳或者肌肉无力现象对大脑运动皮质的MP电位幅值影响进行了研究[16,18,24,29]。Shibata等[29]通过动脉闭塞技术诱发受试者在运动任务中肌肉无力的现象,等同于肌肉疲劳肌力下降的效果。他们发现,在肌肉收缩前大脑皮质的负性电位活动没有显著变化,但是在动作执行阶段的MP电位幅值却显著增加,同时伴随着肌电活动显著增加。有研究者认为,由动脉闭塞诱发的动作执行阶段大脑皮质电位活动增加可能反映出大脑通过募集更多地运动神经元从而补偿肌肉力量的下降。同样,Jankelowitz和Colebatch[16]通过肌细胞内麻醉使肌肉力量下降,发现在动作执行阶段的MP电位幅值发生了显著变化,而RP电位只有较小的变化。另外,Morree等人[24]设计了一个受试者上肢提拉重物直至疲劳的实验发现,受试者只在动作执行阶段时的皮质电位活动发生了变化,且只发生在了Cz位置。他们采用等动训练手段诱发肌肉疲劳,然后,再测试脑电,这样做的目的是为了消除长时间重复性运动对RP电位带来的影响,发现即使肌肉疲劳了,RP电位也没有发生显著变化,而MP电位幅值显著增加了。但是,他们的这种实验设计可能会使疲劳效应降低,因为,佩戴脑电帽以及注射导电膏也要耗费一段时间,这些工作做完后可能会使疲劳得到了恢复。除此之外,Johnston[18]也发现,肌肉疲劳只对MP电位幅值产生了影响。结合以上学者的研究成果,本研究认为,肌肉疲劳主要影响运动执行电位MP。
4 结论
本研究使用疲劳和非疲劳分组基础之上的混合实验设计模型,发现在动作执行阶段,大脑辅助运动区、初级运动皮质区电活动水平随着肌肉疲劳的发生逐渐增强。运动皮质区MRCPs电位的分布似乎随着肌肉的疲劳向大脑的前部以及运动同侧大脑半球区域移动。机体大脑中枢可能通过这两条途径来弥补长时间运动过程中肌肉疲劳时引起的肌肉力量下降。另外,运动执行电位与肌肉疲劳密切相关,而运动前准备电位受肌肉疲劳影响较小。
[1]BERCHICCI M,MENOTTI F,MACALUSO A,etal.The neurophysiology of central and peripheral fatigue during sub-maximal lower limb isometric contractions[J].Front Hum Neurosci,2013,7:135.
[2]BLACKWELL J R,KORNATZ K W,HEATH E M.Effect of grip span on maximal grip force and fatigue of flexor digitorum superficialis[J].Applied Ergonomics,1999,30(5):401-405.
[3]BOZZACCHI C,GIUSTI M A,PITZALIS S,etal.Similar cerebral motor plans for real and virtual actions[J].PLoS One,2012,7(10):e47783.
[4]BOZZACCHI C,GIUSTI M A,PITZALIS S,etal.Awareness affects motor planning for goal-oriented actions[J].Biol Psychol,2012,89(2):503-514.
[5]CADORET G,SMITH A M.Comparison of the neuronal activity in the SMA and the ventral cingulate cortex during prehension in the monkey[J].J Neuro,1997,77(1):153-166.
[6]CUNNINGTON R,IANSEK R,BRADSHAW J L,etal.Movement-related potentials associated with movement preparation and motor imagery[J].Exper Brain Res,1996,111(3):429-436.
[7]DESMURGET M,SIRIGU A.A parietal-premotor network for movement intention and motor awareness[J].Trends Cognitive Sci,2009,13(10):411-419.
[8]DIRNBERGER G.Habituation in a simple repetitive motor task:A study with movement-related cortical potentials[J].Clin Neuro,2004,115(2):378-384.
[9]DIRNBERGER G,DUREGGER C,TRETTLER E,etal.Fatigue in a simple repetitive motor task:A combined electrophysiological and neuropsychological study[J].Brain Res,2004,(1):26-30.
[10]FERNANDEZ-DUQUE D,POSNER M I.Brain imaging of attentional networks in normal and pathological states[J].J Clin Exper Neuropsychol,2001,23(1):74-93.
[11]FREUDE G,ULLSPERGER P.Changes in Bereitschaftspotential during fatiguing and non-fatiguing hand movements[J].Eur J Appl Phys Occupat Phys,1987,56(1):105-108.
[12]GRATTON G,COLES M G,DONCHIN E.A new method for off-line removal of ocular artifact[J].Electroencephalography Clin Neuro,1983,55(4):468-484.
[13]GREGORY J E,PROSKE U.Responses of tendon organs in a lizard[J].J Phys,1975,248(2):519-529.
[14]HALLETT M.Movement-related cortical potentials[J].Electromyography Clin Neurophysiol,1994,34(1):5-13.
[15]JAHANSHAHI M,JENKINS I H,BROWN R G,etal.Self-initiated versus externally triggered movements I.An investigation using measurement of regional cerebral blood flow with PET and movement-related potentials in normal and Parkinson's disease subjects[J].Brain,1995,118(4):913-933.
[16]JANKELOWITZ S,COLEBATCH J.Movement related potentials in acutely induced weakness and stroke[J].Exper Brain Res,2005,161(1):104-113.
[17]JASPER H H.The ten twenty electrode system of the international federation[J].Electroencephalography Clin Neurophysiol,1958,10:371-375.
[18]JOHNSTON J,REARICK M,SLOBOUNOV S.Movement-related cortical potentials associated with progressive muscle fatigue in a grasping task[J].Clin Neuro,2001,112:68-77.
[19]KELLIS E,KELLIS S.Effects of agonist and antagonist muscle fatigue on muscle coactivation around the knee in pubertal boys[J].J Electromyography Kinesiol,2001,11(5):307-318.
[20]KORNHUBER H H,DEECKE L.Changes in the brain potential in voluntary movements and passive movements in man:readiness potential and reafferent potentials[J].Pflugers Archiv fur Die Gesamte Physiologie des Menschen und der Tiere,1965,284:1-17.
[21]LIU J Z,DAI T H,SAHGAL V,etal.Nonlinear cortical modulation of muscle fatigue:A functional MRI study[J].Brain Res,2002,957(2):320-329.
[22]LIU J Z,LEWANDOWSKI B,KARAKASIS C,etal.Shifting of activation center in the brain during muscle fatigue:An explanation of minimal central fatigue?[J].NeuroImage,2007,35(1):299-307.
[23]LIU J Z,YAO B,SIEMIONOW V,etal.Fatigue induces greater brain signal reduction during sustained than preparation phase of maximal voluntary contraction[J].Brain Res,2005,(1-2):113-126.
[24]MORREE H M,KLEIN C,MARCORA S M.Perception of effort reflects central motor command during movement execution[J].Psychophysiol,2012,49(9):1242-1253.
[25]POPIVANOV D,MINEVA A,DUSHANOVA J.Single-trial readiness potentials and fatigue[J].Adv Exp Med Biol,1995,384:295-304.
[26]SCHILLINGS M,KALKMAN J,VAN DER WERF S,etal.Central adaptations during repetitive contractions assessed by the readiness potential[J].Eur J Appl Phys,2006,97(5):521-526.
[27]SHIBASAKI H,BARRETT G,HALLIDAY A M,etal.Scalp topography of movement-related cortical potentials[J].Progress Brain Res,1980,54:237-242.
[28]SHIBASAKI H,HALLETT M.What is the bereitschaftspotential?[J].Clin Neuro,2006,117(11):2341-2356.
[29]SHIBATA M,ODA S,MORITANI T.The relationships between movement-related cortical potentials and motor unit activity during muscle contraction[J].J Electromyography Kinesiol,1997,7(2):79-85.
[30]SIEMIONOW V,FANG Y,CALABRESE L,etal.Altered central nervous system signal during motor performance in chronic fatigue syndrome[J].Clin Neuro,2004,115(10):2372-2381.
[31]SLOBOUNOV S,HALLETT M,NEWELL K M.Perceived effort in force production as reflected in motor-related cortical potentials[J].Clin Neuro,2004,115(10):2391-2402.
[32]WOLDAG H,WALDMANN G,SCHUBERT M,etal.Cortical neuromagnetic fields evoked by voluntary and passive hand movements in healthy adults[J].J Clin Neuro,2003,20(2):94-101.
[33]ZWARTS M,BLEIJENBERG G,VAN ENGELEN B.Clinical neurophysiology of fatigue[J].Clin Neuro,2008,119(1):2-10.
Changes of Movement-related Cortical Potentials in Motor Cortex Areas during Exercise-induced Muscle Fatigue
GUO Feng
Objective:To examine the changes of movement-related cortical potentials (MRCPs) in motor cortex areas induced by submaximal voluntary isometric fatiguing contractions of flexor digitorum.Methods:15 subjects in fatigue group and 13 subjects in non-fatigue group performed 200 repeated 30% MVCs isometric contractions of flexor digitorum,accompanying by measurements of muscle force,surface electromyography (sEMG),and electroencephalography (EEG).The 200 contractions were divided by 4 blocks,to observe the changes of maximal handgrip force and RMS of sEMG.And the 200 contractions were divided by 2 large blocks,to analyze the MRCPs distracted from EEG.Results:Subjects from the fatigue group during muscle fatigue showed significant decrease of the maximal handgrip force (P<0.001) and RMS of sEMG (P<0.001),accompanying the significant increase of average RMS over 4 blocks.With the development of muscle fatigue,the amplitudes of motor potential (MP) and readiness potential (RP) significantly increased.However,these measurements did not present significant changes.In addition,compared with the non-fatigue group,the MRCPs site in the fatigue group presented the shift to anterior and ipsilateral brain areas.Conclusion:During the muscle fatigue induced by submaximal voluntary isometric contractions of flexor digitorum,the activation strength and activation areas of MRCPs in brain motor cortex areas increases,and the activation site of MRCPs presents a tendency of shift to anterior and ipsilateral brain areas,suggesting a central strategy to compensate the loss of force.In addition,muscle fatigue has more effects on the MP than the RP.
exercise-inducedmusclefatigue;handgrip;motorcortexareas;event-relatedpotential(ERP);movement-relatedcorticalpotentials(MRCPs)
1000-677X(2015)04-0042-10
10.16469/j.css.201504005
2014-11-18;
2015-03-06
辽宁省教育厅一般科学研究项目(L2012412)。
郭峰(1982-),辽宁凌海人,讲师,博士,主要研究方向为运动性疲劳的中枢机制以及神经肌肉控制的电生理学,E-mail:guofeng_first@aliyun.com。
沈阳体育学院 运动人体科学学院,辽宁 沈阳 110102 Shenyang Sport University,Shenyang,110102,China.
G804
A
