环介导等温扩增技术及其在病原生物检测中的应用
2015-02-14黄枝妙综述翁育伟审校
黄枝妙(综述),翁育伟(审校)
环介导等温扩增技术及其在病原生物检测中的应用
黄枝妙(综述),翁育伟(审校)
环介导等温扩增(LAMP)技术是近年来发展起来的一种新型核酸扩增技术,具有操作简便、快速、特异性高、灵敏性高等特点,自2000年开发以来,在短短的十几年内被广泛应用于细菌、病毒和寄生虫等病原生物的检测,在即时检验和基层实验室推广中有重要意义。
环介导等温扩增;病原生物;检测
病原生物的检测有传统分离培养、血清学检测和核酸检测等。传统分离培养方法耗时长而且易出现污染和漏检现象;血清学检测方法会出现非特异性交叉反应,造成判断困难,且在疾病较早期易出现假阴性;相比之下,以病原体核酸靶序列扩增为基础的核酸检测方法不但所需时间短而且敏感性、特异性强,已被广泛应用于临床检验医学和新发传染病检测等领域。核酸扩增技术主要分为以常规PCR为基础的变温扩增以及等温扩增两大类。其中变温扩增技术需要经过变性、退火、延伸等步骤多次循环,在此过程中反复升温降温,不但对仪器要求比较高,而且反应耗时较长,不利于节省时间成本。等温扩增技术所需温度恒定,利用水浴或金属浴就可以实现,所需时间短。等温扩增技术包括很多种:依赖于核酸序列的扩增技术(nucleic acid sequence-based amplification,NASBA)[1]、滚环扩增技术(rolling circle amplification,RCA)[2]、链替代扩增技术(strand displacement amplification,SDA)[3]和环介导等温扩增技术(loop mediated isothermal amplification,LAMP)[4]等。其中,近些年来使用比较广泛、发展比较快的是环介导等温扩增,该技术操作简便、快速、特异性高、灵敏性高,在短短十几年内被广泛应用于细菌、病毒、寄生虫等病原生物的检测,在即时检验和基层实验室推广中有重要意义。
1 LAMP技术介绍
1.1 LAMP技术原理 环介导等温扩增技术是由日本的Notomi等[4]于2000年开发的一种新型核酸扩增技术,该技术使用了一种特殊的链置换型DNA聚合酶(Bst-DNA polymerase),该酶能够在恒温(60~65℃)条件下以双链DNA中的一条链为模板合成新链,并将另外一条链替换掉。LAMP技术针对靶基因的六个区域设计两条内引物和两条外引物,可在15min~60min内对目的基因实现109~1010倍的扩增,如果同时采用两条环状引物,还可以促进目的片段的扩增,大大提高反应速度[5]。LAMP技术针对6个不同区域设计的4条特殊引物,分别为上游外引物F3、上游内引物FIP、下游外引物B3和下游内引物BIP,其中,内引物FIP包含F1c和F2,两者可以直接相连或者以TTTT连接;内引物BIP包含B1c和B2,两者可以直接相连或者以TTTT连接。
LAMP扩增过程主要分为两个阶段:起始阶段和扩增循环阶段。
起始阶段:在LAMP扩增体系中,由于内引物的Tm值和浓度都大于外引物,所以内引物会先于外引物结合到模板上并延伸产生子链,之后外引物结合到模板,并通过子链的延伸将内引物链置换下来。经过FIP (F1c+F2)、F3、BIP (B1c+B2)、B3四个引物先后作用,最终被置换出的互补链结构为3′-F1-F2c-F1c……B1-B2-B1c-5′,其中F1和F1c互补,B1c和B1互补,形成两端环状的哑铃状模板结构,该结构是LAMP基因扩增循环的起始结构(见图1)。

图1 起始阶段Fig.1 Starting material producing step
扩增循环阶段:在这一阶段中外引物不再起作用,内引物继续引导链置换延伸。哑铃状结构以3′末端的F1区段为起点,以自身为模板,进行DNA合成延伸形成茎环状结构,FIP(F1c+F2)中的F2区与茎环处的F2c区结合,开始链置换合成,解离出的单链核酸上也会形成环状结构,迅速以3′末端的B1区段为起点,以自身为模板,进行DNA合成延伸及链置换,结果形成长短不一的2条新茎环状结构的DNA,然后BIP(B1c+B2)引物上的B2区与其杂交,启动新一轮扩增。每进行一次扩增产物DNA长度增加一倍,扩增的最后产物是具有不同个数茎环结构、不同长度DNA的混合物(见图2)。
1.2 LAMP引物设计原则 LAMP是通过两对引物对6个不同区域的识别进行扩增的,因此对引物设计要求比较高。影响LAMP引物设计的因素主要有Tm值、引物末端稳定性、GC含量、二级结构和引物间距。(1)Tm值采用Nearest-Neighbor算法,F1c和B1c的Tm值约65℃(64 ℃~66 ℃),F2、B2、F3和B3的Tm值约60 ℃(59 ℃~61 ℃),环引物的Tm值约65℃(64 ℃~66 ℃);(2)引物末端做为DNA合成的起始位点,需要有一定的稳定性,F2/B2,F3/B3和LF/LB的3′端以及F1c/B1c的5′端的自由能要≤-4 kcal/mol;(3)引物的GC含量要控制在40%~65%之间,以50%~60%为最佳;(4)设计引物时要避免二级结构产生,为了防止引物二聚体形成还要确保3′端不与其他序列互补并极力避免AT富集;(5)LAMP的扩增区域为F2~B2区段,最好在130 bp~200 bp之间,过长或过短都会影响扩增效率,最长300 bp,不可超过500 bp,否则会严重影响扩增效率。最理想的引物间距是:F2的5′端和B2的5′端相距120~160 bp,F2的5′端与F1c的3′端(B2的5′端与B1c的3′端)相距40~60 bp,F3的3′端和F2的5′端(B3的3′端和B2的5′端)相距0~60 bp。
目前,已经有针对LAMP引物设计的在线软件出现。试验者只要根据需要选择合适的目的基因,在NCBI等数据库中检索出目的基因核苷酸序列,提交到Primer-Explorer V4(http://primerexplorer.jp/e/)设计相应的LAMP引物,然后通过Primer 5.0或oligo 7等软件进行分析,确保引物之间无二聚体形成,最后再通过BLAST检验引物的特异性。
1.3 LAMP反应体系 LAMP反应体系:两对内外引物、dNTP、甜菜碱、Tris-HCl(pH 8.8)、KCl、(NH4)2SO4、MgSO4、Triton X-100、模板、Bst-DNA聚合酶。体系中会对LAMP反应结果产生影响的几个比较重要的因素有:(1)Bst-DNA聚合酶:具有链置换活性,在延伸新链的同时可以将下游旧链剥离。(2)内外引物浓度比例:内外引物浓度比对LAMP扩增体系影响重大,因此,除了引物Tm差异外,内引物的浓度要大于外引物浓度,这样才能先于外引物结合到模板上。一般情况下外引物和内引物的浓度比在1/4~1/10之间。(3)甜菜碱浓度:甜菜碱可以使双链DNA处于解链的动态平衡中,从而提高反应的扩增效率。(4)镁离子浓度:镁离子浓度太低会降低聚合酶活性,影响反应的进行,浓度太高又会降低反应的特异性。因此,反应必须对镁离子浓度进行优化。(5)dNTP浓度:dNTP是核酸合成的底物,浓度低,底物不足,影响反应进行,浓度过高,过量的dNTP会与镁离子螯合,影响酶活性。
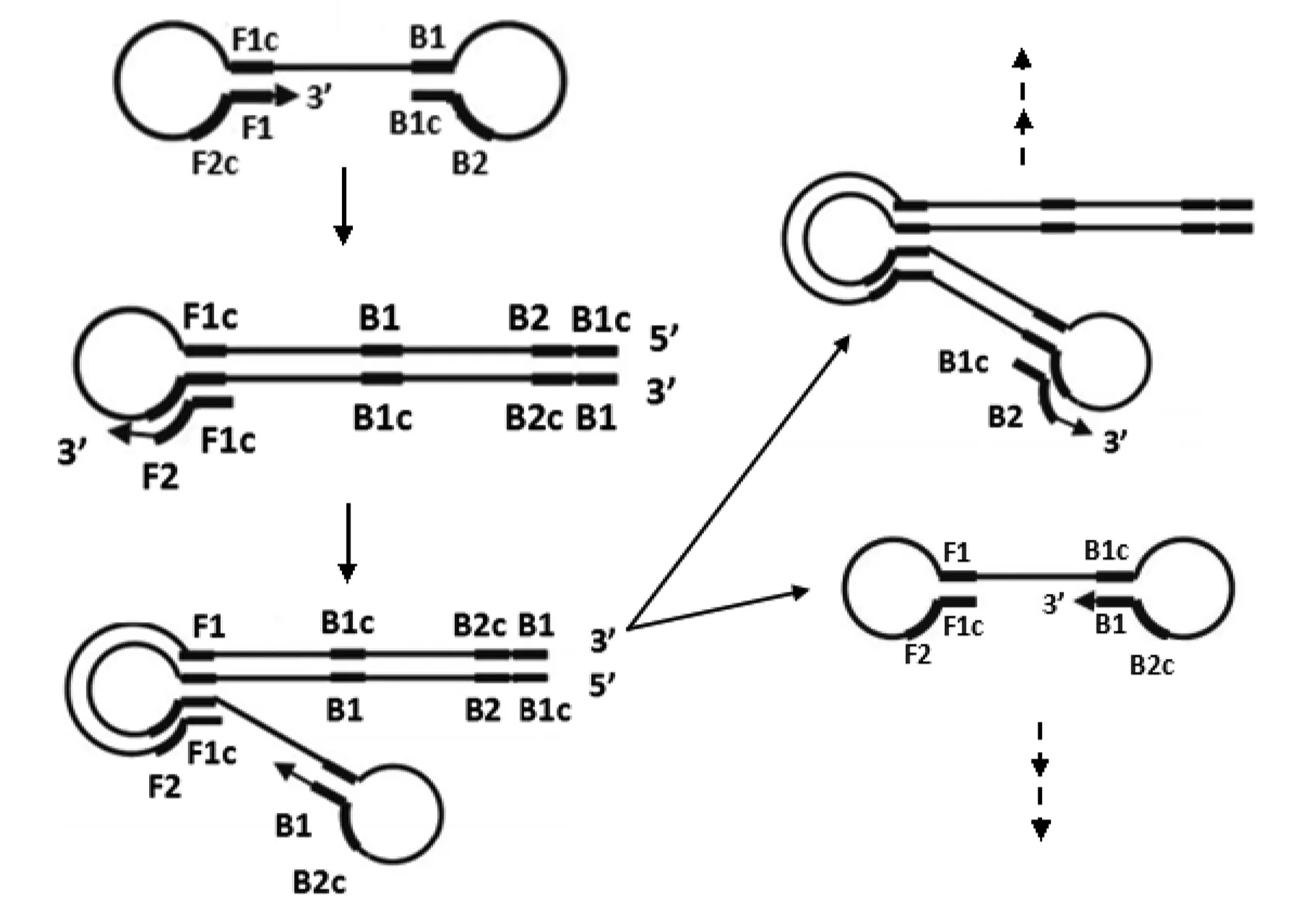
图2 扩增循环阶段Fig.2 Amplification and cycling step
1.4 LAMP产物鉴定方法
1.4.1 白色沉淀 DNA复制过程中,当一个dNTP结合到DNA链上的同时会解离下一个焦磷酸根离子,该离子与反应液中的镁离子结合可产生白色焦磷酸镁沉淀。由于环介导等温扩增过程中,DNA进行大量复制,所产生的焦磷酸根离子与镁离子结合可产生大量的焦磷酸镁沉淀,因而在反应的末期通过肉眼就可以观察到白色沉淀。但是通过肉眼观察主观性和不确定性较大,且阳性样品的浑浊度维持的时间相对短暂,因而宜在反应结束后尽快进行观察。此外,可以通过浊度仪,实时检测管内的浊度变化。但由于焦磷酸镁沉淀颗粒大小不均一,空间分布不均匀,样品达到最高浑浊度前焦磷酸镁颗粒可能重新溶解,这些因素同样会影响实时浊度仪的检测结果[6]。
1.4.2 金属离子指示剂 LAMP反应过程中会解离出焦磷酸根离子,焦磷酸根离子又会与反应液中的镁离子结合产生白色沉淀。因此,根据反应液中镁离子或焦磷酸根离子浓度的变化可以间接判断产物的扩增情况,这种间接染色法比较常用的是钙黄绿素和羟基萘酚蓝离子指示剂[7]。(1)钙黄绿素:这种检测方法是在反应液中加入钙黄绿素和锰离子,扩增反应进行前钙黄绿素与锰离子结合处于淬灭状态,溶液为橙色,而在扩增反应过程中产生的焦磷酸离子可与锰离子结合,导致钙黄绿素释放,淬灭状态解除发出黄绿色荧光。(2)羟基萘酚蓝:反应前将羟基萘酚蓝加入到反应液中,溶液呈紫罗兰色,反应过程中镁离子与反应副产物焦磷酸根离子结合产生大量沉淀,镁离子浓度降低,pH发生变化,从而使羟基萘酚蓝的颜色变为天蓝色。金属离子指示剂检测的灵敏度比白色沉淀法高,但同样要通过肉眼观察判断,同样会存在一些主观误差,而且由于指示剂在反应前加入,会在一定程度上对扩增反应产生抑制。
1.4.3 DNA嵌入染料 DNA嵌入染料具有特定的分子结构,可以选择性的结合到双链DNA分子上,常见的DNA嵌入染料有SYBR Green I和溴化乙锭等。1)实时荧光检测:游离的SYBRGreen I发出微弱的绿色荧光,但与DNA双链结合后荧光会大大增强,荧光信号强度与双链DNA的数量相关。反应前在体系中加入SYBRGreen I,通过实时荧光检测仪可以检测出体系中双链DNA的扩增情况。这种方法可以实时快速地检测反应情况,但SYBRGreen I会抑制LAMP反应。2)凝胶电泳检测:溴化乙锭也是一种常用的核酸荧光染料,可嵌入核酸双链的配对碱基之间,在紫外线激发下发出红色荧光。LAMP产物与溴化乙锭结合进行凝胶电泳检测,会出现特异性梯形条带,由于可以对条带大小进行判定,所以这种方法的特异性较高,但会加大工作量且容易造成污染。
1.4.4 随着LAMP技术的快速发展,除了以上几种比较常见的鉴定方法外,还出现了很多新的鉴定方法:横向流动试纸条技术(LAMP-LFD)[8]、酶联免疫吸附(LAMP-ELISA)[9]、电化学方法、NanoAu探针、场效应传感器、表面等离子共振传感器、扩增子吸光度、生物荧光、巨磁阻传感器等。
1.5 LAMP技术优缺点
1)高效性:由于LAMP在等温条件下进行,无需像常规PCR反应那样反复升降温造成时间损失,一般在1h内即可完成扩增,使靶序列达到109个拷贝[4]。如果使用环引物还可以缩短一半的扩增时间。这对临床,尤其是应急检测具有重要的意义。2)高灵敏度:LAMP反应对模板的要求不高,几乎不受反应液中存在的大量外源DNA和其它杂质的影响,对模板DNA无需纯化,甚至只要将样品超声裂解即可用来检验,检出率比普通PCR高1~2个数量级。3)高特异性:针对靶基因的6个区域设计4条引物,6个区域中任一区域不匹配都无法进行扩增,这就决定了扩增的高特异性。4)成本低廉:LAMP反应温度恒定,只需要水浴锅或金属浴就可以实现这个条件,所需仪器成本低,便于在基层单位进行推广。5)实验结果可视化:可直接用肉眼观察扩增管的浊度,或者添加荧光染料通过颜色变化对实验结果进行判定。6)通过与反转录技术结合,LAMP技术也可以高效扩增RNA序列。RT-LAMP方法可以先将RNA反转录成cDNA再进行LAMP扩增,也可以直接在LAMP反应液中直接加入逆转录酶。7)缺点:扩增灵敏度高,效率高,易受到污染产生假阳性,应尽量避免或减少开盖;对引物要求高,有些基因序列比较难设计出合适的引物;扩增片段一般不超过300 bp,不能进行长片段DNA扩增。
2 LAMP技术在病原生物检测中的应用
2.1 细菌检测 甲类传染病鼠疫和霍乱都是由细菌引起的,近些年来随着卫生条件的改善,这两种疾病在人类中已经比较罕见,但在世界范围内的自然疫源地并未缩小,对于卫生条件较差的贫困地区,仍然存在暴发的可能性,所以仍需对其进行监测,不能掉以轻心。除此之外,在空气、水源和食物等与人类息息相关的事物中同样存在着一些其它致病细菌,细菌性疾病仍然对人体的健康造成很大的威胁。传统的细菌培养是细菌检测最常用的方法之一,然而细菌培养方法不仅繁琐,而且耗时长,例如,严重危害人类健康的结核分枝杆菌,生长缓慢,一般2~4周才可见菌落生长,影响疾病的确诊。LAMP技术不但操作方便,易于在自然疫源地开展检测活动,而且反应速度快,在临床诊断上有重要的意义,在30~35 min内即可完成对肺结核的检测[10]。目前LAMP技术已经被用于多种致病菌的检测当中,例如,霍乱弧菌[11]、沙门氏菌[12]和金黄色葡萄球菌[13]等,除此之外,结核杆菌、嗜肺军团菌和艰难梭菌等已经有了商品化的LAMP恒温快速检测试剂盒。
2.2 病毒检测 病毒的变异速度相对比较快,特别是RNA病毒,近些年来出现很多新发传染病,基本上都是病毒性疾病。为了有效防止病毒性疾病的传播感染,需要建立一种能够对病毒进行快速检测的方法。传统的病毒分离培养方法和血清学鉴定耗时较长,所以一般先采用分子生物学核酸检测的方法对其进行鉴定,而相比于普通PCR和实时荧光定量PCR,LAMP技术所需时间更短,能够更加快速地检测出病毒核酸。在LAMP技术出现的这十几年来,很多研究者已经将其广泛应用于各种病毒性疾病的检测当中。
2007年,Kurosaki等[14]建立了快速检测扎伊尔埃博拉病毒的RT-LAMP方法,该方法可以在26 min内检测到20个拷贝的人工合成的扎伊尔埃博拉病毒RNA,或者10-3FFU的传代细胞培养病毒。2013年,Yiyue Ge等[15]对HA基因和NA基因进行扩增,建立了检测H7N9病毒的RT-LAMP-LFD方法,通过对80份H7N9疑似病例临床样本进行检测,发现其敏感性和特异性与实时荧光定量PCR相比均达到了100%。2014年,Shirato等[16]建立了检测MERS-CoV的RT-LAMP方法,能够检测出低至3~4个拷贝的RNA,具有高度的特异性,且不会与其它呼吸道病毒产生交叉反应。2012年,Kai Nie等[17]利用直接热处理原始样品进行RT-LAMP的方法检测出咽拭子中的EV71病毒C4亚型,其敏感性和特异性与提取完RNA再进行RT-LAMP的方法相比分别为90.3%和100%,与qRT-PCR相比为86.83%和100%。除此之外,国内外许多研究者也成功地使用LAMP技术检测出诺如病毒[18]、新布尼亚病毒[19]、登革热病毒[20]和人乳头瘤病毒[21]等,LAMP技术在病毒性疾病的检测中有广阔的前景。
2.3 寄生虫检测 在一些偏远地区或者是野外,卫生环境比较差,容易引发寄生虫病的感染。而LAMP技术操作方便,可省去DNA抽提环节,用肉眼观察浑浊度可做出定性判断,为寄生虫病的现场流行病学调查提供了方便。目前,LAMP技术在寄生虫包括原虫、蠕虫乃至其宿主的检测中得到了应用。疟疾是全球三大公共卫生问题之一,2014年,江再茂等[22]针对恶性疟原虫核糖体DNA的序列保守区设计LAMP引物,成功地检测出了血液中的恶性疟原虫,克服了传统血膜染色法费时、费力且容易漏诊、误诊的缺点。2014年,陈璐等[23]针对棘球绦虫ND2基因设计引物,建立LAMP检测方法,鉴别出多房棘球绦虫和细粒棘球绦虫这两个相近的种属,且不与其它待检寄生虫发生交叉反应,最低检测限度为40拷贝。此外,对刚地弓形虫[24]、利什曼原虫病[25]、布鲁格丝虫病[26]、泰国肝吸虫[27]等进行LAMP检测的方法也已经建立起来,并得到不断深入的研究。
2.4 与其他技术联合应用 由于LAMP技术反应条件温和,敏感性强,特异性高,反应速度快等特点,人们将其与其他技术联合应用,开发了一些很有意义的检测病原生物的方法。Jung等[28]将多重RT-LAMP和免疫层析试纸条相结合(RT-LAMP-ICS),检测出临床样品中仅10个拷贝的甲型流感病毒,并得出其分型(H1N1、H3N2、H5N1)。Aaruyama等[29]将LAMP和原位杂交相结合,建立了In-Situ-LAMP技术,用于检测组织细胞中大肠杆菌O157∶H7。Seetang-Nun等[30]将纳米金颗粒标记的DNA探针与LMAP技术相结合,建立了用肉眼观察白斑综合征病毒的方法。
3 展 望
LAMP技术灵敏度高,可以检测到单个拷贝的核酸,对DNA要求不高,样品甚至只需经过超声裂解即可做为扩增模板,再加上其反应温度恒定,在1h内即可扩增109个拷贝,所以在临床检测和现场检测中具有重大的意义。LAMP扩增反应所需温度恒定,不需要使用昂贵仪器,一旦建立了一种病原生物的LAMP检测方法,就可以在基层单位和现场中推广,具有广阔的应用前景。
[1]Compton J. Nucleic acid sequence-based amplification[J]. Nature, 1991, 350(6313): 91-92.
[2]Lizardi PM, Huang XH, Zhu ZR, et al. Mutation detecton and single-molecule counting uding sothermal rolling-circle amplification[J]. Nat Genet, 1998, 19: 225-232.
[3]Walker GT, Fraiser MS, Schram JL, et al. Strand displacement amplification-an isothermal,invitroDNA amplification technique[J]. Nucleic Acids Res, 1992, 20(7): 1691-1696.
[4]Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(12): e63.
[5]Nagamine K, Hase T, Notomi T. Accelerated reaction by loop-mediated isothermal amplification using loop primers[J]. Mol Cell Probes, 2002, 16: 223-229.
[6]Chuang TL, Wei SC, Lee SY, et al. A polycarbonate based surface plasmon resonance sensing cartridge for high sensitivity HBV loop-mediated isothermal amplification[J]. Biosens Bioelectron, 2012, 32(1): 89-95.
[7]Fischbach J, Xander NC, Frohme M, et al. Shining a light on LAMP assays--a comparison of LAMP visualization methods including the novel use of berberine[J]. Biotechniques, 2015, 58(4): 189-194.
[8]Deng J, Pei J, Gou H, et al. Rapid and simple detection of Japanese encephalitis virus by reverse transcription loop-mediated isothermal amplification combined with a lateral flow dipstick[J]. J Virol Methods, 2015, 213: 98-105.
[9]Ravan H, Yazdanparast R. Development and evaluation of a loop-mediated isothermal amplification method in conjunction with an enzyme-linked immunosorbent assay for specific detection ofSalmonellaserogroup D[J]. Anal Chim Acta, 2012, 733: 64-70.
[10]Kumar P, Pandya D, Singh N, et al. Loop-mediated isothermal amplification assay for rapid and sensitive diagnosis of tuberculosis[J]. J Infect, 2014, 69(6): 607-615.
[11]Okada K, Chantaroj S, Taniguchi T, et al. A rapid, simple, and sensitive loop-mediated isothermal amplification method to detect toxigenicVibriocholeraein rectal swab samples[J]. Diagn Microbiol Infect Dis, 2010, 66(2): 135-139.
[12]Yang Q, Wang F, Jones KL, et al. Evaluation of loop-mediated isothermal amplification for the rapid, reliable, and robust detection ofSalmonellain produce[J]. Food Microbiol, 2015, 46: 485-493.
[13]Wang XR, Wu LF, Wang Y, et al. Rapid detection ofStaphylococcusAureusby loop-mediated isothermal amplification[J]. Appl Biochem Biotechnol, 2015, 175(2): 882-891.
[14]Kurosaki Y, Takada A, Ebihara H, et al. Rapid and simple detection of Ebola virus by reverse transcription-loop-mediated isothermal amplification[J]. J Virol Methods, 2007, 141(1): 78-83.
[15]Ge Y, Wu B, Qi X, et al. Rapid and sensitive detection of novel avian-origin influenza A (H7N9) virus by RT-lamp combined with a lateral-flow device[J]. PLoS ONE, 2013, 8(8): e69941.
[16]Shirato K, Yano T, Senba S, et al. Detection of Middle East Respiratory Syndrome coronavirus using reverse transcription loop-mediated isothermal amplification(RT-LAMP)[J]. Virol J, 2014, 11: 139.
[17]Nie K, Qi S, Zhang Y, et al. Human enterovirus 71 subgenotype C4 in nasopharyngeal swab specimens[J]. PLoS ONE, 2012, 7(12): e52486.
[18]Hanaki K, Ike F, Kajita A, et al. Detection of murine norovirus by reverse transcription loop-mediated isothermal amplification[J]. J Virol Methods, 2014, 204: 17-24.
[19]Huang XY, Hu XN, Ma H, et al. Detection of new bunyavirus RNA by reverse transcription-loop-mediated isothermal amplification[J]. J Clin Microbiol, 2014, 52(2): 531-535.
[20]Teoh BT, Sam SS, Tan KK, et al. Early detection of dengue virus by use of reverse transcription-recombinase polymerase amplification[J]. J Clin Microbiol, 2015, 53(3): 830-837.
[21]Luo L, Nie K, Yang MJ, et al. Visual detection of high-risk human papillomavirus genotypes 16, 18, 45, 52, and 58 by loop-mediated isothermal amplification with hydroxynaphthol blue dye[J]. J Clin Microbiol, 2011, 49(10): 3545-3550.
[22]Jiang ZM, Ma XP, Yin ZJ, et al. A closed-tube isothermal amplification method for highly sensitive and visualized detection ofPlasmodiumfalciparum[J]. Progr Mod Biomed, 2014, 14(26): 5014-5018. (in Chinese) 江再茂,马雪萍,殷竹君,等. 单管可视化环介导等温扩增技术快速检测恶性疟原虫[J]. 现代生物医学进展, 2014, 14(26): 5014-5018.
[23]Chen L, WLM Mamuti, Zhang DT, et al.Loop-mediated isothermal amplification for rapid detection of dogs infected withEchinococcusspecies based on copro-DNAⅡ[J]. Chin J Zoonoses, 2014, 30(7): 718-722. (in Chinese) 陈璐,吾拉木·马木提,张德亭,等. 环介导等温扩增技术(LAMP)检测棘球绦虫感染犬粪DNA的研究[J]. 中国人兽共患病学报, 2014, 30(7): 718-722.
[24]Zhuo X, Huang B, Luo J, et al. Development and application of loop-mediated isothermal amplification assays based on ITS-1 for rapid detection ofToxoplasmagondiiin pork[J]. Vet Parasitol, 2015, 208(3/4): 246-249.
[25]Mehrdad G, Mohammad JG, Lame A, et al. Development and assessment of loop-mediated isothermal amplification (LAMP) assay for the diagnosis of human visceral leishmaniasis in Iran[J]. Iranian J Parasitol, 2014, 9(1): 50-59.
[26]Poole CB, Tanner NA, Zhang Y, et al. Diagnosis of brugian filariasis by loop-mediated isothermal amplification[J]. PLoS Negl Trop Dis, 2012, 6(12): e1948.
[27]Arimatsu Y, Kaewkes S, Laha T, et al. Specific diagnosis ofOpisthorchisviverriniusing loop-mediated isothermal amplification (LAMP) targeting parasite microsatellites[J]. Acta Trop, 2015, 141(Pt B): 368-371.
[28]Jung JH, Oh SJ, Kim YT, et al. Combination of multiplex reverse-transcription loop-mediated isothermal amplification with an immunochromatographic strip for subtyping influenza A virus[J]. Anal Chim Acta, 2015, 853: 541-547.
[29]Maruyama F, Kenzaka T, Yamaguchi N, et al. Detection of bacteria carrying thestx2 gene by in situ loop-mediated isothermal amplification[J]. Appl Environ Microbiol, 2003, 69(8): 5023-5028.
[30]Seetang-Nun Y, Jaroenram W, Sriurairatana S, et al. Visual detection of white spot syndrome virus using DNA-functionalized gold nanoparticles as probes combined with loop-mediated isothermal amplification[J]. Mol Cell Probes, 2013, 27(2): 71-79.
Loop mediated isothermal amplification and its application in pathogenic organisms detection
HUANG Zhi-miao,WENG Yu-wei
(FujianCenterforDiseaseControlandPrevention,Fuzhou350001,China)
Loop mediated isothermal amplification (LAMP) technology is a novel nucleic acid amplification technology developed in recent years. Because of its simplicity, rapidity, high specificity and high sensitivity, it has been widely used in the detection of pathogenic organisms such as bacteria, viruses and parasites in the past dozen years since 2000, it has important significance of point-of-care test and local laboratory promotion.
Loop mediated isothermal amplification;pathogenic organisms;detection
福建省疾病预防控制中心,福州 350001
10.3969/j.issn.1002-2694.2015.11.019
R781
A
1002-2694(2015)11-1075-06
2015-05-23;
2015-07-21
