弓形虫ROP16I/IIIDNA疫苗不能诱导小鼠有效的保护性免疫
2015-02-14周芹芝罗庆礼沈继龙
周芹芝,李 曼,陈 鹤,都 建,罗庆礼,沈继龙
弓形虫ROP16I/IIIDNA疫苗不能诱导小鼠有效的保护性免疫
周芹芝1,2,李 曼1,陈 鹤3,都 建1,罗庆礼1,沈继龙1
目的 利用ROP16I/III基因真核表达重组质粒免疫BALB/c雌性小鼠,检测小鼠体液免疫和细胞免疫,评估ROP16I/III作为潜在的分子疫苗的价值。方法 克隆Chinese 1型弓形虫ROP16I/III, 将其插入真核表达载体pEGFP-C2中构建重组质粒pEGFP-ROP16I/III,脂质体法转染T293细胞并观察体外表达。Western blotting分析鉴定。将36只SPF级小鼠随机均分为:①PBS组;②空质粒组;③pEGFP-ROP16I/III组。每2周肌注免疫1次(100 μg/只),共3次;于免疫前及每次肌注前1 d和末次免疫后2周收集小鼠血清,间接ELISA法检测血清抗弓形虫IgG。于末次免疫2周后取小鼠脾脏,分离淋巴细胞培养测细胞因子。剩余小鼠腹腔注射Chinese 1型弓形虫 Wh3株速殖子1 000个/只,观察小鼠攻击感染后的存活时间和存活率。结果 真核表达载体构建成功,体外见到重组质粒pEGFP-ROP16I/III在T293细胞的表达;pEGFP-ROP16I/III末次免疫后血清中IgG水平及脾淋巴细胞细胞因子均无明显升高(P>0.05);攻击感染后,免疫组小鼠比对照组的存活时间无延长(P>0.05);生物信息学分析发现ROP16I/III缺乏线性B细胞表位。结论 Chinese1 型弓形虫的ROP16I/III由于其分泌的定位和结构特点,不能诱导小鼠产生有效的抗Wh3株攻击感染的免疫保护。
弓形虫;ROP16I/III;分子疫苗
弓形虫病(toxoplasmosis)是一种人兽共患病,严重危害人类健康和畜牧业生产,目前尚无特效药物用来预防和治疗弓形虫感染。唯一用于绵羊接种的弓形虫疫苗为热敏感无毒株疫苗S48(ts-4)[1]。但是由于弓形虫生活史各阶段抗原成分复杂,目前尚无用于其他动物和人体的有效分子疫苗。研制安全有效的重组疫苗长期以来是弓形虫病防治的研究热点之一。DNA疫苗接种是将编码抗原的基因插入载体质粒中构成重组体,直接接种机体,在接种部位摄取表达疫苗抗原分子,从而诱导机体产生抗感染免疫的有效途径。在DNA疫苗的接种途径中,直接肌注法被认为是目前最简单有效的途径之一。目前用于弓形虫疫苗研究的虫源性蛋白包括表膜蛋白SAGs、棒状体蛋白ROPs,致密颗粒蛋白GRAs,和微线体蛋白MICs等[2-5]。ROPs是虫体分泌型细胞器棒状体(rhoptry)的分泌蛋白,除了ROP2和ROP8外,多数具有丝氨酸-苏氨酸蛋白激酶活性,也是虫株重要的毒力因子[6-7]。ROP16是由弓形虫棒状体分泌的一组与细胞内增殖和调节有关的效应分子,参与纳虫泡的形成,以抵抗宿主细胞内的杀伤。有研究报告,ROP16用于小鼠的免疫可诱导抗感染的免疫力[8,9]。不同弓形虫基因型具有ROP16的多态性。我国流行的优势弓形虫基因型为Chinese 1[10-12],其ROP16的多态性为ROPI/III。为了深入探讨ROP16的潜在疫苗应用价值,本研究克隆了Chinese 1基因型Wh3 虫株的ROP16I/III,并构建了真核表达质粒,对小鼠进行了重组ROP16I/III(rROP16I/III)的免疫保护性的研究。现将结果报告如下。
1 材料与方法
1.1 虫株、菌种、质粒及细胞 弓形虫Wh3 株(Chinese 1 型),大肠杆菌DH5α,真核表达载体pEGFP-C2,HEK293T(人胚肾细胞株)细胞均由本实验室保存。
1.2 实验动物 SPF级BALB/c雌性小鼠购自北京维通利华实验动物技术有限公司,经安徽医科大学试验动物伦理委员会审批(No.2014012)。
1.3 主要试剂 质粒提取试剂盒GoldHi EndoFree Plasmid Maxi Kit购自康为世纪公司(中国);HRP标记的羊抗鼠IgG,IgG1和IgG2a购自Invitrogen公司;FBS(Gibco,美国);SDS-PAGE 凝胶配置试剂盒(碧云天,中国);预染蛋白markers 和ECL底物发光检测试剂盒(Fermentas,美国);逆转录试剂盒(Thermo,美国);DMEM高糖培养基,转染试剂Lipofectamine 2000,Opti-MEM(Gibco公司,美国);SYBR(Takara, 中国);AxyPrep DNA凝胶回收试剂盒与AxyPrep质粒小量提取试剂盒(Axygen公司,中国);细胞因子(IL-2、IL-4、IL-10和IFN-γ)ELISA试剂盒购自北京四正柏生物科技有限公司。
1.4 真核表达重组质粒pEGFP-ROP16I/III的构建与鉴定 根据GenBank中弓形虫ROP16I/III的表达序列设计引物:上游引物 P1:5′-GAAGATCTAT GAAAGTGACC ACGAAAGA-3′,划线序列为BgⅢ酶切位点;下游引物P2:5′-CGAGCTCCAT CCGATGTGAAGAAAG-3′, 划线序列为SacI酶切位点。以提取的Wh3虫株的基因组DNA为模板,进行PCR扩增。PCR产物电泳鉴定、回收和纯化,并克隆至同样经Bgm和SacI双酶切的真核表达载体pEGFP-C2上,得到的阳性重组克隆pEGFP-ROP16I/III进行酶切、测序和鉴定。
1.5 pEGFP-ROP16I/III转染及鉴定 鉴定正确后提取质粒,转染HEK293T细胞。24孔板培养HEK293T细胞,转染前1 d换为无血清 DMEM 培养基, 在500 μL无抗生素的DMEM培养基中接种2×105细胞,待细胞生长至90%~95%密度时开始转染,6 h后移去转染液,加DMEM完全培养基。培养24 h后,在荧光显微镜下观察绿色荧光,分析重组质粒pEGFP-ROP16I/III在HEK293T细胞中的表达。
1.6 重组质粒在免疫小鼠体内表达 提取免疫局部的小鼠后腿肌肉组织RNA,逆转录成cDNA后PCR扩增ROP16I/III目的片段,鉴定其在体内的表达。
1.7 弓形虫裂解抗原的制备 弓形虫在HFF细胞中培养。待虫体即将HFF细胞全部裂解时,离心收集速殖子。将速殖子悬液置-20 ℃反复冻融3次,置于冰上超声破碎。经BCA蛋白浓度测定试剂盒对速殖子裂解液进行蛋白质浓度测定,-80 ℃保存备用。
1.8 动物分组及免疫 36只SPF级BALB/c雌性小鼠随机分成3组,每组12只。 第1组为实验组(肌肉注射pEGFP-ROP16I/III);第2组为空质粒对照组;第3组为PBS对照组。重组质粒提取纯化后用PBS稀释至100 μg/100 μL。实验组小鼠经肌肉注射100 μL/只, 空质粒对照组和空白对照组用同剂量免疫,每2周肌肉注射免疫1次,共免疫3次。
1.9 免疫小鼠抗体测定 免疫前及每次免疫前1 d和末次免疫后2周,小鼠尾静脉采血收集血清,间接ELISA检测血清抗弓形虫IgG。用弓形虫 RH 株速殖子裂解液抗原包被96孔酶标板4 ℃过夜, BSA 37 ℃封闭2 h。 鼠血清1∶50稀释作为一抗, HRP标记的抗小鼠IgG作为二抗,1 h后底物显色,终止反应后用酶标仪测定各孔吸光度值。免疫鼠血清 OD值/阴性对照 OD>2为阳性。
1.10免疫小鼠细胞因子的测定 末次免疫2周后,每组取3只小鼠,分别制备脾细胞悬液,加入淋巴细胞分离液分离淋巴细胞,调整浓度接种于96孔培养板中,加入刺激物37 ℃,5%CO2细胞培养箱中培养。分别于培养24 h、72 h和96 h后收集细胞培养上清,置于-80 ℃保存,ELISA试剂盒检测细胞因子。
1.11 攻击感染实验 末次免疫两周后,每只小鼠经腹腔接种Wh3速殖子103个,记录一般状况和存活时间。
1.12 统计学方法 实验数据用SPSS13.0软件进行统计分析,用T-test、ONE-WAY ANOVA分析,以α=0.05为水准,P<0.05具有统计学意义。
2 结 果
2.1 pEGFP-ROP16I/III表达载体的构建与鉴定 以提取的重组质粒pEGFP-ROP16I/III为模板进行PCR扩增,电泳后显示一条分子量约2 124 bp的条带,说明重组表达质粒pEGFP-ROP16I/III初步构建成功(图1)。

M: DNA分子量标准(bp);1 转染重组质粒pEGFP-ROP16I/III细胞组;2 转染空质粒pEGFP-C2组;3 空白对照组
M: molecular weight (bp); 1: cells transfected with recombinant pEGFP-ROP16I/III; 2: cells transfected with control plasmids; 3: cells without plasmids transfection.
图1 重组载体pEGFP-ROP16I/III经PCR扩增的ROP16I/III片段
Fig.1 PCR amplification ofROP16I/IIIfrom template recombinant pEGFP-ROP16I/III.
2.2 pEGFP-ROP16I/III细胞内表达的检测 质粒pEGFP-ROP16I/III体外转染HEK293T细胞,培养24 h后,在荧光显微镜下见到绿色荧光,同时未转染质粒的HEK293T细胞观察不到绿色荧光。虽然pEGFP-ROP16I/III转染效率不及空白质粒,但是与对照组相比,表明重组质粒在真核细胞内能有效表达(图2)。

A:转染重组质粒pEGFP-ROP16I/III;B:转染空质粒pEGFP-C2;C,空白对照
A: cells transfected with recombinant pEGFP-ROP16I/III;B: cells transfected with control plasmids; C: cells without plasmids transfection.
图2 重组质粒pEGFP-ROP16I/III转染HEK293T后目的基因表达的检测
Fig.2 Fluorescent detection of theROP16I/IIIgene expression in transfected HEK293T cells
2.3 重组质粒在免疫小鼠体内的表达 提取小鼠后腿肌肉组织总RNA,逆转录成cDNA后PCR扩增ROP16I/III目的片段。结果可见与目的片段大小(2 124 bp)位置一致的条带(图3),证明体内有ROP16I/III的mRNA水平转录。
2.4ROP16I/III的生物信息学分析 Chinese 1 基因型虫株的ROP16氨基酸序列不同于II型虫株(ROP16II)而与I型/III型虫株一致(ROP16I/III)。亦即,其ROP16I/III第503位氨基酸为亮氨酸(L)而非丝氨酸(S),见图4 A。ROP16I/III的编码序列采用Bepipred Server (http://www.cbs.dtu.dk/services/BepiPred/) 软件进行B细胞表位分析,结果见到,ROP16I/III缺乏线性B细胞表位(见图4 B)。ROP16I/III的三维空间结构模型见图5。

M:DNA分子量标准(bp);1:小鼠接种局部组织;2:远离接种局部的组织
M: DNA molecular weight(bp); 1: local tissues of vaccinated mouse; 2: adjacent tissues of the location of vaccination.
图3 RT-PCR鉴定重组质粒在小鼠肌肉组织表达
Fig.3 Identification ofROP16I/IIIexpression in the muscles of mouse by RT-PCR
2.5 免疫小鼠血清特异性抗ROP16I/IIIIgG抗体的检测 最后一次免疫小鼠后,ELISA检测小鼠血清IgG,如图6所示:与对照组相比,实验组小鼠未能产生特异性抗体,在450nm处OD值未见明显差异(P>0.05)。
检测小鼠血清中IgG1和IgG2a的水平,如图7所示,实验组和对照组的IgG1和IgG2a含量亦无显著变化(P>0.05)。

A:Chinese 1基因型弓形虫ROP16多态性特征为ROP16I/III503L(第503位氨基酸为亮氨酸);B:ROP166I/III线性B细胞表位预测(示缺乏B细胞表位)
A: polymorphicROP16I/III,showing leucine (L) at amino acid 503; B: B epitope prediction ofROP16I/III, showing lack of B epitope in ROPI/III.
图4ROP16I/III的生物信息分析
Fig.4 Bioinformatic analyses ofROP16I/III
2.6 免疫小鼠细胞免疫的检测 免疫小鼠在末次免疫后取小鼠脾细胞,制备脾细胞悬液,加入相对应的刺激物培养,收集培养上清,经ELISA检测,发现试验组IL-2、IL-4、IL-10和IFN-γ与对照组之间无差异(表1),P>0.05,无统计学意义。
2.7 攻击感染免疫保护效果 3组小鼠经腹腔接种感染103个Wh3速殖子,均未能耐受攻击感染,于第3 d开始,所有小鼠出现活动减少、竖毛、弓背、饮食减少等表现;攻击后第8 d时3组小鼠均开始死亡;第10 d全部死亡。重组质粒组未能延长小鼠寿命(P>0.05)(图8)。说明ROP16I/III的DNA疫苗未能成功诱导机体产生抗攻击感染的免疫保护作用。

图5ROP16I/III的3D结构(绿色箭头所指为503L位点)
Fig.5 Three dimensional structure ofROP16I/III, indicating leucine (L) at amino acid 503 (arrow)

图6 pEGFP-ROP16I/III质粒免疫BALB/c小鼠血清抗ROP16I/III总IgG抗体
Fig.6 Total seral IgG antibodies againstROP16I/IIIin mice immunized with pEGFP-ROP16I/III
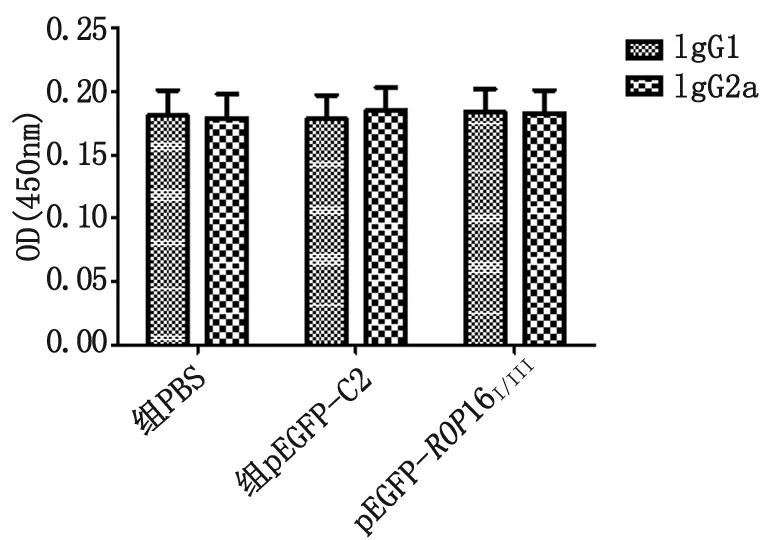
图7 pEGFP-ROP16I/III质粒免疫小鼠,血清抗体IgG1和IgG2a的检测
Fig.7 IgG1 and IgG2 antibodies againstROP16I/IIIin mice immunized with pEGFP-ROP16I/III

图8ROP16I/IIIDNA免疫小鼠经103个Wh3速殖子攻击感染后的生存时间
Fig.8 Survival time of mice immunized with pEGFP-ROP16I/IIIfollowed by challenge with 103tachyzoites ofToxoplasmaWh3 virulent strain

表1 pEGFP-R0P16I/III质粒免疫小鼠脾细胞分泌的细胞因子检测(P>0.05)Tab.1 Cytokines detection in the splenocytes of mice immunized with pEGFP-ROP16I/III and control (P>0.05)
3 讨 论
目前,唯一在欧洲和新西兰注册用于绵羊接种的弓形虫疫苗为减毒活疫苗S48(热敏虫株)[13]。活虫疫苗虽不能在体内增殖,但是有转变为包囊的风险而不适用于人体。近年有关弓形虫以及其他顶复原虫(Apicomplexan)的表膜抗原和分泌抗原作为候选疫苗分子的研究较多。在蛋白质疫苗中,有报告认为[14],只有弓形虫的全虫裂解抗原(而非是若干重组抗原的混合物)才能诱导小鼠产生免疫保护力,表现为脾细胞高表达IFN-γ,巨噬细胞分泌高水平的iNOS和NO,小鼠脑内包囊较少。
弓形虫棒状体(rhoptry)位于虫体顶端复合器,一般含8~12个。虫体入侵宿主细胞后,棒状体分泌一系列具有丝氨酸/苏氨酸蛋白激酶(serine-threonine kinase)活性的棒状体蛋白(ROPs)。ROPs家族成员众多,目前已经鉴定出30多个,其编码基因位于弓形虫第VIIa染色体上,在细胞入侵时虫体分泌的ROPs与前端表膜融合,有助于虫体入侵宿主细胞[15]。在宿主细胞内,ROPs主要定位于纳虫泡膜(parasitophorous vacuole membrane, PVM)[16],是弓形虫调控宿主细胞的重要效应分子,也是虫体逃避巨噬细胞清除的重要机制。因此ROPs家族的鉴定和功能描述被认为是弓形虫生物学研究的一个重大突破[17]。Garcia 等曾试用弓形虫棒状体复合粗抗原接种家猪,虽然见到抗原可诱导猪对III型虫株VEG卵囊感染的部分免疫保护(脑内包囊减少),但是对急性期感染无保护作用。其原因可能是皮下接种抗原不能提供肠粘膜的免疫保护[18]。用相同抗原接种猫,结果3只猫中的2只排卵囊数目减少。但是由于动物数量少同样难以判断疫苗的保护力[19]。棒状体蛋白中的ROP2的DNA疫苗可在C3H小鼠提供部分免疫保护,但在C57BL/6 和BALB/c 小鼠则未见有任何作用[20]。同样的结果见于Leyva 的报道[21]。作者采用ROP2的DNA疫苗在3个小鼠品系(CBA/J, C57BL/6, BALB/c),进行了测试。结果未见对于RH攻击感染的任何保护力。
ROP16为ROPs家族的重要成员,被认为是弓形虫重要的毒力相关因子。弓形虫接触细胞后10分钟,在受染细胞的细胞核内便可以检测到ROP16。弓形虫在入侵宿主细胞时,会分泌并释放ROP16到宿主细胞质中,然后ROP16被核定位信号(nuclear localization signals, NLS)运输至细胞核内,完成细胞核内的定位并发挥功能,这在弓形虫特异性蛋白中非常罕见[16-17]。
本研究克隆表达了流行我国的优势基因型 Chinese 1 弓形虫Wh3株ROP16I/III编码序列。以此构建pEGFP-ROP16I/III重组质粒,体外转染HEK293T细胞见到目的蛋白的表达;质粒接种BALB/c后,检测到ROP16I/III的mRNA在体内的转录。给与免疫小鼠经腹腔攻击感染Wh3株速殖子103个。结果见到,虽然接种和表达成功,但是免疫小鼠未出现明显的体液和细胞介导的免疫应答,且对攻击感染缺乏有效的免疫保护。感染鼠的临床表现与存活时间与免疫组相比未见显著差异。
国内有报告,用pVAX-ROP16质粒免疫昆明小鼠,可以诱导出淋巴细胞的增殖、高滴度抗体、IL-2、IFN-γ、IL-4和IL-10水平升高,小鼠攻击感染后存活时间延长,提示ROP16具有疫苗研究价值[8];用ROP16和GRA7构建融合表达质粒肌注免疫昆明小鼠,可诱导高滴度的IgG抗体和IFN-γ, CD8+细胞比例升高,小鼠存活时间延长[9]。然而有趣的是,Jensen 等应用II型虫株的ROP16转基因弓形虫(Strain II+ROP16I)免疫C57BL/6J小鼠,结果见到,只有内源性的GRA15II和插入的ROP16I共同表达的基础上,才能诱导小鼠对于经口感染的免疫保护力,表现为小鼠产生了对1 000个PRU包囊和100个ME49株包囊攻击感染后的100%的保护力[22]。最近, Alvarez 等[17]发现,人体与动物感染(肉类)的弓形虫的ROP16具有显著的多态性差异。前者多为强毒的ROP16(ROP16I);而后者全部为弱毒的ROP16(ROP16II)。强毒的ROP16I因为缺乏线性B细胞表位而失去免疫原性,难以(仅10.5%)诱导小鼠产生特异性抗体。本研究与该作者结果相一致。
本实验采用我国Chinese 1 型弓形虫的多态性ROP16I/III的DNA疫苗免疫小鼠,虽然在体内获得了真核表达产物,但未见诱导小鼠的显著性免疫保护力。其原因可能是:①ROP16主要是虫体入侵后分泌在宿主细胞质内,构成纳虫泡膜的成分参与虫体的免疫逃避和宿主的免疫调节,难以暴露并有效刺激宿主产生抗虫免疫;②毒力因子ROP16I/III缺乏线性B细胞表位,这一结构特点难以诱导出高水平的特异性抗体;③相同疫苗在不同小鼠品系的结果差异较大,本实验采用了对弓形虫高度敏感的BALB/c小鼠,结果与Vercammen的报告一致。为了真实地反应出ROP16I/III的疫苗效果,本研究的质粒构建未采用细胞因子佐剂的融合表达,攻击感染采用了毒力较强的Wh3株而非是II型成囊株。由于我国流行的这一优势基因型弓形虫Wh3虫株兼有II型和I型的主要效应分子多态性特点,深入探讨其他效应分子的潜在疫苗价值仍然具有十分重要的意义。
4 结 论
我国流行的优势基因型Chinese 1的多态性ROP16I/III难以诱导实验小鼠产生高滴度抗体和Th1应答,不能为BALB/c小鼠提供有效的免疫保护力。
[1]Katzer F,Canton G, Burrells A, et al. Immunization of lambs with the S48 strain ofToxoplasmagondiireduces tissue cyst burden following oral challenge with a complete strain of the parasite[J]. Vet Parasitol, 2014, 205(1/2): 46-56.
[2]Wang Y, Yin H. Research progress on surface antigen 1 (SAG1) ofToxoplasmagondii[J]. Parasit Vectors, 2014, 13(7): 180. DOI: 10. 1186/1756-3305-7-180
[3]Lu G, Wang L, Zhou A,et al. Epitope analysis, expression and protection of SAG5A vaccine againstToxoplasmagondii[J]. Acta Trop, 2015, 146: 66-72. DOI: 10.1016/j.actatropica.2015.03.013
[4]Hiszczynska-Sawicka E, Oledzka G, Holec-Gasior L, et al. Evaluation of immune responses in sheep induced by DNA immunization with genes encoding GRA1, GRA4, GRA6 and GRA7 antigens ofToxoplasmagondii[J]. Vet Parasitol, 2011, 177(3/4): 281-289.
[5]Lourenco EV, Bemardes ES, Silva NM, et al. Immunization with MIC1 and MIC4 induces protective immunity againstToxoplasmagondii[J]. Microbes Infect, 2006, 8(5): 1244-1251.
[6]Qiu W, Wernimont A, Tang K, et al. Novel structural and regulatory features of rhoptry secretory kinases inToxoplasmagondii[J]. EMBO J, 2009, 28 (7): 969-979.
[7]Xu Y, Gao Q, Xu QM, et al. New advances in studies ofToxoplasmagondiirhoptry neck proteins and rhoptry proteins[J]. Chin J Zoonoses, 2013, 12: 1217-1221. (in Chinese) 徐颖, 高琦, 徐前明, 等. 弓形虫棒状体颈部蛋白及棒状体蛋白研究的新进展[J]. 中国人兽共患病学报, 2013, 12: 1217-1221.
[8]Yuan ZG, Zhang XX, He XH, et al. Protective immunity induced byToxoplasmagondiirhoptry protein 16 against toxoplasmosis in mice[J]. Clin Vaccine Immunol, 2011, 18(1): 119-124.
[9]Liu Q, Wang FW, Wang G, et al.Toxoplasmagondii: immune response and protective efficacy induced by ROP16/GRA7 multicomponent DNA vaccine with a genetic adjuvant B7-2[J]. Human Vaccines Immunotherapeutics, 2014, 10(1): 184-1912.
[10]Wang L, Chen H, Liu DH, et al. Genotypes and mouse virulence ofToxoplasmagondiiisolates from animals and humans in China[J]. PLoS ONE, 2013, 8(1): e53483.
[11]Wang L, Cheng HW, Huang KW, et al.Toxoplasmagondiiprevalence in food animals and rodents in different regions of China: isolation, genotyping and mouse pathogenicity[J]. Parasites Vectors, 2013, 6: 273.
[12]Li M, Mo XW, Wang L, et al. Phylogeny and virulence divergency analyses ofToxoplasmagondiiisolates from China[J]. Parasites Vectors, 2014, 7: 133.
[13]Burrells A, Benavides J, Canton G, et al. Vaccination of pigs with the S48 strain ofToxoplasmagondii-safer meat for human consumption[J]. Vet Res, 2015, 46(1): 47. DOI: 10.1186/s13567-015-0177-0
[14]Wagner A, Schabussova I, Ruttkowski B. Prime-boost vaccination withToxoplasmalysate antigen, but not with a mixture of recombinant protein antigens, leads to reduction of brain cyst formation in BALB/c mice[J]. PLoS One, 2015, 26(5): e0126334. DOI: 10.1371/journal.pone.0126334
[15]Taylor S, Barragan A, Su C, et al, A secreted serine-threonine Kinase determines virulence in the eukaryotic pathogenToxoplasmagondii[J]. Science, 2006, 314: 1776-1780. DOI: 10. 1126/science.1133643
[16]Gilbert LA, Ravindran S, Turetzky JM, et al.Toxoplasmagondiitargets a protein phosphatase 2C to the nuclei of infected host cells[J]. Eukaryotic Cell, 2007, 6(1): 73-83.
[17]Catalina A,De-la-Torre A,Vargas M, et al. Striking divergence inToxoplasmaROP16 nucleotide sequences from human and meat samples[J]. J Infect Dis, 2015, 211: 2006-2013.
[18]Garcia JL, Gennari SM, Navarro IT, et al. Partial protection against tissue cysts formation in pigs vaccinated with crude rhoptry proteins ofToxoplasmagondii[J]. Vet Parasitol, 2005, 129(3/4): 209-217.
[19]Garcia JL, Navarro IT, Biazzono L, et al. Protective activity against oocyst shedding in cats vaccinated with crude rhoptry proteins of theToxoplasmagondiiby the intranasal route[J]. Vet Parasitol, 2007, 145(3、4): 197-206.
[20]Vercammen M, Scorza T, Huygen K, et al. DNA vaccination with genes encodingToxoplasmagondiiantigens GRA1, GRA7, and ROP2 induces partially protective immunity against lethal challenge in mice[J]. Infect Immun, 2000, 68(1): 38-45.
[21]Leyva R, Herion P, Saavedra R, et al. Genetic immunization with plasmid DNA coding for the ROP2 protein ofToxoplasmagondii[J]. Parasitol Res, 2001, 87(1): 70-79.
[22]Jensen KD, Hu K, Hitmarsh RJ, et al.Toxoplasmagondiirhoptry 16 kinase promotes host resistance to oral infection and intestinal inflammation only in the context of the dense granule protein GRA15[J]. Infect Immun, 2013, 81(6): 2156-2167.
Recombinant eukaryotic plasmid ofROP16I/IIIfailed to provide efficient protection against toxoplasmosis in BALB/c mice
ZHOU Qin-zhi1,2,LI Man1,CHEN He3,DU Jian1,LUO Qing-li1,SHEN Ji-long1
(1.DepartmentofParasitology,AnhuiMedicalUniversity,Hefei230032,China;2.DepartmentofClinicalLaboratory,theCentralHospitalofCTCEGROUP,Hefei230023,China;3.DepartmentofBiochemistry,AnhuiMedicalUniversity,Hefei230032,China)
To construct the recombinant eukaryotic expression plasmids ofToxoplasmaROP16I/III, and to assess the immune protection in BALB/c mice induced byROP16I/IIIDNA vaccine,T.gondiiROP16I/IIIcoding gene obtained by PCR amplification was inserted into the eukaryotic expression vector pEGFP-C2 to generate recombinant pEGFP-ROP16I/III. T293 cells were transfected by Liposome methodinvitroand the fusion protein expression was identified by Western blotting. Thirty-six mice were randomly divided into 3 groups with 12 in each: PBS control group; empty plasmid group; and pEGFP-ROP16I/IIIgroup, respectively. Immunization was completed in each mouse by intramuscular injection once 2 weeks for 3 times. Sera at each time point were collected for detection of antibodies againstToxoplasmaby indirect ELISA. After two weeks of the last immunization, mouse splenocytes were harvested and cultured for tests of cytokines in the supernatant. The remaining mice were injected with 1 000 Wh3 tachyzoites for each, followed by observation of survival time and mortality of the animals. The recombinant eukaryotic expression vector of pEGFP-ROP16I/IIIwas successfully generated and efficient expressions were noted both in the transfected T293 cells and in the muscles in which the plasmid vaccine was given. All vaccinated mice, however, did not present the increased IgG antibody titers and cytokine levels after pEGFP-ROP16I/IIIimmunization. Correspondingly, no difference was seen of either survival or mortality of the animals compared with the control. Our conclusion is thatToxoplasmaROP16I/IIIDNA vaccine failed to provide BALB/c mice with efficient immune protection against virulent tachyzoites challenge due to its inaccessibility to host immune components and its lack of linear B epitope.
Toxoplasmagondii;ROP16I/III; DNA vaccine
Shen Ji-long, Email: shenjilong53@126.com
国家自然科学基金(No.81471983)资助;国家“973”计划项目(No. 2010CB530001)资助
沈继龙,Email: shenjilong53@126.com
1.安徽医科大学病原生物学教研室,安徽省人兽共患病重点实验室,安徽病原生物学省级实验室,合肥 230032; 2.中铁四局集团中心医院检验科,合肥 230000; 3.安徽医科大学第一附属医院,合肥 230032
10.3969/j.issn.1002-2694.2015.11.005
R382
A
1002-2694(2015)11-1010-07
2015-06-17;
2015-08-12

Supported by the Funded by the National Natural Science Foundation of China ( No. 81471983); the National Basic Research Program of China (973 Project, No.2010CB530001)
