相对活度在物理化学课程中的应用*
2015-02-13宁爱民
宁爱民
(河南农业大学理学院 河南郑州450002)
有关活度、化学势及标准状态的概念,在20世纪80~90年代曾进行过较多的讨论[1-4]。这些内容在大部分物理化学教材中均用了较多的篇幅进行介绍[5-8],在本科化学专业的课程教学中一般也都占有较多的学时,但是学生普遍认为这些内容既抽象不易理解,又难于系统掌握。如果引入相对活度的概念[9-13],将有助于学生对化学势表达式和标准状态的理解和应用,增强课程中一些内容和知识点的系统性,既有利于学生深刻理解和掌握相关知识,又可减少教材中一些不必要的重复推导和文字介绍,从而提高教学效率。
1 相对活度的概念
1.1 化学势表达式的通式
通常可以由两种方法得到化学势表达式的通式。
1)根据国家标准[14]和国际标准[15]以及有关文献[1],任意系统中组分B的绝对活度λB的定义为:

式中μB(T,p)为组分B在一定温度T和压力p时的化学势,与T、p及组成有关,R为气体常数。组分B的标准绝对活度的定义[15]为:

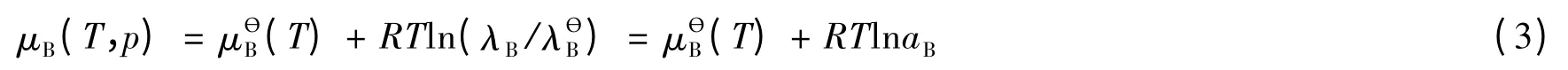
式中aB为组分B的相对活度。aB的定义式为:

相对活度的概念在一些国外的教材[9-12]中均有体现和应用,但在国内的教材中应用很少[13]。
2)分别对不同组分的化学势表达式进行推导,然后归纳为一个通式[13]:

式中FB对气体组分而言等于0;对非气体组分,有:

式中Vm,B为组分B在特定条件(不同系统中的组分,Vm,B的具体含义不同[2-3,13])下的偏摩尔体积,pӨ为标准压力(105Pa)。FB是T和p的函数,与相对活度无关。对非气体组分,当p与pӨ相差不是很大时,FB值很小,通常可忽略[2-3,13]。这样,化学势表达式的通式就与式(3)相同了。
1.2 相对活度的定义
根据Mortimer R G编著的《Physical Chemistry》[9],化学势表达式的通式用式(3)表示时,组分B相对活度的定义为“The activity is a dimensionless quantity that is equal to unity if the substance is in its standard state”(活度是物质在标准状态下等于1的无量纲的量)。对应的标准状态为:“温度为T,压力为pӨ,aB=1且活度系数γB=1的组分B”。若aB=1且γB=1的组分B并不真实存在,则标准状态为假想状态[2,4]。例如,对于非理想气体,aB=fB/pӨ=(γBpB)/pӨ(fB为逸度,γB为逸度系数或活度系数),既要满足aB=1即fB=pӨ,又要满足γB=1即fB=pB,显然此状态对非理想气体并不存在,而是具有理想气体性质的假想状态[2,4]。这样,就可得到不同系统中组分相对活度的具体形式[9-12]及标准状态[2,4],如表1所示。

表1 不同系统中组分的相对活度及标准状态
2 相对活度概念的应用
2.1 在平衡常数表达式及化学反应等温式中的应用
大部分物理化学教材在推导化学反应等温式及平衡常数表达式时,是将化学反应分为几种不同的类型(如理想气体反应,非理想气体反应,理想稀溶液反应,复相反应等)分别推导,这样既增加了教材中不必要的重复内容,也不利于学生系统掌握相关知识。在引入相对活度的概念后,根据化学势表达式的通式进行推导,可以克服这些弊端。
对于任意类型的化学反应(用通式aA+dD=gG+hH表示,简写为0=∑νBB,νB为B的化学计量系数,下同),根据化学势表达式的通式(3)可推导得到化学反应等温式为[9-13]:

式中ΔrGm、Δr分别为化学反应的非标准和标准摩尔Gibbs自由能变,aB为反应系统中某反应物或产物的相对活度,Qa=∏B(aB)νB为反应的相对活度商。平衡常数KӨ表达式的通式为:

式中aeq,B为物质B平衡时的相对活度。从而,还可得到:

这样,只要把不同组分相对活度的具体形式代入式(7)~式(9),就可得到任意类型化学反应的等温式和平衡常数表达式,包括弱酸和弱碱的电离常数、难溶电解质的溶度积常数、水的离子积常数以及分配定律表达式等。同时,由式(8)可以看出,KӨ与标准状态对应,仅是温度的函数。所以,其他的实验平衡常数(如Km、Kc、Kp、Kx、Kn等)都不遵守式(9),均不能根据式(9)由ΔrGӨm直接计算。
2.2 在化学反应等压方程式中的应用
温度对化学反应平衡常数影响的等压方程式的定积分式可写为:

式中KӨ(T1)和KӨ(T2)分别为化学反应在温度T1和T2时的标准平衡常数,ΔHm为化学反应的摩尔焓变。该公式与溶液凝固点、沸点的计算公式以及温度对液体或固体饱和蒸气压影响的Clausius-Clapeyron公式的实质可以认为是一样的,它们之间的内在联系可通过平衡常数及相对活度的概念进行解释。
2.2.1 溶液凝固点的计算公式


KӨ(Tf)=1/aA。将和Tf两个温度时的KӨ代入式(10)即可得到稀溶液凝固点的计算公式为:

若为理想稀溶液,由于aA=xA,代入式(11)即可。若理想稀溶液中溶剂凝固时形成固溶体(固态混合物,用sln'表示,A的物质的量分数为xA'),即:
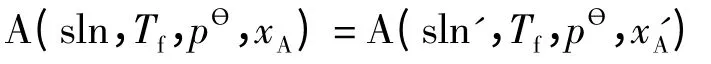
KӨ(Tf)=xA'/xA。代入式(10)即可。
2.2.2 溶液沸点的计算公式
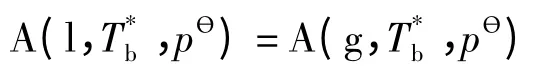
KӨ)=1,ΔHm=ΔvapHm(A),ΔvapHm(A)为液体溶剂的摩尔蒸发焓。对于非挥发溶质形成的溶液,溶液中的溶剂在沸点Tb时蒸发为纯气体,溶液中溶剂与纯气体达到两相平衡,即:

KӨ(Tb)=1/aA。将和Tb两个温度时的KӨ代入式(10)即可得到溶液沸点的计算公式为:

若为理想稀溶液,由于aA=xA,代入式(12)即可。若是挥发性溶质形成的理想稀溶液,稀溶液中溶剂在沸点Tb时蒸发为混合气体中的气体溶剂,稀溶液中溶剂与混合气体中的气体溶剂(其物质的量分数为yA)达到两相平衡,即:

KӨ(Tb)=yA/xA。代入式(10)即可。
2.2.3 Clausius-Clapeyron公式
若纯液体(或固体)B在温度T1时的蒸气压为p1,纯液体(或固体)与纯气体(压力为p1)达到两相平衡,即:

KӨ(T1)=p1/pӨ,ΔHm为液体(或固体)的摩尔蒸发(或升华)焓。同理,若纯液体(或固体)在温度T2时的蒸气压为p2,则KӨ(T2)=p2/pӨ。代入式(10)即可得到Clausius-Clapeyron公式:

由前面的分析知,有了相对活度的概念和平衡常数表达式的通式后,式(10)~式(13)就具有一定的内在联系,只要有了式(10),就可得到其他几个公式。
2.3 在稀溶液定律中的应用
根据相对活度的定义,稀溶液的拉乌尔定律和亨利定律可用如下通式表示:

式中pB为组分B在溶液液面上方气相中的分压,aB为该组分在溶液中的相对活度,ka为常数。对理想稀溶液中的溶剂A,ka为同温度下纯溶剂的饱和蒸气压,因此pA=xA,即拉乌尔定律。对理想稀溶液中的溶质B,ka为亨利系数。因理想稀溶液中溶质B的活度有mB/mӨ、cB/cӨ、xB3种形式,所以pB=km(mB/mӨ)=kc(cB/cӨ)=kxxB,即亨利定律。
稀溶液定律的公式用通式(14)表示后,具有以下几个优点:①对理想稀溶液和非理想稀溶液均成立;②对稀溶液中溶剂和溶质都适用;③亨利系数km、kc、kx的单位均统一为压力单位Pa;④在根据亨利定律推导理想稀溶液中溶质化学势表达式时,不需要人为地通过式子变换引入cӨ或mӨ的项[13],避免了学生对一些公式推导产生的误解,有利于学生对标准状态的理解。
3 结语
综上所述,在引入相对活度的概念后,任意组分的化学势均可用一个通式来表示,组分标准状态的含义相对容易理解,热力学中一些重要知识的系统性更强,一些公式之间的内在联系更为清晰,同时还可减少相关知识点在物理化学教材中的简单重复,有利于学生深刻理解和系统掌握相关知识,对提高教师的授课效率和学生的学习效率均有一定的帮助。
[1]许海涵.化学通报,1987(4):51
[2]姚允斌.大学化学,1988,3(4):40
[3]刘晓地,童汝婷.化学通报,1991(5):40
[4]姚天扬.大学化学,1995,10(2):18
[5]韩德刚,高执棣,高盘良.物理化学.第2版.北京:高等教育出版社,2009
[6]傅献彩,沈文霞,姚天扬,等.物理化学(上册).第5版.北京:高等教育出版社,2005
[7]刘俊吉,周亚军,李松林.物理化学(上册).第5版.北京:高等教育出版社,2009
[8]胡英,吕瑞东,刘国杰,等.物理化学.第5版.北京:高等教育出版社,2007
[9]Mortimer R G.Physical Chemistry.3rd ed.New York:Elsevier Academic Press,2008
[10]Atkins P,Paula J.Physical Chemistry.8th ed.New York:W.H.Freeman&Company,2006
[11]Ott J B,Boerio-Goates J.Chemical Thermodynamics:Principles and Applications.New York:Elsevier Academic Press,2000
[12]Kaufman M.Principles of Thermodynamics(Undergraduate Chemistry:A Series of Textbooks).New York:Marcel Dekker,2002
[13]朱文涛.基础物理化学(上册).北京:清华大学出版社,2011
[14]GB 3102.8—1993,物理化学和分子物理学的量和单位.北京:中国标准出版社,1994
[15]ISO 80000—9:2009,Quantities and Units-Part 9:Physical Chemistry and Molecular Physics.Geneva,2009
