以化学势为中心的多组分系统热力学的集中教学*
2020-11-15郭佩佩赵振波
郭佩佩,赵振波,关 爽
(长春工业大学化学与生命科学学院,吉林 长春 130012)
化学势是物理内容丰富的热力学强度量,如果说温度是表征系统能量以热量传递的趋势,压强表征能量以功传递的趋势,那么化学势是表征系统与媒质,或系统相与相之间,或系统组分之间粒子转移的趋势。粒子总是从高化学势向低化学势区域、相或组元转移,直到两者相等才相互处于化学平衡[1]。与熵判据、吉布斯自由能判据和亥姆霍兹自由能判据相比,化学势判据具有更广泛的适用范围。在多组分系统热力学教学当中,化学势是最为重要的概念。掌握化学势的基本概念、化学势表达式的由来,以及化学势的变化规律对深入理解热力学基本概念及其处理问题的方法具有重要意义。由于之前学习内容均为组成不变的系统,而化学势的概念又比较抽象,学生在理解本章内容上相对比较困难,因此有必要安排集中教学,帮助学生将这部分内容深入的理解、内化到之前的知识体系当中。近年来,尝试以化学势为中心对相关的热力学内容进行集中教学,取得了良好的教学效果[2]。
1 定 义
化学势μ又称化学位,是在多组分系统热力学研究偏摩尔量性质时引出的一个非常重要的强度性质。其定义如下:
对一多组分均相封闭系统,各组分的物质的量分别为nA,nB,nC,nD.....B的化学势定义为:
化学势虽然有4种不同的定义,但是只有第一个才是偏摩尔量即偏摩尔吉布斯自由能。而恒温恒压过程又最为常见,因此在大多数情况下化学势是以偏摩尔吉布斯自由能的形式出现的。理解化学势的定义是至关重要的,在之后的学习中,化学势的很多性质、定量关系及其应用都是基于化学势是偏摩尔吉布斯自由能这一概念的[3]。
2 化学势判据
对于多组分多相系统,根据对广延量的全微分方程以及各相加和,可以得到拓展的热力学基本方程。其具体形式如下:
由基本方程可见,在非体积功为0的多组分多相系统中,进行任意的恒温恒压、恒温恒容、恒熵恒容或恒熵恒压的过程时,系统的变化方向都可以用化学势来判断,也就是说化学势判据将吉布斯自由能判据、亥姆霍兹自由能判据,内能和焓判据(较少使用)进行了统一,因此为物理化学的发展做出了重要贡献[4]。
3 化学势的表达式
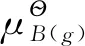
3.1 气体的化学势
对于纯的理想气体而言,其化学势等于气体的摩尔吉布斯自由能,由前一章热力学第二定律中关于吉布斯自由能变换的计算可知:当纯理想气体B在温度T下由标准压力变至某一任意压力p时其化学势的变化等于摩尔吉布斯自由能变化即:
dμ*=dGm=-SmdT+Vmdp
对上式从pӨ到p进行积分则有:

由该公式可知一定温度下的理想气体,其化学势只和气体的压力有关,压力越大理想气体的化学势越大。根据化学势判据可知在同样温度下气体由化学势大的也就是压力大的气体向压力低的气体扩散。
3.2 理想气体混合物中任一组分的化学势
对混合理想气体中的任一组分B的化学势可根据化学势判据和纯理想气体的化学势得到。如图1所示,在一定温度下,纯气体B与含有B气体的混合理想气体通过半透膜隔开时,达到平衡的条件是纯气体B的压力等于混合理想气体中B的分压。同时,根据化学势判据可知,此时两者的化学势也是相等的。所以混合理想气体中B的化学势可以表示为:

图1 气体平衡示意图

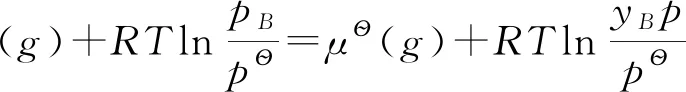
3.3 纯液体的化学势
同样,根据化学势判据,纯液体的化学势也可以由平衡时饱和气体的化学势与(饱和)液体的化学势相等来求得即:
当气体压力不太大时,将气体近似认为理想气体,纯液体的化学势为:
3.4 理想液态混合物中任一组分的化学势
在理想液态混合物中,利用气、液两相平衡时任一组分在两相的化学势相等的原理,结合气体化学势表达式及理想液态混合物的定义式,可推导出理想液态混合物中任一组分的化学势与混合物组成的关系式。形成理想液态混合物后,根据拉乌尔定律,混合物中任一组分的饱和蒸汽压等于纯液体的饱和蒸汽压乘以其摩尔分数即:
利用气、液两相平衡时任一组分在两相的化学势相等的原理,结合上述纯液体的化学势可得:
对于凝聚态物质而言,当压力变化不大的时候化学势随压力的变化可以忽略,上式可近似写作

3.5 理想稀溶液中溶质的化学势
在理想稀溶液中,溶剂遵循拉乌尔定律,因此其化学式表达式与理想液态混合物中任一组分B的化学势表达式相同,这里不再赘述。但是对于溶质,因其遵循亨利定律,故其化学势的表达式与溶剂不同。以挥发性溶剂为例,其遵循亨利定律:
pB=kbbB
结合液体化学势的表达式,两相平衡时溶质的化学势为:
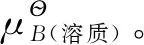
4 影响化学势的因素
4.1 纯物质
对于纯物质由dμ*=dGm=-SmdT+Vmdp可知,其化学势与温度和压力相关。根据热力学第三定律可知,纯物质的摩尔熵为正值,所以在恒压条件下纯物质的化学势随温度的升高而降低;而纯物质的摩尔体积总为正值,所以在恒温条件下纯物质的化学势随压力的升高而增大。
4.2 理想液态混合物中任一组分
5 稀溶液的依数性

6 结 论
图2为集中教学主题的流程图,结合以上讨论可见:以化学势为中心对多组分系统内容进行串联讲解可以更深刻的理解化学势的概念、化学势判据以及化学势的影响因素和相关变量,有利于学生构建更系统的掌握相关知识[6]。

图2 化学势相关基础内容讲解流程图
