低成本光镊装置在荧光定量检测中的应用*
2015-02-13唐宏武曹迪李诚予庞代文
唐宏武 曹迪 李诚予 庞代文
(武汉大学化学与分子科学学院 生物医学分析化学教育部重点实验室 湖北武汉430072)
1970年,美国科学家Ashkin[1]在试验中发现,当一束平行激光入射到微米级别的微球上时,激光对微球存在一个沿光传播方向的推力,之后发现当一束高度会聚的激光束入射到微球上时,对小球有一个指向光强最强处的拉力。结合这两种现象,Ashkin[2]在1986年发明了光镊这种微球操纵工具。
最近几十年来,我国在光镊技术理论研究和应用方面都有了很大的发展。在学科交叉领域,光镊光源是单色性优良的激光,可以用于对特定光谱的激发,现在已经发展出光镊与拉曼光谱结合的光镊-拉曼光谱探测等新技术[3]。我国现有高校进行光镊研究的实验室一般使用专业科研级别的光镊装置,其价格较高,使光镊的教学普及受到很大的限制。我们希望利用国产的正置显微镜代替昂贵的进口倒置显微镜搭建一个光镊系统,同时采用光镊的捕获光源作为荧光基团的激发光源,通过微球富集靶分子,实现靶分子的定量检测。因此,激光既是光镊光源,也是荧光信号的激发光源。DNA检测在核酸特定序列分析、基因研究和癌症早期诊断等方面具有十分重要的作用。本实验以含有64个碱基的人乳头瘤病毒16的DNA(T-16)为靶DNA分子,通过夹心法将其定量捕获于微球表面,并通过本实验装置对其进行定量检测。
1 光镊原理
光镊又称单光束梯度力光阱,是利用一束高度会聚的激光生成一个三维的光梯度力阱,对微球进行捕获和操控的技术,利用的是光与物质之间相互作用的力学效应[4]。对于微米级别的粒子,可以用几何光学方法来考察其与光的相互作用。我们选取透明的介电小球为模型来阐释光镊的基本原理。在这里设介电小球的折射率大于周围介质折射率。
光子具有动量。当光入射到物体上发生反射或折射时,光将动量传递给物体,同时产生压强,这种压强称为光压,光压与入射的光强呈正相关关系。对于宏观物体,这种光压可以忽略,但是对于微纳尺度的粒子,这种光压的作用非常明显。
当激光照射到透明微米级粒子上时,光在微球的表面和内部发生反射和折射,分别产生散射力和梯度力。散射力方向与光传播方向一致,强度正比于光强,梯度力方向指向光强最强位置,与光强的梯度变化成正相关。在平行光束中选取两条光线a、b说明二维势阱的原理。实线表示入射光线和折射光线,虚线表示反射光,Fa和Fb分别表示a、b两条光线对小球的力,F表示合力。如图1(a)所示,在非匀强光场中,小球的横向受力指向光强更强处;而在图1(b)的匀强光场中,小球的横向受力为0。
二维势阱由平行光形成,光强在传播方向上(y方向)没有梯度,故微球在y方向没有梯度力来平衡散射力。微球到达光轴依然会沿光轴运动,故单个二维光学势阱无法完全束缚微球。通常用两束相对传播的光束照射微球,使其受到两个等大反向的散射力,实现捕获;或是在垂直光轴的平面上放置一个挡板,微球接触挡板后弹力与散射力平衡,也能实现捕获。
激光在光轴方向具备光强梯度才能产生轴向梯度力来与散射力平衡,以实现单光束梯度力捕获。通常让激光束通过透镜或物镜,使平行激光高度会聚,获得轴向光强梯度。这种高度会聚的光束产生的势阱称为三维势阱。图2为三维势阱中微球的受力分析。结合图2,可知微球的中心在会聚光束焦点f的下方或上方,梯度力的合力F的方向均指向焦点位置,当梯度力合力大小与散射力平衡时,微球便可被单光束激光捕获。
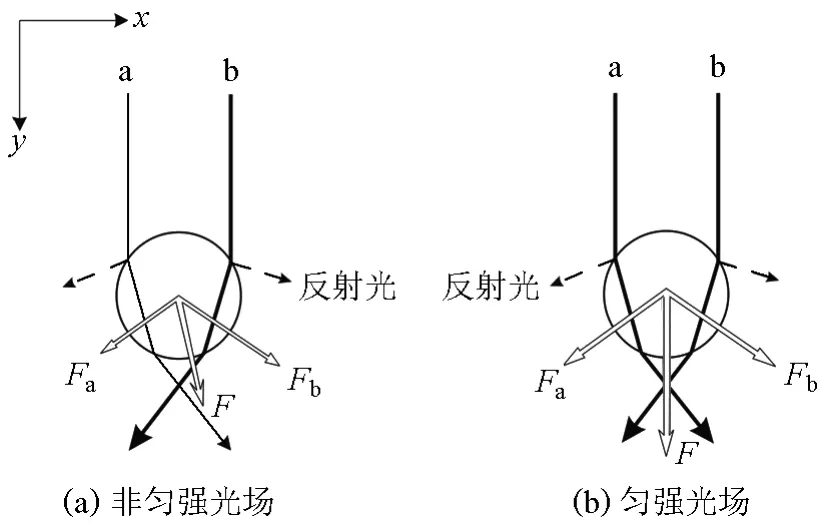
图1 二维势阱中微球受力分析

图2 三维势阱中微球受力分析
2 三维势阱的二维捕获
光镊的发展经历了二维光学势阱到三维光学势阱两个阶段;形成能完全束缚微球的三维光学势阱需使用高倍物镜。而在实际应用中,有时并不需要完全捕获微球,也不需过高的放大倍数,这时便可使用低倍物镜,形成一个会聚程度较低的光束来捕获微球。低会聚光束的轴向梯度力弱,无法平衡轴向散射力,故捕获微球的过程是先将微球吸入光斑中心,然后将其沿光传播方向推出,微球在光束的散射力和容器底/顶的弹力的作用下静止。这种形式类似二维光学势阱的捕获,但又是在三维光学势阱中实现的,故称其为三维光学势阱的二维捕获。
3 光镊-荧光分析检测方法
荧光检测是分析化学中的一种重要检测手段。近年来,该检测技术的发展主要体现在两个方面:一是研究新型的荧光标记物,如荧光蛋白[5]和量子点[6-8]等,二是开发新的荧光检测方法如流式细胞术[9]和共聚焦荧光显微镜等。
本实验采用的光镊-荧光分析检测方法是一种基于单个微球富集待测分子高灵敏度高选择性的定量分析方法,其检测对象是微米级的偶联复合微球。偶联复合微球是由微球探针偶联靶DNA后再连接标记有量子点的互补DNA制备得到。荧光的激发需要高能的激发光源,而光镊的激光光源具有单色性好、能量集中等优点,能满足荧光激发光源的要求,故可以将光镊与荧光检测相结合,检测被捕获的微球的荧光。
选用量子点代替传统的有机荧光染料作为荧光标记物。量子点是一种性能卓越的荧光标记物,具有亮度高、激发光谱宽、发射光谱窄、抗光漂白能力强等一系列优点。由于激光的能量高且集中,需要荧光标记物具有良好的耐光漂特性,量子点满足实验要求。并且量子点的一元激发、多元发射的特性也使得多元检测成为可能。
4 偶联复合微球的制备
下面以浓度为30nmol/L的靶DNA为例,简要介绍偶联复合微球的制备过程。
4.1 微球探针的制备
微球探针的制备分为两步,先将羧基微球表面修饰上亲和素,然后利用生物素-亲和素这种高效特异性反应[10],使微球表面能够牢固地结合捕获DNA。移取15μL 50mg/mL直径大小为3μm的羧基聚苯乙烯微球(阿拉丁,中国)至离心管中,加入100μL 10mmol/L MES缓冲溶液(pH5.0)洗涤两次。洗涤完毕后,依次加入40μL 1mg/mL亲和素(Sigma-Aldrich,美国),3.6μL 10mg/mL EDC(Sigma-Aldrich,美国)水溶液,室温条件下,在摇床中培育1.5h后,补加1.8μL 100mg/mL EDC水溶液,继续培育1.5h,总反应时间为3h。随后,将表面修饰有亲和素的聚苯乙烯微球与30μL 10μmol/L 3'端修饰生物素的捕获DNA(生工,上海,序列为5'-GTGTGGATAATAGAGAATGTATATCTATGG-Biotin-3')混合均匀,加入100μL 0.01mol/L PBS缓冲溶液(pH7.2),在微量振荡器中反应2h,得到微球探针,残余的捕获DNA可通过离心的方式除去。最后,将制得的微球探针悬浮于100μL杂交缓冲溶液中(20mmol/L Tris,pH8.0,200nmol/L NaCl),4℃下保存。
4.2 量子点探针的制备
量子点探针的制备同样是依据链霉亲和素-生物素高效特异性结合的原理来反应。依次移取30μL 10μmol/L 5'端修饰生物素的探针DNA(序列为5'-Biotin-ACAGAAAATGCTAGTGCTTATGCAAAT-3')和3.0μL 1μmol/L表面修饰链霉亲和素的CdSe/ZnS量子点(发射波长605nm,武汉珈源量子点公司)至离心管中混合均匀,然后补加50μL 0.01mol/L PBS缓冲溶液(pH7.2),在微量振荡器中反应1h,得到量子点探针,残余的探针DNA可通过超滤的方式除去。最后,将制得的量子点探针悬浮于50μL杂交缓冲溶液中(20mmol/L Tris,pH8.0,200nmol/L NaCl),4℃下保存。
4.3 偶联复合微球的制备
杂交过程采用简单、快速的一步法杂交反应来实现。将上述制备的微球探针、量子点探针与30μL 1μmol/L目标DNA(T-16,序列为5'-CCATAGATATACATTCTCTATTATCCACACCTGCATTTGCTGCATAA GCACTAG CATTTTCTGT-3')混合均匀,在45℃条件下,在摇床中培育2h后,洗涤两次,除去残余的目标DNA。最后,将偶联复合微球悬浮于100μL杂交缓冲溶液中(20mmol/L Tris,pH8.0,200nmol/L NaCl),4℃下保存。利用倒置荧光显微镜(尼康,ECLIPSE TE2000-U,日本),以蓝光为激发光源拍摄的偶联复合微球如图3所示。

图3 偶联量子点的复合微球的显微荧光照片
5 光镊-荧光检测装置的搭建
光镊装置通常由激光光源、耦合光路、显微镜和移动控制平台组成。通常加装CCD或CMOS摄像头,搭配计算机进行实时图像记录。目前国内实验室所用显微镜多为较昂贵的倒置荧光显微镜,Stephen P等人提出一种用有限远正置显微镜系统构建光镊的方法[11],但该方法非常复杂,不利于教学推广。我们参考无限远显微镜光镊的结构,对现有的国产有限远正置显微镜(重庆光学仪器厂)进行改造,拆除光路中的透镜,仅留下激光通路及光路中的二向色镜DM,同时将物镜替换成无限远物镜,这样就将有限远系统显微镜改造为无限远显微镜。本套装置采用三维势阱的二维捕获(以下简称二维捕获)方式捕获微球,物镜为无限远40×物镜(Olympus NA 0.60)。低倍物镜透光率较高,可降低激光透过后的功率损失。二维捕获将微球捕获到容器底/顶部光斑光强最强处,既可使微球位置稳定,实现最大程度的荧光激发,也可使每个微球的荧光激发条件保持一致。
如图4所示,光源采用波长473nm,功率0~130mW可调的DPSS激光器(长春镭仕光电科技有限公司MW-BLN-473)。激光经过L1和L2透镜组扩束准直后,经DM反射进入物镜后瞳,经物镜聚焦成为一束会聚激光,形成光学势阱,对微球进行捕获。
捕获激光同时用于荧光标记物的激发。量子点荧光信号由与显微镜结合的光谱仪采集。光谱仪由光栅单色仪(北京光学仪器厂,WDG30)和线阵CCD(日本滨松,S7031-1007)构成。由于双色分光镜DM不能完全过滤荧光信号中混有的激光,通过单色仪分光可分离残余的激光。调整光栅的角度可以将荧光或激光信号聚焦投影到适当的CCD检测范围。对于多色量子点荧光信号,可通过光栅分光后分别检测,此时CCD为多通道检测器。
6 实验结果
6.1 微球的捕获
实验中所用复合微球的基底为直径3μm的聚苯乙烯微球。复合微球分散于石英载玻片和石英盖玻片之间的液膜中,如图5所示。在实验过程中,移动二维载物台使微球靠近光斑,当接近光斑中心时,微球被吸入光斑中心,其后被压在载玻片的上表面。此时移动载物台,发现微球相对光斑中心保持静止,可知微球已被光阱捕获。
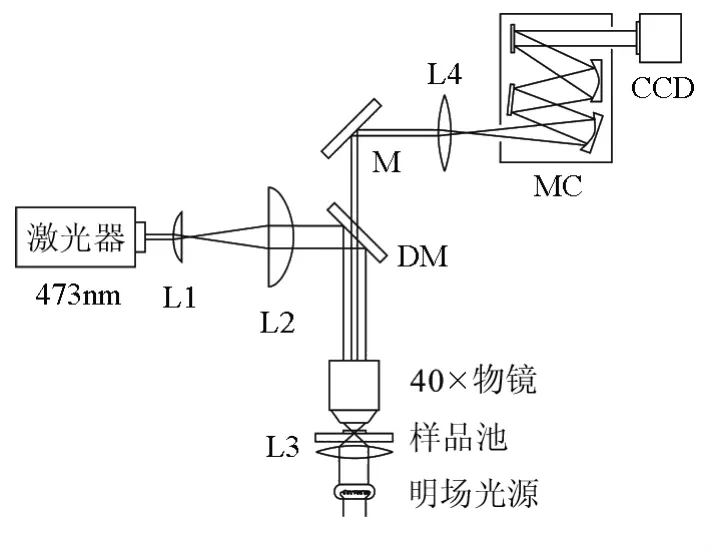
图4 实验装置示意图
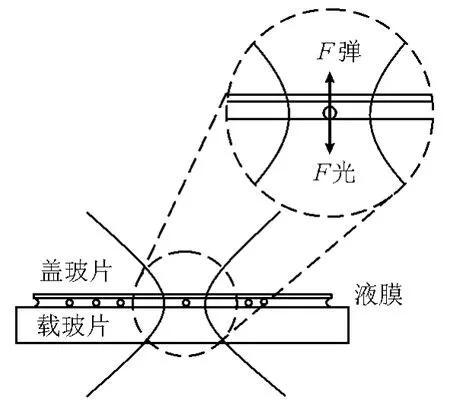
图5 三维势阱的二维捕获示意图
6.2 单个微球荧光信号的检测
将显微镜明场光源关闭,可观察到光阱中偶联复合微球的红色荧光,再将显微镜从目镜观察模式切换到信号检测模式,可从配套软件界面读出此时微球的荧光强度值。由图6可以看出,经过单色仪分光和谱带位置调整,残留蓝光已被移出CCD的检测范围,谱图中仅剩红色的量子点荧光信号峰。
6.3 工作曲线和检出限
用相同的制备方法分别制备2.5、5.0、10.0、20.0和30.0nmol/L 5种不同靶DNA浓度下的偶联复合微球,利用光镊-荧光定量检测装置检测,在相同的激光功率激发下,当CCD积分时间为7ms时,测得对应的荧光强度,每种浓度下的荧光强度均为检测50个不同微球荧光峰的统计平均结果。图7为6种富集不同浓度靶DNA(即上述5个浓度和空白)的单个复合微球的荧光光谱。结果表明:荧光强度ⅠF与c(T-16)在0~30nmol/L之间呈线性关系(图8),随着靶DNA浓度的增大,偶联复合微球的荧光强度也随之升高,ⅠF=2.96c(T-16)+24.72,相关系数为0.9745。通过测量空白样品,得到本检测方法的检出限(3σ,其中σ表示空白样品的标准偏差,n=11)为1.4nmol/L。实验表明,方法的灵敏度与CCD积分时间显著相关,当积分时间为50ms时,方法的检出限可以降低一个数量级。
7 实验总结
本实验利用实验室现有的国产正置显微镜,经过改造,构建了一台简易的光镊装置,并成功实现了单个微球的二维捕获。同时利用激光的特性,将荧光检测技术与光镊装置相结合,在实现微球捕获操纵的同时,对复合微球的荧光进行了定量检测,测定了荧光强度-靶DNA浓度的工作曲线。由于本实验对微球的操纵要求不高,故采用了三维光阱的二维捕获这种捕获方式,同时也利用了这种捕获方式不需要高倍物镜的特点,有效地降低了激光能量的损失,提高了荧光激发强度。量子点具有发射峰窄、耐光漂白等优良特性,因此非常适合作为以激光为激发光源的荧光标记物。

图6 单色仪分光后测得的光镊捕获单个微球的荧光光谱(量子点标记)

图7 6种富集不同浓度靶DNA的单个复合微球的荧光光谱
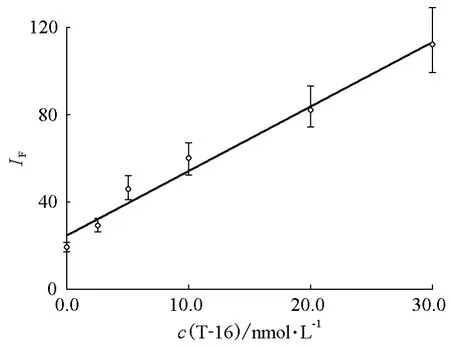
图8 荧光强度-靶DNA工作曲线
本实验通过对DNA的检测,成功地对方法的原理和通用性进行了验证。也可以通过偶联抗体或DNA适配体等方法来特异性富集血清中肿瘤标志物等分子,用于患者血清生化指标检查和癌症诊断等方面,因此本实验装置在生物医学分析领域具有潜在应用价值。
[1]Ashkin A.Phys Rev Lett,1970,24(4):156
[2]Ashkin A,Dziezic J M,Bjorkholm J E,et al.Opt Lett,1986,288(11):288
[3]黄超,王强,姚辉璐,王桂文,等.分析化学,2007,35(10):1410
[4]李银妹.生命科学新技术——光镊原理、技术和应用.合肥:中国科学技术大学出版社,1996
[5]Chalfie M,Tu Y,Euskirchen G,et al.Science,1994,263:802
[6]Chan W C W,Nie S.Science,1998,281:2016
[7]Han M,Gao X,Su J Z,et al.Nat Biotechnol,2001,19:631
[8]Chan W C W,Maxwell D J,Gao X,et al.Curr Opin Chem Biol,2002,13:40
[9]Gucker F T,O'Konskl G T,Plckard H B,et al.J Am Chem Soc,1947,68:2422
[10]Hermanson G T.Bioconjugate Techniques.New York:Academic Press,1996
[11]Smith S P,Bhalotra S R,Brody A L,et al.Am J Phys,1998,67(1):26
