多糖对肠道功能调节作用的研究进展
2015-02-10朱怡卿刘玮王虹高向东姚文兵
朱怡卿,刘玮,王虹,高向东,姚文兵
(中国药科大学生命科学与技术学院,江苏 南京 210009)
·前沿与进展·
ADVANCES IN
PHARMACEUTICAL SCIENCES
多糖对肠道功能调节作用的研究进展
朱怡卿,刘玮,王虹,高向东,姚文兵*
(中国药科大学生命科学与技术学院,江苏 南京 210009)

肠道是机体重要的消化器官,亦是共生微生物群的主要寄居场所,在维持机体正常生命活动如免疫和内分泌功能中发挥着重要作用。肠道功能紊乱与疾病的发生以及发展过程密切相关。近年来,多项研究结果显示,多糖具有肠道功能调节作用,包括通过作用于肠道黏膜参与机体免疫过程、保护肠道屏障结构和功能的完整性、调节肠道菌群组成以及刺激肠道内分泌。从伴随疾病过程中的肠道功能紊乱的角度,对多糖调节肠道功能的作用机制进行综述。
多糖;黏膜免疫;肠道屏障;肠道菌群;肠道内分泌
肠道是机体消化和营养吸收的主要器官,参与机体能量代谢调节;是机体内微生物最主要的寄居部位,含有数以千亿计的肠道微生物;是机体免疫系统的重要组成部分,阻止病原微生物、代谢废物从肠腔侵入机体。随着对肠道功能研究的深入,人们逐渐发现:肠道功能紊乱,如肠道黏膜免疫系统失调、内分泌失衡、肠道屏障受损和肠道菌群组成破坏等,与代谢性疾病、炎性肠病及神经退行性疾病密切相关。因此,筛选具有肠道功能调节作用的活性物质具有十分重要的意义。近年来的研究显示,多糖类物质可以从多个方面改善肠道功能,维持机体健康。本文从肠道的黏膜免疫、机械屏障及菌群组成等方面,分析肠道功能与疾病发生、发展的密切联系,并综述多糖调节肠道功能的机制,为将多糖类物质应用于相关疾病治疗提供参考。
1 肠道功能紊乱与相关疾病
1.1 肠道黏膜免疫紊乱
目前,机体免疫系统紊乱、长期处于慢性炎症状态是多种疾病发生的根本原因的理论已经被人们广泛接受[1]。肠道黏膜免疫系统占整个机体黏膜免疫系统的70%,其功能的紊乱是诱发机体炎症反应,致使疾病发生的重要因素。
肠道相关T细胞分为诱导型和辅助型两大类。前者包括FoxPro3+诱导型T(inducible regulatory T,iTreg)
细胞、IL-10分泌型FoxPro3-Tr细胞,后者包括辅助型T细胞17(Th17)、辅助型T细胞1(Th1)。这两类T细胞的分化在维持肠道黏膜免疫中发挥最为重要的作用:FoxP3+iTreg细胞促进免疫耐受的形成,Th17和Th1促进炎症反应发生。正常生理状态下,这两类T细胞通过释放细胞因子相互作用,处于动态平衡的状态。Badami等[2]研究发现,这两类T细胞的相互作用失衡,FoxP3+iTreg细胞分化缺陷,将诱发机体免疫系统攻击胰岛β细胞,致使胰岛β细胞功能缺陷,引起1型糖尿病。而在对溃疡性结肠炎的研究中,人们发现Treg细胞的缺失会使溃疡性结肠炎模型小鼠的病症恶化[3]。
T细胞的分化不仅依赖于T细胞间的相互作用,还依赖肠道黏膜免疫系统中的抗原递呈细胞(antigenpresenting cells,APCs),包括树突状细胞(DC)和巨噬细胞。按照APCs表面分子可将其分为CD11c、CD11b和CD103等多种亚型。这些APCs通过诱导肠道相关T淋巴细胞分化,在维持肠道黏膜免疫系统平衡中发挥重要作用。体外研究表明CD103+DC借助肿瘤生长因子-β(TGF-β)诱导T细胞向FoxP3+iTreg细胞分化,使机体形成免疫耐受[4]。同时,表达Toll样受体5(TLR5)的CD11c+、CD11b+及CD103+细胞在被外来抗原激活后,将促进B细胞分泌IgA,诱导Th17和Th1分化,从而引发炎症反应[5]。APCs调节T淋巴细胞分化的作用依赖IL-10和IL-6等多种炎症相关因子,其功能缺陷也将导致机体炎症反应,促使糖尿病发生。在对糖尿病人群的研究中,Vijay-Kumar等[6]发现,在2型糖尿病患者机体内,巨噬细胞向炎性巨噬细胞分化,并伴有TNFα、IL-6等促炎因子释放。
1.2 肠道屏障损伤
肠道屏障主要由肠道上皮细胞和细胞间连接构成。肠道上皮细胞包括杯状细胞、吸收细胞和潘氏细胞等;细胞间连接有桥粒连接、紧密连接和黏附连接等。
肠道屏障在功能上有辅助肠道黏膜免疫的作用:通过形成物理屏障、分泌抗菌肽和黏蛋白,有效地保护机体不受外源微生物的侵入,减少炎症反应发生;同时,通过介导跨膜转运和细胞旁转运,选择性地进行营养物质吸收。肠道屏障结构和功能的完整性在维持肠道黏膜免疫中发挥重要作用,其损伤是肠道黏膜免疫系统失衡的早期事件,推动机体炎症反应持续发生。细胞间的紧密连接通过调节细胞旁转运,在维持肠道屏障结构和功能的完整性中十分重要,其表达量的减少,是肠道屏障损伤的重要标志。表1总结了主要的细胞紧密连接的结构和功能。大量临床研究证实,肥胖、胰岛素抵抗、溃疡性结肠炎等疾病的发生和发展伴随着肠道屏障功能的损伤以及ZO家族蛋白(zonula occludens,ZOs)、咬合蛋白(occludin)和闭合蛋白(claudins)等细胞紧密连接表达的改变[7-8]。因此以紧密连接为治疗靶点,促进其表达有利于修复肠道屏障损伤,缓解多种疾病。
肠道损伤诱发炎症和推动疾病病程发展的主要机制包括:(1)增加机体内抗原的暴露机会,诱发自身免疫反应;(2)肠道微生物代谢的内毒素脂多糖(LPS)通过受损的肠道屏障进入血液。LPS可以激活Toll样受体4(Toll-like receptor 4,TLR4)下游信号通路,促进促炎因子释放,使机体处于慢性炎症状态中[9]。

表1 细胞紧密连接的结构和功能Table1 The structure and function of the tight junctions
1.3 肠道菌群功能失调
肠道菌群是人体内最大的共生微生态系统,在与人类共同进化的数百万年中,通过自然选择、个体适应,与宿主形成了一个相互制约又相互依存的整体:降解不能被人体消化的营养物质,合成机体必需的维生素;通过与肠道免疫细胞相互作用,修复损伤的黏膜屏障,更新肠道上皮细胞;通过其直接分泌或间接促进机体自身分泌生物活性物质,调节机体行为,参与并影响机体的生命活动。
大量研究表明,机体肠道内菌群组成的改变与多种疾病的发生密切相关,表2总结了糖尿病、孤独症、肝病患者肠道菌群组成的变化。其中最主要的特点包括:厚壁菌门与拟杆菌门间比例改变,菌群组成多样性下降,以及有益厌氧菌减少。
以糖尿病为例,肠道菌群组成的改变从以下2个方面诱发该疾病。一方面,正常生理条件下,肠道菌群代谢产生多种底物和酶,通过参与营养物质的消化、吸收及转化,调节机体能量代谢。病理状态下菌群组成发生变化,造成能量代谢失衡,继而引起脂肪累积和胰岛素抵抗。例如,摄入含有相同热量的高脂饲料时,与无菌小鼠相比,普通小鼠体内脂肪总量上升,并伴有胰岛素抵抗症状。若将普通小鼠的肠道菌群移植到无菌小鼠体内,则可以逆转这种差异[19]。另一方面,肠道菌群通过损伤的肠道屏障,诱导机体处于持续的炎症反应状态。有报道指出,病理状态下,肠道菌群组成发生变化,菌群代谢毒素进入血液循环,诱发机体炎症。该报道称,糖尿病患者血液中微生物RNA的含量显著高于正常人,TNF-α、IL-6等炎症相关因子的水平也异常升高[20]。
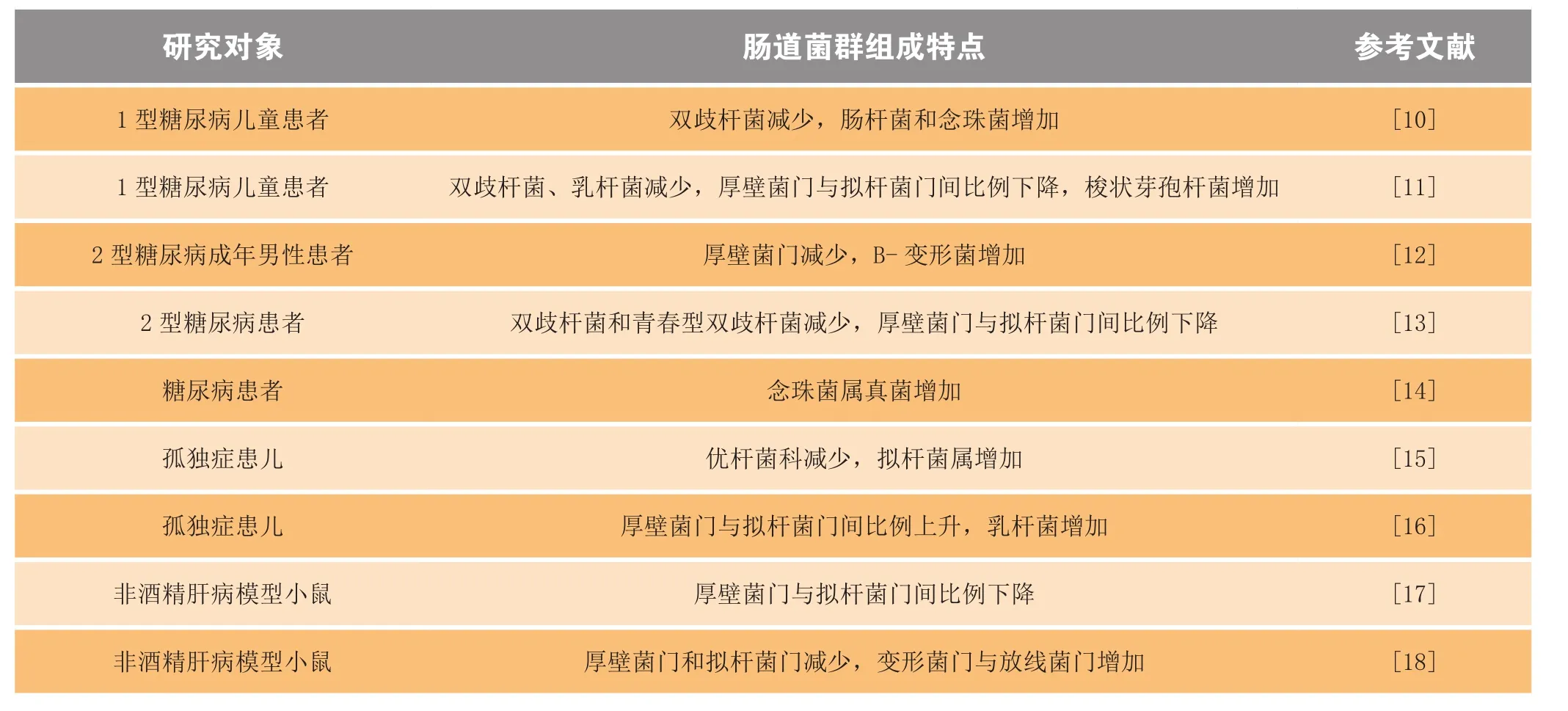
表2 肠道菌群组成变化特点Table2 Characteristic changes in the composition of intestinal flora
1.4 肠道内分泌变化
肠道黏膜免疫紊乱、肠道屏障损伤和肠道菌群功能失调通过直接或间接作用,诱导机体炎症反应发生,诱发疾病。肠道内分泌则依赖激素作用,影响疾病病程。
自1932年La Barre首次提出肠促胰岛素(incretin)的概念以来,肠道内激素的研究不断深入。当前研究表明,肠道内激素的表达发生变化是糖尿病从发病早期向中期过渡的重要环节之一。糖尿病患者的饮食摄取增加,能量消耗减少,以及胰岛素的释放不足与肠道内激素水平变化密切相关。机体所摄入的营养物质通过与肠道内分泌细胞表面受体相互作用,调节肠道内激素的释放。此外,肠道内分泌也与神经退行性疾病密切相关,阿尔茨海默病患者表现有脑部慢性炎症和胰岛素抵抗等症状,补充肠道内激素能够改善阿尔茨海默病患者的神经退化症状[21]。表3总结了分布于肠道不同部位参与肠道激素释放的受体。
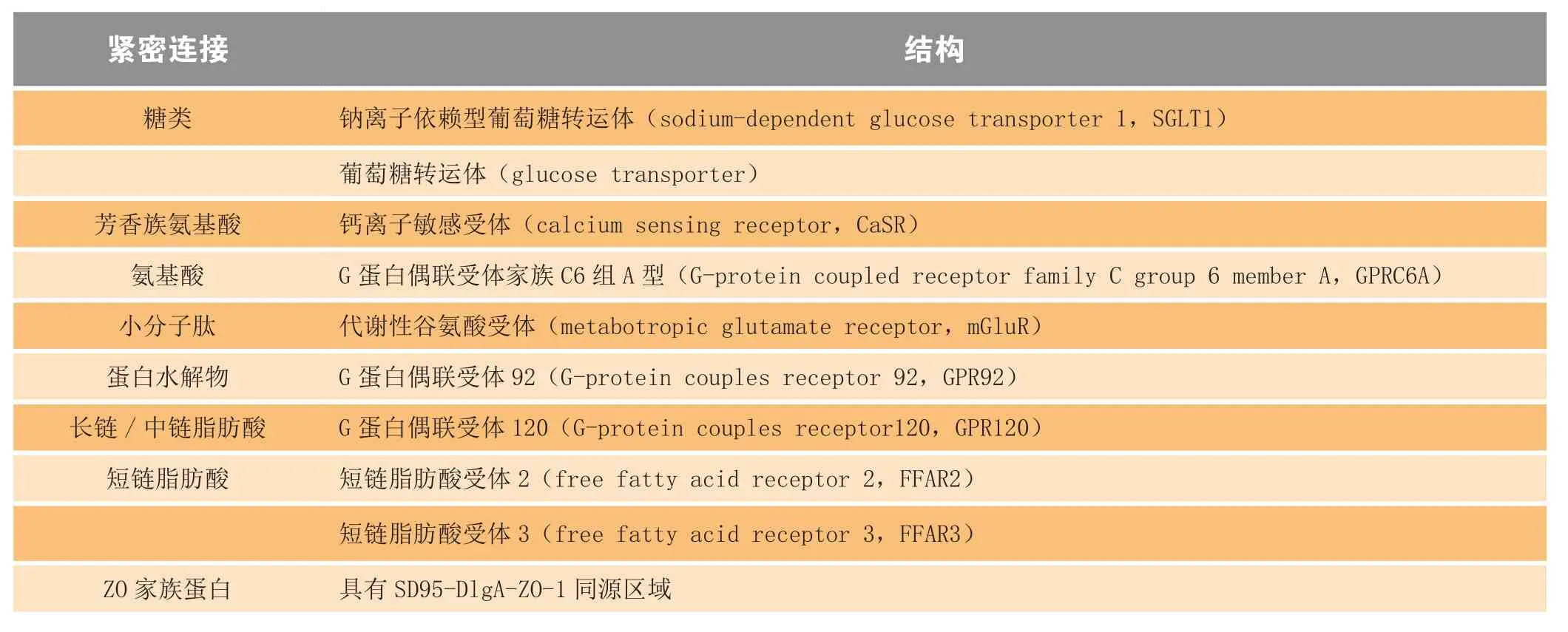
表3 分布于肠道不同部位的营养物质敏感受体Table3 Nutrient-sensing receptors distributed in different parts of intestine
最早分离纯化得到的肠道内激素是肠促胰岛素,包括胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)和葡萄糖依赖性促胰岛素肽(glucosedependent insulinotropic peptide,GIP)。此后,通过Roux-en-Y胃分流手术发现,YY肽(peptide YY,PYY)、肠促胰酶肽(cholecystokinin,CCK)和舒血管肠肽(vasoactive intestinal peptide)也是与血糖调节相关的肠道内激素[22],其各自的来源和具体功能见表4。其中,GLP-1是目前研究最多的一类肠道激素,通过促进胰岛β细胞增殖,增加胰岛素分泌,减少食欲和抑制胰高血糖素分泌发挥调节血糖的功能。GLP-1在体内的半衰期较短,进入体内循环后很快会被二肽基肽酶4(dipeptidyl peptidase 4,DPP4)降解(Todd等,Eur J Clin Invest, 1997年)。

表4 肠道内激素的来源和功能Table4 The origin and function of intestinal hormones
2 多糖调节肠道功能机制
2.1 免疫调节
肠道免疫系统紊乱所导致的机体炎症反应,以及自身免疫反应在疾病发展过程中的作用一直受到人们的关注。寻找合适的免疫调节剂,帮助肠道恢复正常免疫功能,是肿瘤、糖尿病、孤独症和炎性肠病等多种疾病的有效治疗手段。多糖的免疫调节功能已经被广泛证实,从多糖类物质中筛选免疫调节剂安全可行。
研究表明,肠道菌群在与肠道黏膜免疫系统相互作用的过程中,其荚膜多糖发挥重要作用。Mazmanian等[23]从脆弱拟杆菌中获得荚膜多糖A(capsular polysaccharide A,PSA)并阐述了其对肠道相关T细胞的调节作用。PSA通过2条途径诱导分泌IL-10的Treg细胞分化,抑制炎症发生:(1)与FoxP3+iTreg细胞表面TLR2作用,直接调节Treg细胞;(2)以APCs为媒介,激活TLR2下游信号通路,间接调节Treg细胞[24]。此外,Johnson等[25]还发现,PSA还可以通过诱导一类早前未报道过的CD+Foxp-T细胞分化,抑制机体炎症反
应。另有研究报道,双歧杆菌的胞外多糖也有肠道免疫调节功能,且不同种的双歧杆菌胞外多糖具有不同的免疫调节能力。一般来说,中性高相对分子质量胞外多糖有炎症抑制作用;而酸性多糖通过诱导Th1分化,促进炎症发生[26]。
此外,膳食纤维也具有调节肠道免疫功能的潜力。其在肠道内降解并转化成短链脂肪酸(short chain fatty acids,SCFA),后者通过激活FFAR2下游信号通路,抑制单核细胞释放肿瘤坏死因子-α(TNF-α)等炎症因子,促使T细胞向Th2分化,增加IL-10释放,减少炎症发生[27]。果聚糖是一类重要的可溶性膳食纤维,动物实验表明,果聚糖能够有效降低机体内LPS水平,抑制炎症,改善代谢紊乱。在糖尿病人群中进行的研究得到了相同的结论,摄入低聚果糖能够有效地降低糖尿病患者体内促炎因子IL-6、TNF-α的表达,减轻体质量,并缓解胰岛素抵抗症状[28]。
2.2 肠道屏障保护
肠道屏障损伤是自身免疫性反应发生、机体慢性炎症形成的关键性步骤。因此,修复肠道屏障是治疗糖尿病、炎性肠病等炎症相关的慢性疾病的有效策略。
多糖类物质可从多个方面实现肠道屏障修复:(1)高相对分子质量的黏性多糖通过在肠道上皮细胞表面形成与肠道屏障黏液层相似的亲水凝胶层,维护肠道屏障结构的完整性。Del Piano等[29]发现了一种来自嗜热链球菌的高黏度胞外多糖,健康受试者摄入该多糖后,肠道的通透性下降,肠道屏障得到保护。(2)除肠道上皮细胞和细胞间的连接蛋白外,黏液层也是肠道屏障的组成部分。多糖可促进肠道上皮杯状细胞分泌黏蛋白,形成疏水黏液凝胶层,抑制有害物质对肠道上皮细胞的损害。在对低酯化度果胶的研究过程中,Hino等[30]发现,多糖的促黏蛋白分泌作用依赖于空肠中Muc2的上调。(3)细胞紧密连接在维持肠道屏障的选择透过性中发挥重要作用。多糖通过调控细胞紧密连接的表达,修复损伤的肠道屏障,保护肠道屏障功能的完整性。乌贼墨多糖能够同时在mRNA水平和蛋白水平上调小鼠肠道组织中紧密连接蛋白,包括occludin和ZO-1的表达,逆转化疗带来的肠道屏障损伤[31]。多糖的促紧密连接蛋白表达作用可能与TLR2有关,Vogt等[32]的研究表明,果聚糖通过激活肠道上皮细胞表面的TLR2,增强肠道屏障。(4)多糖在肠道内的降解转化产物SCFA是肠道上皮细胞的直接能源,其摄入可以促进肠道上皮细胞增殖,增加肠道屏障的机械强度[33]。
2.3 肠道菌群调节
长期以来,肠道菌群的存在一直被人们忽视,但随着分子生物学技术在肠道菌群研究中的应用,越来越多的研究表明,肠道菌群不仅广泛地参与机体生命活动,其组成和功能的破坏与人体许多重大疾病密切相关。肠道菌群组成的改变通过影响机体能量代谢和诱发炎症反应,在代谢性疾病、特应性疾病和发育障碍的发生发展中发挥重要作用。鉴于此,一种以改善受损肠道菌群结构与功能为思路的疾病治疗策略应运而生。
“益生元”(prebiotics)是一类能够被肠道菌群利用,并可以选择性地增加肠道内有益微生物的多糖。传统的益生元主要包括:寡聚半乳糖、寡聚果糖以及菊粉等。Sangwan等[34]研究发现,低聚半乳糖能够显著增加糖尿病大鼠肠道内乳杆菌,减少大肠杆菌,改善大鼠的胰岛素抵抗症状,降低血液中糖化血红蛋白、三酰甘油酯、总胆固醇以及肌酐和尿素含量。Vulevic[35]和de Luis[36]等又相继证实,反式寡聚半乳糖和寡聚果糖都能够通过增加有益微生物改善肥胖、胰岛素抵抗以及代谢综合征症状。此外,在特应性疾病的研究中,Arslanoglu等[37]发现,婴儿时期增加果聚糖的摄入能够降低受试者成年时期患哮喘的概率。
2.4 促进GLP-1释放
肠道内激素可以有效改善2型糖尿病患者胰岛素分泌不足和胰岛素抵抗症状和阿尔茨海默病患者的神经功能退化。因此,开发GLP-1类似物、GLP-1受体激动剂以及DPP4活性抑制剂一直是降糖药物和神经功能保护药物研发的热点。但是,持续服用GLP-1类似物有引发胰腺炎甚至胰腺癌的风险,而多糖类物质可以有效促进内源性GLP-1持续释放。多糖类物质促进GLP-1释放的主要作用机制包括2个方面。其一,糖胺聚糖通过与肠道内分泌细胞表面受体结合,激活下游信号通路,直接发挥促进GLP-1释放作用。Liu等[38]在体外研究中发现,从甲壳素中获得的低相对分子质量壳聚糖可以通过激活促分裂素活化蛋白激酶(mitogenactivated protein kinase,MAPK)-p38依赖的信号通路,促进人类肠道内分泌细胞(NCI-H716)释放GLP-1。其二,膳食纤维类多糖通过在肠道内降解成SCFA,间接促进GLP-1释放。短链脂肪酸通过激活肠道L细胞表面FFAR2和FFAR3,促进PYY和GLP-1释放,增
加胰岛素分泌,抑制食欲,发挥调节餐后血糖的作用[39]。
3 结语
近几年来,随着对肠道功能研究的深入,人们发现,虽然代谢性疾病、炎性肠病以及神经退行性疾病等的病理特征不尽相同,但其发生、发展均与肠道功能的紊乱密切相关,调节肠道功能是治疗这类疾病的有效策略。对于多糖物质的研究表明,天然来源的多糖可以从肠道免疫、肠道屏障、肠道菌群等多个角度全方位地调节肠道功能,具有来源广泛、安全有效的独特优势。相信在不久的将来,具有肠道功能调节作用的多糖类物质在疾病治疗领域将会有广泛的应用。
[1]Dregan A, Charlton J, Chowienczyk P,et al.Chronic inflammation disorders and risk of type 2 diabetes mellitus, coronary heart disease, and stroke: a population-based cohot study [J].Circulation, 2014, 130 (10): 837-844.
[2]Badami E, Sorini C, Coccia M,et al.Defective differentiation of regulatory FoxP3+T cells by small-intestinal dendritic cells in patients with type 1 diabetes [J].Diabetes, 2011, 60(8): 2120-2124.
[3]Wang L, Ray A, Jiang X,et al.T regulatory cells and B cells cooperate to form a regulatory loop that maintains gut homeostasis and suppresses dextran sulfate sodium-induced colitis[J].Mucosal Immunol, 2015,doi: 10.1038/mi.2015.20.[Epub ahead of print].
[4]Rivollier A, He J, Kole A,et al.Infammation switches the differentiation program of Ly6Chi monocytes from anti-infammatory macrophages to infammatory dentritic cells in the colon[J].J Exp Med, 2012, 209(1): 139-155.
[5]Semmrich M, Plantinga M, Svensson-Frej M,et al.Directed antigen targetingin vivoidentifies a role for CD103(+) dentrtic cells in both tolerogenic and immunogenic T-cell responses [J].Mucosal Immunol, 2012, 5(2): 150-160.
[6]Vijay-Kumar M, Aitken J D, Carvalho F A,et al.Metabolic syndrome and altered gut microbiota in mice lacking Toll-like receptor 5 [J].Science, 328(5975): 228-231.
[7]Groschwitz K R, Hogan S P.Intestinal barrier function: molecular regulation and disease pathogenesis [J].J Allergy ClinImmunol, 2009, 124(1): 3-20.
[8]Scaldaferri F, Lopetuso L R, Petito V,et al.Gelatin tannate ameliorates acute colitis in mice by reinforcing mucus layer and modulating gut microbiota composition: Emerging role for ‘gut barrier protectors’ in IBD?[J].United European Gastroenterol J, 2014: 2(2): 113-122.
[9]Rodes L,Khan A, Paul A,et al.Effects of probiotics Lactobacillus and Bifdobacterium on gut-derived lipopolysaccharides and infammatory cytokines: anin vitrostudy using a human colonic microbiota model [J].J Microbiol Biotechnol, 2013, 23(4): 518-526.
[10]Turnbaugh P J, Bäckhed F, Fulton L,et al.Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome[J].Cell Host & Microbe, 2008, 3(4): 213-223.
[11]Amar J, Serino M, Lange C,et al.Involvement of tissue bacteria in the onset of diabetes in humans: evidence for a concept [J].Diabetologia, 2011, 54 (12): 3055-3061.
[12]Soyucen E, Gulcan A, Aktuglu-Zeybek A C,et al.Differences in the gut microbiota of healthy children and those with type 1 diabetes [J].Pediatr Int, 2014, 56(3): 336-343.
[13]Murri M, Leiva I, Gomez-Zumaquero J M,et al.Gut microbiota in children with type 1 diabetes differs from that in healthy children: a case-control study [J].BMC Med, 2013, 11(1): 46.
[14]Larsen N, Vogensen F K, van den Berg F W,et al.Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults [J].PloS One, 2010, 5(2): e9085.
[15]Le K A, Li Y, Xu X,et al.Alterations in fecalLactobacillusandBifidobacteriumspecies in type 2 diabetic patients in Southern China population [J].Front Physiol, 2012, 3: 496.
[16]Gosiewski T, Salamon D, Szopa M,et al.Quantitative evaluation of fungi of the genus Candida in the feces of adult patients with type 1 and 2 diabetes- a pilot study [J].Gut Pathog, 2014, 6(1): 43.
[17]De Angelis M, Piccolo M, Vannini L,et al.Fecal microbiota and metabolome of children with autism and pervasive developmental disorder not otherwise specifed[J].PLoS One, 2013, 8(10): e76993.
[18]Tomova A, Husarova V, Lakatosova S,et al.Gastrointestinal microbiota in children with autism in Slovakia[J].Physiol Behav, 2015, 138: 179-187.
[19]Yan A W, E Fouts D, Brandl J,et al.Enteric dysbiosis associated with a mouse model of alcoholic liver disease[J].Hepatology, 2011, 53(1): 96-105.
[20]Bull-Otterson L, Feng W, Kirpich I,et al.Metagenomic analyses of alcohol induced pathogenic alterations in the intestinal microbiome and the effect of Lactobacillus rhamnosus GG treatment[J].PLoS One, 2013, 8(1): e53028.
[21]Hölscher C.The incretin hormones glucagonlike peptide 1 and glucosedependent insulinotropic polypeptide are neuroprotective in mouse models of Alzheimer's disease[J].Alzheimers Dement, 2014, 10(1): S47-S54.
[22]Sjostrom L, Gummesson A, Sjostrom C D,et al.Effects of bariatric surgery on cancer incidence in obese patients in Sweden (Swedish Obese Subjects Study): a prospective, controlled intervention trial[J].Lancet Oncol, 2009, 10(7): 653-662.
[23]Mazmanian S K, Round J L, Kasper D L.A microbial symbiosis factor prevents intestinal infammatory disease [J].Nature, 2008, 453(7195): 620-625.
[24]Round J L, Lee S M, Li J,et al.The Toll-like receptor 2 pathway establishes colonization by a commensal of the human microbiota [J].Science, 2011, 332(6032): 974-977.
[25]Johnson J L, Jones M B, Cobb B A.Bacterial capsular polysaccharide prevents the onset of asthma through T cell activation[J].Glycobiology, 2015, 25(4): 368-375.
[26]Hidalgo-Cantabrana C, Nikolic M, Lopez P,et al.Exopolysaccharideproducing Bifidobacteriumanimalis subsp.Lactis strains and their polymers elicit different responses on immune cells from blood and gut associated lymphoid tissue [J].Anaerobe, 2014, 26: 24-30.
[27]Masui R, Sasaki M, Funaki, Y,et al.G protein-coupled receptor 43 moderates gut inflammation through cytokine regulation from mononuclear cells [J].Infamm Bowel Dis, 2013, 19(13): 2848-2856.
[28]Dehghan P, Pourghassem Gargari B, AsghariJafar-abadi M.Oligofructose-enriched inulin improves some inflammatory markers and metabolic endotoxemia in women with type 2 diabetes mellitus: a randomized controlled clinical trial [J].Nutrition, 2013, 30(4): 418-423.
[29]Del Piano M, Balzarini M, Carmagnola S,et al.Assessment of the capability of a gelling complex made of tara gum and the exopolysaccharides produced by the microorganism Streptococcus thermophilus ST10 to prospectively restore the gut physiological barrier: a pilot study [J].J Clin Gasroenterol, 2014, 48(Suppl 1): 56-61.
[30]Hino S, Sonoyama K, Bito H,et al.Low-methoxyl pectin stimulates small intestinal mucin secretion irrespective of goblet cell proliferation and is characterized by jejunum Muc2 upregulation in rats [J].J Nutr, 2013, 143(1): 34-40.
[31]Zuo T, Cao L, Li X,et al.The squid ink polysaccharides protect tight junctions and adherens junctions from chemotherapeutic injury in the small intestinal epithelium of mice [J].Nutr Cancer, 2015, 67(2): 364-371.
[32]Vogt L M, Meyer D, Pullens G,et al.Toll-like receptor 2 activation by β2→1-fructans protects barrier function of T84 human intestinal epithelial cells in a chain length-dependent manner [J].J Nutr, 2014, 144(7): 1002-1008.
[33]Chambers E S, Morrison D J, Frost G.Control of appetite and energy intake by SCFA: what are the potential underlying mechanism [J].Proc Nutr Soc, 2014, 12(1475-2719): 1-9.
[34]Sangwan V, Tomar S K, Ali B,et al.Hypoglycaemic effect of galactooligosaccharides in alloxan-induced diabetic rats [J].J Dairy Res, 2015, 82(1): 70-77.
[35]Vulevic J, Juric A, Tzortzis G,et al.A mixture of trans-galactooligosaccharides reduces markers of metabolic syndrome and modulates the fecal microbiota and immune function of overweight adults [J].J Nutr, 2013, 143(3): 324-331.
[36]de Luis D A, de la Fuente B, Izaola O,et al.Double blind randomized clinical trial controlled by placebo with a fos enriched cookie on saciety and cardiovascular risk factors in obese patients [J].ButrHosp, 2013, 28(1): 78-85.
[37]Arslanoglu S, Moro G E, Schmitt J,et al.Early dietary intervention with a mixture of prebiotic oligosaccharides reduces the incidence of allergic manifestations and infections during the frst two years of life[J].J Nut, 2008, 138(6): 1091-1095.
[38]Liu S H, Huang Y W, Wu C T,et al.Low molecular weight chitosan accelerates glucagon-like peptide-1 secretion in human intestinal endocrine cells via a p38-dependent pathway [J].J Agric Food Chem, 2013, 61(20): 4855-4861.
[39]Gwen T, Helen H, Yu S L,et al.Short-chain fatty acids stimulate glucagon-like-peptide-1 secretion via the G-protein-coupled receptor FFAR2 [J].Diabetes, 2012, 61(2): 364-671.
Advances in Researches on Regulatory Effect of Polysaccharides on Intestinal Tract Function
ZHU Yiqing, LIU Wei, WANG Hong, GAO Xiangdong, YAO Wenbing
(School of Life Science and Technology, China Pharmaceutical University, Nanjing 210009, China)
As an important digestive organ, intestinal tract is also dominated by symbiotic microbes.It plays a crucial role in maintaining human health, such as immunity and endocrine functions.Functional disorder of intestinal tract is closely related to the development of many diseases.Recently, many studies have indicated that polysaccharides have regulatory effect on the function of intestinal tract.The underlying mechanism includes involvement in immunity by affecting intestinal mucosa, protection of intestinal barrier, regulation of intestinal flora composition and stimulation of intestinal endocrine.This paper summarized the regulatory mechanisms of polysaccharides on the function of intestinal tract from the aspect of intestinal disorders in disease progression.
polysaccharide; mucosal immunity; intestinal barrier; intestinal fora; intestinal endocrine
Q539; R333.3
A
1001-5094(2015)04-0293-07
接受日期:2015-03-05
项目资助:江苏高校优秀科技创新团队
*通讯作者:姚文兵,教授;
研究方向:生物药物的研究;
Tel:025-83271218;E-mail:wbyao@cpu.edu.cn
