细胞穿膜肽介导蛋白/多肽类药物输送的研究进展
2015-02-10张娅洁陈应之杨志民黄永焯
张娅洁,陈应之,杨志民,黄永焯*
(1.中国科学院上海药物研究所,上海 201203;2.天津医科大学药学院天津市临床药物关键技术重点实验室,天津 300070;3.美国密西根大学药学院,密西根州 安娜堡48109)
·生物制药论坛· BIOPHARMACEUTICAL FORUM
细胞穿膜肽介导蛋白/多肽类药物输送的研究进展
张娅洁1,2,陈应之1,杨志民2,3,黄永焯1*
(1.中国科学院上海药物研究所,上海 201203;2.天津医科大学药学院天津市临床药物关键技术重点实验室,天津 300070;3.美国密西根大学药学院,密西根州 安娜堡48109)
编者按:2014年11月,由国家自然科学基金委员会主办,中国药科大学生命科学与技术学院、中国药科大学科技处、《药物生物技术》、《药学进展》、常州千红生化制药股份有限公司、江苏省生物化学与分子生物学学会等协办的“生物药物研发与创新青年学者高峰论坛”在中国药科大学召开,为广大医药领域研究人员特别是青年学者搭建了交流学术观点、分享研究成果的宝贵平台。会议期间,来自中科院、第四军医大学、北京大学、复旦大学等多家具有国内顶尖生物制药研究实力的科研机构的专家学者们围绕“生物药物领域的发展趋势、前景预测和展望”、“生物药物研发与产业中的新思路、新技术、新方法”、“生物药物成药性研究”等主题展开了充分交流与探讨。医药产业关系国计民生,在国家经济发展中具有举足轻重的地位,而生物制药更是具有巨大的发展前景。本刊编辑部特邀部分专家作客本期“生物制药论坛”栏目,与读者分享他们在该领域的科研思路和精彩观点,为生物药物的研发提供参考。

在当前药物研发中,蛋白/多肽类药物占据着重要地位。然而,此类药物大多需进入细胞内才能发挥作用,故细胞摄取率低的问题成为制约其发展的关键因素。细胞穿膜肽是一类富含精氨酸的短肽,自身具有较强的生物膜穿透能力,可携带多种大分子甚至是纳米粒入胞。因此,穿膜肽被广泛应用于药物输送,且基于穿膜肽介导药物胞内输送,成为解决蛋白/多肽类药物入胞问题的优选策略。主要综述穿膜肽介导蛋白/多肽类药物输送用于不同疾病治疗的研究进展。
细胞穿膜肽;蛋白;多肽;胞内输送
近30年来,随着人类对生命科学探知的逐渐深入,以基因工程、酶工程等为代表的生物技术得到了前所未有的突破和进步,生物药物的研发也随之得到长足发展,高速递增的研发投入促进了众多生物药物的问世。在1989年,治疗药物市场上只有13种生物药物,而到2012年,这一数字增长了16倍,达210种[1]。
凭籍令人满意的临床效果,生物制药在医药领域中起着越来越重要的作用。现阶段生物药物的研发与临床
应用以蛋白/多肽类药物为主,此类药物具有以下优势:1)相较于传统小分子药物而言,此类药物靶向性更好,因而对正常组织和器官的毒性较低;2)由于此类药物大多来源于人体,故生物相容性较好,不易引起机体免疫应答,对正常生理过程的影响甚少;3)此类药物可以作为基因药物的下游替代药物,能避免基因药物脱靶的潜在风险。然而,作为生物大分子药物,蛋白/多肽类药物存在着缺乏主动跨膜转运机制、难以有效地被细胞摄取等缺点,这对于需要进入细胞内才能发挥作用的此类生物药物来说,极大地影响了其生物利用度。
因此,利用细胞穿膜肽(cell-penetrating peptides, CPP)介导生物大分子药物的体内输送,成为近年来研究热点。CPP是一类富含精氨酸或赖氨酸的多肽,其序列长度一般少于20个氨基酸。上世纪八九十年代,便有研究发现来自于HIV-1病毒的Tat蛋白及其功能结构域可以高效穿越细胞膜进入细胞(Frankel等,Cell, 1988年; Green等,Dis Markers, 1990年),从而开启了CPP的应用研究。随后,Fawell等(Proc Natl Acad Sci USA, 1994年)通过化学偶联的方法,将CPP Tat共价修饰于模型蛋白药物(如β-半乳糖苷酶、辣根过氧化物酶、RNA酶等)上,并成功地利用CPP介导这些活性生物大分子进入细胞内,且发现CPP介导大分子药物进入细胞的行为不受细胞类型的影响。这揭示了CPP的穿膜功能具有普适性,极大地促进了CPP在药物输送(drug delivery)领域的应用。后来,又有研究者将Tat片段的基因序列插入到含有目的蛋白序列的质粒中,利用细菌表达系统,成功表达出融合有CPP的目的蛋白(Ezhevsk等,Proc Natl Acad Sci USA, 1997年;Nagahara等, Nat Med, 1998年)。Dowdy研究团队也发现,经腹腔注射的CPP-β-半乳糖苷酶融合蛋白能够有效地穿越血脑屏障,进入脑组织(Schwarze等,Science, 1999年)。这些奠基性的研究工作,极大地促进了对CPP介导大分子药物输送的广泛研究与应用。CPP不仅可以携带化学小分子药物入胞,还可介导核酸、蛋白、脂质体、高分子聚合物和无机纳米材料等穿越细胞膜而进入细胞[2]。因此,CPP技术被形象地比喻为“特洛伊木马”[3]。
然而,由于具有强大的穿越生物膜能力,CPP可能会显著改变所携蛋白/多肽类药物的体内分布,导致药物广泛的组织分布。为了减少CPP介导的药物非特异性分布,实现靶向给药,Yang研究小组设计了一种抗体靶向的触发式前药型CPP介导给药系统,并命名为 ATTEMPTS(Antibody Targeted, [protamine] Triggered, Electrically, Modified Prodrug-Type Strategy)。如图1所示,该系统包括两个模块:CPP修饰的药物和肝素修饰的抗体,其设计原理是,利用肝素与CPP的静电及亲和作用,通过非共价方式将蛋白药物和抗体连接成一个具有靶向作用的给药系统。其中,抗体介导为蛋白药物赋予了靶向性,使其能更好地在肿瘤部位富集;当注射鱼精蛋白时,由于鱼精蛋白与肝素具有更强的亲和力,从而将CPP修饰的药物置换并释放出来;随后,药物在CPP介导下进入靶细胞发挥作用[4-7]。
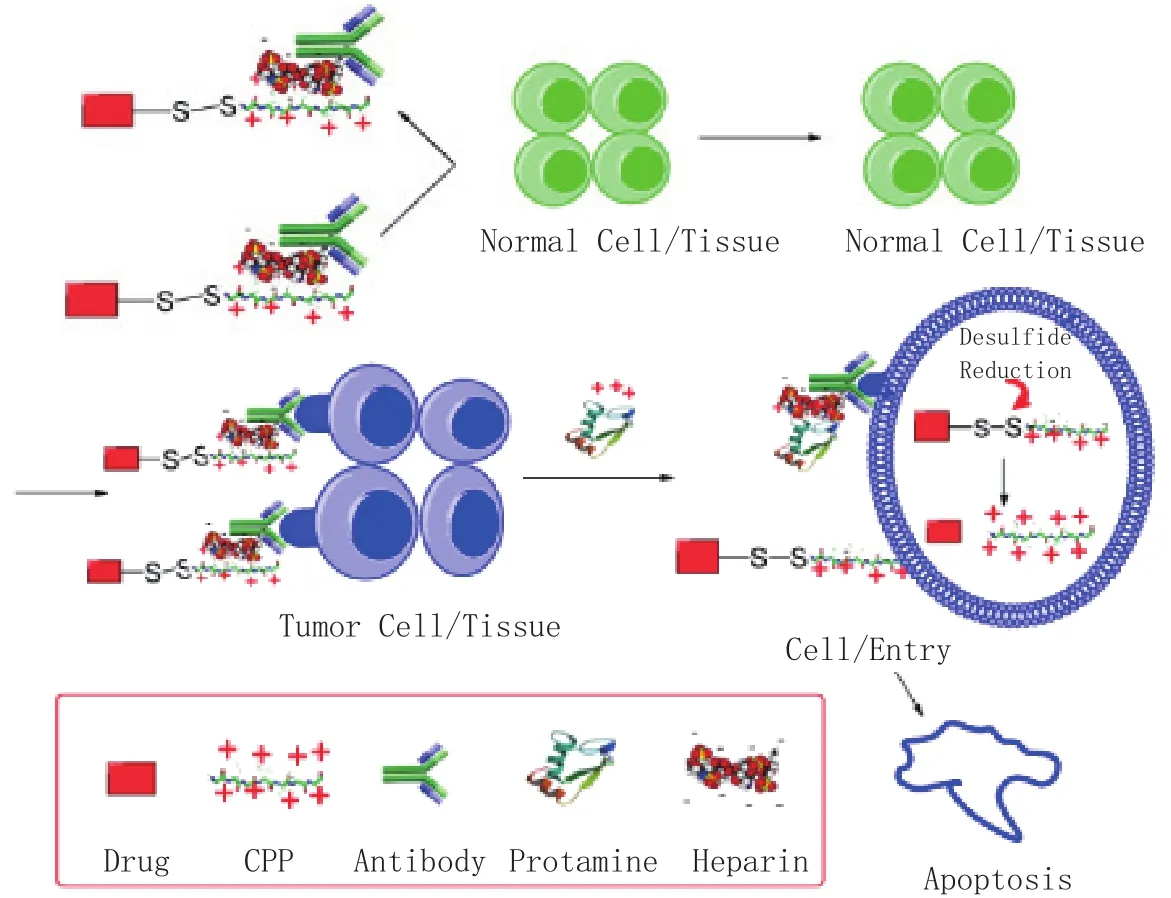
图1 ATTEMPTS 系统介导抗肿瘤药物输送示意图Figure 1 Schematic illustration of anticancer drug delivery mediated by ATTEMPTS system
此外,人们还针对其他一些基于肿瘤微环境激活(如pH敏感/肿瘤酶敏感等)的穿膜输送策略,开展了一系列研究,其目的都是为了让CPP的膜穿透作用仅限于靶向特定组织[7]。
CPP与蛋白的连接方式主要有化学偶联(即共价连接)、基因重组、静电吸附(即非共价连接)和蛋白载体表面修饰等[7]。所连接的蛋白种类也十分广泛,包括生长因子、胰岛素、酶类、细胞毒素等[3]。本文主要针对CPP介导蛋白/多肽类药物输送用于不同疾病治疗作一综述。
1 用于肿瘤治疗
相较于阿霉素、紫杉醇等小分子抗肿瘤药物,以蛋白/多肽类药物为代表的大分子抗肿瘤药物有着极高的生物活性。
1.1 穿膜肽-蛋白毒素
一些来源于植物的蛋白毒素可以起到很好的杀死肿瘤细胞的作用。例如,核糖体失活蛋白(ribosome inactivating proteins, RIP)可以作用于真核细胞核糖体,抑制核糖体功能,从而通过阻碍肿瘤细胞中蛋白质的合成来杀死细胞。一旦进入肿瘤细胞,一个蛋白毒素(如RIP)分子就足以杀死一个肿瘤细胞,而小分子药物要达到同样的肿瘤细胞杀灭效果,则至少需要104~105个分子[8]。不过,针对肿瘤细胞核糖体发挥作用的蛋白毒素药物需要进入细胞才能发挥作用,而CPP介导给药技术则为解决这一问题提供了一个极具前景的重要手段。Yang研究团队分别通过化学偶联和蛋白融合的方式,成功获得了连接有CPP Tat或低分子质量鱼精蛋白(LMWP)的RIP Gelonin,其具有较好的体内外肿瘤抑制活性。酶活性实验显示,经CPP修饰和无修饰的Gelonin其N-糖苷酶活性相当,表明CPP的引入并不影响蛋白药物的固有活性。细胞实验显示,CPP修饰的Gelonin其细胞毒性较未修饰的Gelonin高100多倍,表明CPP能显著提高蛋白药物的入胞效率。体内实验也显示,CPP能携带Gelonin进入肿瘤组织,发挥抑瘤作用;与无修饰的Gelonin相比,连接有CPP的Gelonin不仅在同等剂量下抑瘤作用显著,在更低剂量下亦具有明显的抑瘤优势[9-11]。另外,Shin等[4,9]将ATTEMPTS系统经一系列修饰后,成功地应用于RIP的输送。该研究团队将肝素修饰的癌胚抗原单克隆抗体与CPP修饰的Gelonin通过静电吸附作用构建了药物复合物,并将其用于小鼠皮下移植肿瘤模型。结果发现,药物复合物中的抗体可发挥靶向功能,介导复合物输送至肿瘤部位;然后在鱼精蛋白作用下,CPP修饰的Gelonin从复合物中解离释放,令暴露的CPP成功地介导Gelonin输送入肿瘤组织/细胞,发挥抑瘤作用。
1.2 穿膜肽-抗体
在肿瘤治疗领域,抗体药物占据越来越重要的地位,且已有多个该类重磅药物被开发出来。抗体药物通过拮抗相应的受体或抗原,抑制肿瘤生长的信号通路,从而发挥治疗作用,如抗血管内皮生长因子(VEGF)抗体[12]和抗人表皮生长因子受体-2(HER2)抗体[13]。然而,由于存在“结合位点屏障”(binding-site barrier),即抗体与肿瘤组织表面抗原或受体结合后会形成一层物理屏障,从而阻碍后续抗体的进入;并且抗体在肿瘤组织中扩散缓慢,难以有效进入到肿瘤组织的深部(Fujimori等,J Nucl Med, 1990年)。而CPP的连接修饰可有效提高抗体在肿瘤内部的穿透能力,改善抗体类蛋白药物的肿瘤治疗效果。
实验研究显示,将HIV-Tat 的37 ~ 62位氨基酸肽段与抗肿瘤抗体Fab片段连接后,可明显提高抗体片段的细胞摄取量(Anderson等,Biochem Biophys Res Commun, 1993年);抗Akt单链抗体多变区与来源于Kaposi成纤维细胞生长因子的CPP相连接后,抑瘤效果得到很大提升[14];CPP的连接修饰可显著延长单链抗体在肿瘤中的滞留,从而增强抗体对肿瘤的杀伤力[15]。
此外,CPP与抗体的连接还可以应用于肿瘤的诊断。如,Reilly团队将Tat与抗表皮生长因子(EGF)诱导的p21抗体相连接,用于乳腺肿瘤的诊断[16-18]。而且,该团队还将这个方法用于探测放射性免疫偶联物(radioimmunoconjugate, RIC)对曲妥珠单抗诱导的p27蛋白表达水平,实验结果显示,连接有CPP的111In-antip27-TAT在细胞中的滞留时间相对延长,从而可以更准确有效地检测到p27(kip1)蛋白表达水平[19]。
1.3 穿膜肽-促凋亡因子
实体肿瘤中存在着低氧区域,这些区域对化疗和放疗不敏感。肿瘤组织通常富含缺氧诱导因子 (hypoxia-
induced factor, HIF)(Huang等 ,Proc Natl Acad Sci USA, 1998年),HIF-1α 结构中具有一个氧依赖性降解域(oxygen-dependent degradation domain, ODD), 该 氨基酸序列遇氧会发生降解。据此,Harada等[20]构建了一种由Tat、ODD和凋亡酶原pro-Caspase-3构成的融合蛋白Tat-ODD-pro-Caspase-3,这种蛋白在缺氧条件下(如肿瘤组织中)具有稳定性,而pro-Caspase-3可被激活成Caspase-3,从而激活细胞凋亡程序;但在含氧环境(如正常组织)中,由于融合蛋白所含的ODD会被泛素-蛋白酶体系统迅速降解,导致Tat与pro-Caspase-3分离而无法将其带入细胞中发挥作用。荷瘤小鼠实验显示,Tat-ODD-pro-Caspase-3的静注可产生很好的肿瘤杀伤效果。此外,还有研究者采用同样技术构建了Tat-ODD-p53融合蛋白,用于输送肿瘤抑制蛋白p53。体外实验显示,Tat-ODD-p53可促进H1299细胞凋亡。荷瘤小鼠实验也表明,此融合蛋白具有明显的抑瘤作用[21-22]。
1.4 穿膜肽-热激蛋白
热激蛋白又称热休克蛋白(heat shock proteins, HSP),是一种在高温或低温、高盐、缺水等微环境中生物体内正常蛋白的合成受到抑制时诱导合成的新的或功能增强的应激蛋白,它可通过泛素-蛋白酶体通路清除严重受损的蛋白质,帮助新合成的蛋白质正确折叠,提高细胞对应激原的耐受性[23]。在肿瘤免疫中,HSP70充当多重角色:一方面,它可以作为“分子伴侣”参与肿瘤细胞的功能代谢,保护肿瘤细胞免受损害;另一方面,它可以与肿瘤特异性多肽相结合,并将其递送到抗原呈递细胞(antigen-presenting cells, APC),从而激活T细胞,在参与肿瘤抗原的免疫反应中发挥着重要作用[24]。因此,HSP作为肿瘤疫苗可以刺激肿瘤特异性免疫反应,激发肿瘤特异性CD8+T细胞的增殖和杀伤作用,从而抑制肿瘤的生长。另外,HSP对抗肿瘤的作用还体现在,它可以通过提高分子伴侣疫苗的抗原结合能力、对抗免疫抑制性肿瘤微环境等作用来促进细胞毒淋巴细胞(cytotoxic lymphocyte, CTL)进入肿瘤并发挥作用[25]。
有研究者将HSP70与CPP Tat进行融合,结果发现,Tat-HSP70融合蛋白可提高HSP70的穿膜能力,并在细胞内聚积,从而显著增强HSP的细胞保护作用及其他功能[25]。
2 用于糖尿病治疗
胰岛素是临床上治疗糖尿病的首选药物。然而,受限于在无创性给药方式中较差的药代动力学表现和作为蛋白药物的低稳定性等诟病,目前临床使用的胰岛素只能以注射为给药方式,因而患者依从性差。所以,非注射途径给药剂型,如可口服、经皮或鼻腔给药等新的胰岛素制剂的研究与开发,一直是制药领域的重点与热点。其中,胰岛素口服给药剂型研究得最多。然而,胰岛素在胃肠道不仅不易吸收,还极易被酶解,且跨越生理屏障时其稳定性会受到极大影响[26]。
CPP介导给药技术为提高口服胰岛素的吸收提供了一个极具潜力的策略。例如,有研究者采用化学偶联方法将胰岛素与Tat连接,结果,体外实验显示,Tat-胰岛素的肠道吸收效率是未修饰胰岛素的6~8倍,同时它保留了胰岛素的完整活性[27]。在另一项研究中,研究人员使用聚乙二醇(PEG)作为连接臂,将CPP LMWP与胰岛素进行偶联,结果,体外实验显示,相较于无修饰胰岛素,胰岛素-PEG-LMWP对肠黏膜单层细胞的穿越能力提高了5倍;且动物实验也证实CPP的修饰可以显著提高胰岛素的生物利用度[28]。
3 用于脑部疾病治疗
血脑屏障能够选择性阻止某些外源性物质(如病原体和治疗药物)从血液循环系统进入中枢神经系统,从而阻碍药物在脑部发挥作用,成为脑部疾病治疗的一大瓶颈。20世纪末,Dowdy研究团队便发表论文揭示,CPP可携带蛋白穿过致密的完整血脑屏障(Schwarze等,Science, 1999年)。这是蛋白/多肽类药物脑部输送研究的突破性进展。其后,CPP介导脑部给药的研究获得了进一步的显著发展。例如,将Tat连接于功能性蛋白(如Bcl-xL、D-JNKI1等),用于治疗缺血性神经坏死,结果显示,Tat的修饰可提高这些蛋白药物在脑部的浓度,显著减少卒中模型小鼠脑部缺血性神经细胞的凋亡,从而减少脑部梗死体积和神经损伤[29-30]。还有研究人员将一种由39个氨基酸组成的CPP分别融合到β-半乳糖
苷酶和脑源性神经因子(BDNF)上,从而提高了这两种蛋白进入神经中枢的效率[31]。
鼻腔和中枢神经系统间在解剖生理上存在着嗅神经通路,所以鼻腔给药可成为克服血脑屏障进行药物输送的途径之一。但是,蛋白药物很难穿过鼻黏膜,这使得通过鼻腔给药途径输送蛋白药物的生物利用度很低。而利用CPP介导给药技术,可以有效解决这一问题。胰岛素在抵抗神经退行性疾病中具有重要的作用,因此,脑部输送胰岛素药物,可能为此类疾病提供极具潜力的治疗手段。有研究表明,采用Tat修饰装载有胰岛素的聚乳酸聚乙醇酸共聚物[poly(lactic-co-glycolic)acid, PLGA],可有效地将胰岛素经鼻-脑通路输送至脑内[32]。
4 用于心脏疾病治疗
心肌细胞上表达有一种名为GaTa4的转录因子,在发生缺血性心肌病时,心肌细胞会上调GaTa4因子,该因子可以上调降压基因,使细胞代偿性肥大,从而降低心肌损伤,调节心脏的压力性反射[33]。Bian等[34]建立了成纤维细胞稳转株,可表达GaTa4因子和CPP VP22的融合蛋白GaTa4-VP22,并将这种成纤维细胞与间充质干细胞(mesenchymal stem cell, MSC)共培养,结果发现,MSC中GaTa4诱导性基因troponin1的表达量升高;同时,研究还发现,GaTa4-VP22进入细胞后可以改善心肌梗死模型鼠的血管重塑,并增强其心脏功能。
5 用于疫苗输送
抗原进入体内后,会被相应的免疫细胞捕获、呈递及加工。采用化学偶联或基因重组的方法使CPP与抗原结合,可提高抗原进入免疫细胞的效率,从而提高该抗原的免疫效果[35]。
Justesen等[36]将Tat与p53的融合蛋白rTat-p53输送到树突状细胞,以此激发小鼠p53特异性的T细胞免疫。且有研究显示,小泰勒虫抗原Tp2与Tat重组得到的融合蛋白Tat-Tp2,能增强CD8+T细胞反应的兴奋性[37];CPP Tat在明显促进T细胞对HSP gp96摄取的同时,还能轻微减少gp96自身相互聚集,从而增强gp96介导的乙肝病毒特异性T细胞免疫反应及其抗病毒功效[38]。此外,CPP Tat与Ag85B的连接产物也被用作针对结核分枝杆菌的疫苗[39]。
透皮免疫(transcutaneous immunization, TCI)是一种新型免疫给药方式,具有接种效率高、安全性高、耐受性好等优点。然而,角质层屏障、大分子疫苗在表皮组织内的扩散及靶向于树突状细胞(dendritic cells, DC),是TCI所面临的难题。笔者所在课题组将甘露糖基化低分子聚乙烯亚胺(PEI)共价连接CPP,并将其用作靶向高表达甘露糖受体的DC的DNA疫苗输送载体,通过微针免疫技术,成功地应用于黑色素瘤的TCI治疗。该项研究表明,PEI-CPP作为载体可显著提高基因疫苗复合物的免疫效果:针对Trp-2的细胞特异性免疫反应得以增强,并有效激活CD8+细胞毒T淋巴细胞,同时促进CD4+T细胞分泌γ干扰素和白细胞介素-12,且此TCI治疗成功抑制了肿瘤的生长,延长了荷瘤小鼠的存活时间[40]。
6 结语
CPP序列中富含精氨酸,例如最常用的Tat,其序列为GGGYGRKKRRQRRR。目前,针对CPP介导药物入胞的机制研究已有许多,一般认为CPP介导药物入胞的方式有多种,如与细胞表面分子结合后以内吞途径入胞,或通过静电作用直接跨膜入胞,或与细胞膜静电结合后诱导脂质分子形成瞬时通路入胞。这些机制有的是能量依赖型,有的是非能量依赖型。CPP介导蛋白/多肽类药物输送系统正在从基础研发向临床转化,现有多个基于CPP穿给药技术的大分子药物,如KAI-9803、XG-102、AZX100等,已进入临床试验。
然而,CPP强大的穿膜作用是一把双刃剑,既能帮助药物克服体内输送的生理屏障,同时亦带来了新的问题:由于它的穿透作用缺乏特异性,因此全身给药时会导致其所携药物的广泛分布,从而增加药物在正常脏器的暴露量,加大了潜在的毒副作用风险。所以,在保持CPP穿膜功能的同时,提高其对病理组织的靶向性,是影响CPP技术临床应用的关键问题,也是今后CPP技术临床应用研究的重要方向。
[1]Tufts Center for the Study of Drug Development.Biotech products in big pharma clinical pipelines have grown dramatically[R]//Tufts Center for the Study of Drug Development Impact Reports.Boston: Tufts Center for the Study of Drug Development, 2013.
[2]ülo Langel.Cell-Penetrating Peptides: Methods and Protocols[M].New York: Humana Press, 2011.
[3]Dietz G P, Bähr M.Delivery of bioactive molecules into the cell: the Trojan horse approach[J].Mol Cell Neurosci, 2004, 27(2): 85-131.
[4]Huang Y, Jiang Y, Wang H,et al.Curb challenges of the "Trojan Horse" approach: smart strategies in achieving effective yet safe cell-penetrating peptide-based drug delivery[J].Adv Drug Deliv Rev, 2013, 65(10): 1299-1315.
[5]Huang Y, Park Y S, Wang J,et al.ATTEMPTS system: a macromolecular prodrug strategy for cancer drug delivery[J].Curr Pharm Des, 2010, 16(21): 2369-2376.
[6]Ye J, Shin M C, Liang Q,et al.15 years of ATTEMPTS: a macromolecular drug delivery system based on the CPP-mediated intracellular drug delivery and antibody targeting[J].J Control Release, 2015, 205: 58-69.
[7]Shin M C, Zhang J, Min K A,et al.Combination of antibody targeting and PTD-mediated intracellular toxin delivery for colorectal cancer therapy[J].J Control Release, 2014, 194: 197-210.
[8]Hall W A.Immunotoxin treatment of brain tumors[J].Methods Mol Biol, 2001, 166: 139-154.
[9]Shin M C, Zhao J, Zhang J,et al.Recombinant TAT-gelonin fusion toxin: synthesis and characterization of heparin/protamine-regulated cell transduction[J].J Biomed Mater Res A, 2015, 103(1): 409-419.
[10]Shin M C, Zhang J, David A E,et al.Chemically and biologically synthesized CPP-modifed gelonin for enhanced anti-tumor activity[J].J Control Release, 2013, 172: 169-178.
[11]Park Y J, Chang L C, Liang J F,et al.Nontoxic membrane translocation peptide from protamine, low molecular weight protamine (LMWP), for enhanced intracellular protein delivery:in vitroandin vivostudy[J].FASEB J, 2005, 19(11) 1555-1557.
[12]Lien S, Lowman H B.Therapeutic anti-VEGF antibodies[J].Handb Exp Pharmacol, 2008, (181): 131-150.
[13]Pedersen M W, Jacobsen H J, Koefoed K,et al.Targeting three distinct HER2 domains with a recombinant antibody mixture overcomes trastuzumab resistance[J].Mol Cancer Ther, 2015, 14(3): 669-680
[14]Shin I, Edl J, Biswas S,et al.Proapoptotic activity of cell-permeable anti-Akt single-chain antibodies[J].Cancer Res, 2005, 65(7): 2815-2824.
[15]Jain M, Chauhan S C, Singh A P,et al.Penetratin improves tumor retention of single-chain antibodies: a novel step toward optimization of radioimmunotherapy of solid tumors[J].Cancer Res, 2005, 65(17): 7840-7846.
[16]Hu M, Chen P, Wang J,et al.Site-specific conjugation of HIV-1 tat peptides to IgG: a potential route to construct radioimmunoconjugates for targeting intracellular and nuclear epitopes in cancer[J].Eur J Nucl Med Mol Imaging, 2006, 33(3): 301-310.
[17]Hu M, Wang J, Chen P,et al.HIV-1 Tat peptide immunoconjugates differentially sensitize breast cancer cells to selected antiproliferative agents that induce the cyclin-dependent kinase inhibitor p21WAF-1/ CIP-1[J].Bioconjug Chem, 2006, 17(5): 1280-1287.
[18]Hu M, Chen P, Wang J,et al.123I-labeled HIV-1 tat peptide radioimmunoconjugates are imported into the nucleus of human breast cancer cells and functionally interactin vitroandin vivowith the cyclin-dependent kinase inhibitor, p21(WAF-1/Cip-1)[J].Eur J Nucl Med Mol Imaging, 2007, 34(3): 368-377.
[19]Cornelissen B, Kersemans V, McLarty K,et al.In vivomonitoring of intranuclear p27(kip1) protein expression in breast cancer cells during trastuzumab (Herceptin) therapy[J].Nucl Med Biol, 2009, 36(7): 811-819.
[20]Harada H, Hiraoka M, Kizaka-Kondoh S.Antitumor effect of TAT-oxygen-dependent degradation-caspase-3 fusion protein specifically stabilized and activated in hypoxic tumor cells[J].Cancer Res, 2002, 62(7): 2013-2018.
[21]Yu Z, Wu J, Wu S,et al.A recombinant cell-permeable p53 fusion protein is selectively stabilized under hypoxia and inhibits tumor cell growth[J].Cancer Lett, 2009, 279(1): 101-107.
[22]Lee J H, Lu H.Chimeric p53 as an alternative therapy for hypoxic tumors[J].Cancer Biol Ther, 2011, 11(1): 108-110.
[23]De Maio A.Extracellular heat shock proteins, cellular export vesicles, and the Stress Observation System: a form of communication during injury, infection, and cell damage.It is never known how far a contro-
versial finding will go! Dedicated to Ferruccio Ritossa[J].Cell Stress Chaperones, 2011, 16(3): 235-249.
[24]Rappa F, Farina F, Zummo G,et al.HSP-molecular chaperones in cancer biogenesis and tumor therapy: an overview[J].Anticancer Res, 2012, 32(12): 5139-5150.
[25]Calderwood S K, Stevenson M A, Murshid A.Heat shock proteins, autoimmunity, and cancer treatment[J].Autoimmune Dis, 2012, 2012: 486069.
[26]Khafagy el-S, Morishita M, Onuki Y,et al.Current challenges in noninvasive insulin delivery systems: a comparative review[J].Adv Drug Deliv Rev, 2007, 59(15): 1521-1546.
[27]Liang J F, Yang V C.Insulin-cell penetrating peptide hybrids with improved intestinal absorption efficiency[J].Biochem Biophys Res Commun, 2005, 335(3): 734-738.
[28]He H, Sheng J, David A E,et al.The use of low molecular weight protamine chemical chimera to enhance monomeric insulin intestinal absorption[J].Biomaterials, 2013, 34(31): 7733-7743.
[29]Cao G, Pei W, Ge H,et al.In vivodelivery of a Bcl-xL fusion protein containing the TAT protein transduction domain protects against ischemic brain injury and neuronal apoptosis[J].J Neurosci, 2002, 22(13): 5423-5431.
[30]Hirt L, Badaut J, Thevenet J,et al.D-JNKI1, a cell-penetrating c-Jun-N-terminal kinase inhibitor, protects against cell death in severe cerebral ischemia[J].Stroke, 2004, 35(7): 1738-1743.
[31]Fu A, Wang Y, Zhan L,et al.Targeted delivery of proteins into the central nervous system mediated by rabies virus glycoprotein-derived peptide[J].Pharm Res, 2012, 29(6): 1562-1569.
[32]Yan L, Wang H Y, Jiang Y F,et al.Cell-penetrating peptide-modifed PLGA nanoparticles for enhanced nose-to-brain macromolecular delivery[J].Macromol Res, 2013, 21: 435-441.
[33]Bisping E, Ikeda S, Kong S W,et al.Gata4 is required for maintenance of postnatal cardiac function and protection from pressure overloadinduced heart failure[J].Proc Natl Acad Sci USA, 2006, 103(39): 14471-14476.
[34]Bian J, Popovic Z B, Benejam C,et al.Effect of cell-based intercellular delivery of transcription factor GATA4 on ischemic cardiomyopathy[J].Circ Res, 2007, 100(11): 1626-1633.
[35]Jiang Y, Li M, Zhang Z,et al.Cell-penetrating peptides as delivery enhancers for vaccine[J].Curr Pharm Biotechnol, 2014, 15(3): 256-266.
[36]Justesen S, Buus S, Claesson M H,et al.Addition of TAT protein transduction domain and GrpE to human p53 provides soluble fusion proteins that can be transduced into dendritic cells and elicit p53-specifc T-cell responses in HLA-A*0201 transgenic mice[J].Immunology, 2007, 122(3): 326-334.
[37]Tinega A N, Pellé R, Kang'a S,et al.Fusion of a cell penetrating peptide from HIV-1 TAT to the Theileria parva antigen Tp2 enhances the stimulation of bovine CD8+T cell responses[J].Vet Immunol Immunopathol, 2009, 130(1/2): 107-113.
[38]Zhao B, Wang Y, Zhang Y,et al.TAT-mediated gp96 transduction to APCs enhances gp96-induced antiviral and antitumor T cell responses[J].Vaccine, 2013, 31(3): 545-552.
[39]张荣波, 王文洋, 胡东, 等.TAT-Ag85B蛋白疫苗的制备和抗结核分枝杆菌效果评价[J], 细胞与分子免疫学杂志, 2015, 31(1): 49-53.
[40]Hu Y, Xu B, Xu J,et al.Microneedle-assisted dendritic cell-targeted nanoparticles for transcutaneous DNA immunization[J].Polym Chem, 2015, 6(3): 373-379.

[专家介绍] 黄永焯:研究员,博士生导师。1999年和2002年在广州中医药大学分别获学士和硕士,2005年于浙江大学获博士学位,2005-2010年在美国密歇根大学药学院进行博士后研究。2010年入选中国科学院百人计划,同年7月进入中国科学院上海药物研究所工作,任研究员,课题组长。2011年入选上海市浦江人才计划,2013年获中国药学会-赛诺菲青年生物药物奖,2014年获国家自然科学基金优秀青年基金。现任上海市药剂专业委员会委员、世中联中药药理专业委员会委员,并担任Heliyon、中国现代应用药学、中药新药与临床药理杂志等刊物的编委。近5年在Angew Chem Int Ed、Adv Mater、Adv Func Mater、Adv Drug Deliv Rev、J Control Release、Biomaterials、Theranostics、J Mater Chem、Polym Chem等杂志发表SCI论文40篇。研究方向包括:1)经皮新剂型与新技术;2)生物技术药物输送系统研究;3)新型药物给药技术克服多药耐药肿瘤。
Recent Developments in Cell-penetrating Peptidemediated Protein/Peptide Drug Delivery
ZHANG Yajie1,2, CHEN Yingzhi1, YANG Victor C.2,3, HUANG Yongzhuo1
(1.Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China; 2.Tianjin Key Laboratory on Technologies Enabling Development of Clinical Therapeutics and Diagnosis, School of Pharmacy, Tianjin Medical University, Tianjin 300070, China; 3.College of Pharmacy, University of Michigan, Ann Arbor 48109, USA)
Protein/peptide drugs have received great attention and recognition, and taken a growing share in drug development.However, intracellular delivery has become an essential issue for many protein/peptide drugs that need to enter the cells for achieving pharmacological actions.Cell-penetrating peptides (CPPs) are rich in arginine, which enables them not only to penetrate cell membrane effciently, but also to carry a variety of macromolecules into cells.Therefore, CPPs have been widely applied in drug delivery, and especially, CPP-based technique is considered as the promising solution to overcome the barriers against effective intracellular protein delivery.This article provided emphatically an overview on recent development in CPP-mediated protein/peptide drug delivery for treatment of various diseases.
cell-penetrating peptide; protein; peptide; intracellular delivery
R943
A
1001-5094(2015)04-0270-07
接受日期:2015-02-17
项目资助:国家自然科学基金(No.81373357, 81422048, 81172996, 81361140344)
*通讯作者:黄永焯,研究员,博士生导师;
研究方向:经皮新剂型与新技术,生物技术药物输送系统研究,新型药物给药技术克服多药耐药肿瘤;
Tel:021-20231000-1401;E-mail:yzhuang@mail.shcnc.ac.cn
