2014年中国药品审评年度报告
2015-02-10国家食品药品监督管理总局药品审评中心
国家食品药品监督管理总局药品审评中心
·医药行业报告·
REPORT IN PHARMACEUTICAL FIELD
2014年中国药品审评年度报告
国家食品药品监督管理总局药品审评中心
编者按:据汤森路透集团近期在英国的附属公司科学创新监管中心(CIRS)发表的“R&D Briefing 55”报告分析显示,目前全球监管环境已有很大改进,审评机构批准新药所需时间有所缩短。社会对新药寻求更快可及、监管机构希望改善流程和制药企业寻求更及时、优质的审评的要求更高。为畅通信息渠道,推动医药产业发展,本期“医药行业报告”栏目经国家食品药品监督管理总局药品审评中心授权,转载《2014年中国药品审评年度报告》,并邀请江苏省食品药品监督管理局注册处王宗敏处长和中国药科大学医药产业发展研究中心褚淑贞教授分别撰写关于江苏省药品注册管理和医药产业的年度报告。

2014年,国家食品药品监督管理总局药品审评中心(以下简称药审中心)在国家食品药品监督管理总局的领导下,继续秉持质量、公平、效率的原则,围绕完善国家药品审评管理体系建设推进改革,坚持依法依规、科学规范审评,不断提高审评质量和效率,维护和促进公众健康。根据国家食品药品监督管理总局有关工作要求,现将《2014年中国药品审评年度报告》呈现给公众。
1 2014年药品审评基本情况
1.1 机构基本情况
药审中心是国家食品药品监督管理总局药品注册技术审评机构,负责对药品注册申请进行技术审评。药审中心下设13个职能部门,其中9个为技术审评部门;全中心在编115人,技术审评岗位人员89人。技术审评岗位人员正高职称48人,副高职称31人,平均年龄45岁;高级审评员68人,其中具有主审审评员资格人员65人,平均审评工作年限14年。截至2014年底,药审中心待审评任务总量达到18 597个,同比2013年底,待审评任务总量增加了4 362个。
1.2 审评任务接收情况
2014年,药审中心接收新的注册申请8 868个(以受理号计,下同)。与既往年度接收注册申请的比较情况见图1。

图1 2014年审评任务接收情况与前3年比较
2014年化药审评任务接收量增加明显,较2011—2013年年均化药审评任务接收量增幅近30%,占年度审评任务接收总量近90%;中药和生物制品审评任务的接收量均有所下降。
1.2.1 化药审评任务接收情况
(1)化药审评任务分类情况 化药审评任务接收分类情况如图2。其中验证性临床申请、仿制及改剂型申请(ANDA)和补充申请,三者占化药审评任务接收量的87.8%。

图2 2014年接收化药审评任务分类情况
与前3年比较,新药临床申请(IND)和新药上市申请(NDA)接收量相对平稳,验证性临床、ANDA和进口再注册接收量则增加明显。具体见图3。

图3 2014年化药各类审评任务接收情况与前3年比较
(2)化药IND各治疗领域接收情况 2014年接收化药IND申请的治疗领域构成情况见图4。
国产IND接收量前5的治疗领域分别为:抗肿瘤药物、抗感染药物、消化系统疾病药物、循环系统疾病药物、内分泌系统药物。
国际多中心临床接收量前5的治疗领域分别为:抗肿瘤药物、循环系统疾病药物、神经系统疾病药物、消化系统疾病药物、内分泌系统药物。

图4 2014年接收化药IND申请的治疗领域构成
(3)化药重复申报情况 化药ANDA申请和验证性临床申请存在大量重复申报情况。截至2014年底,待审的化药ANDA申请共8 713个,占待审任务总量的46.9%,涉及活性成分1 061个。重复申报较为严重的有112个活性成分(相同活性成分品种待审任务20个以上),涉及待审任务4 829个,占化药ANDA总待审任务量的55.4%。其中相同活性成分品种待审任务超过100个的活性成分有:埃索美拉唑、阿托伐他汀钙、硫酸氢氯吡格雷、恩替卡韦、法舒地尔、头孢地尼、氨溴索、莫西沙星。具体见表1。
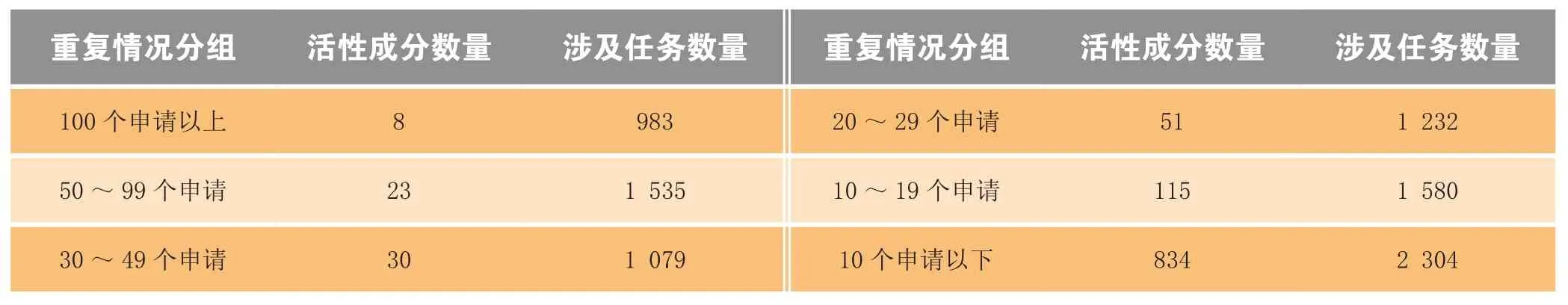
表1 化药仿制药重复申报情况
截至2014年底,待审的化药验证性临床申请共3 983个,占待审任务总量的21.4%,涉及活性成分675个。重复申报较为严重的有42个活性成分(相同活性成分品种待审任务20个以上),涉及待审任务1 608个,占化药验证性临床待审任务总量的40.4%。其中相同活性成分品种待审任务超过50个的活性成分有:阿齐沙坦、罗氟司特、布洛芬(注射剂)、鲁拉西酮。具体见表2。
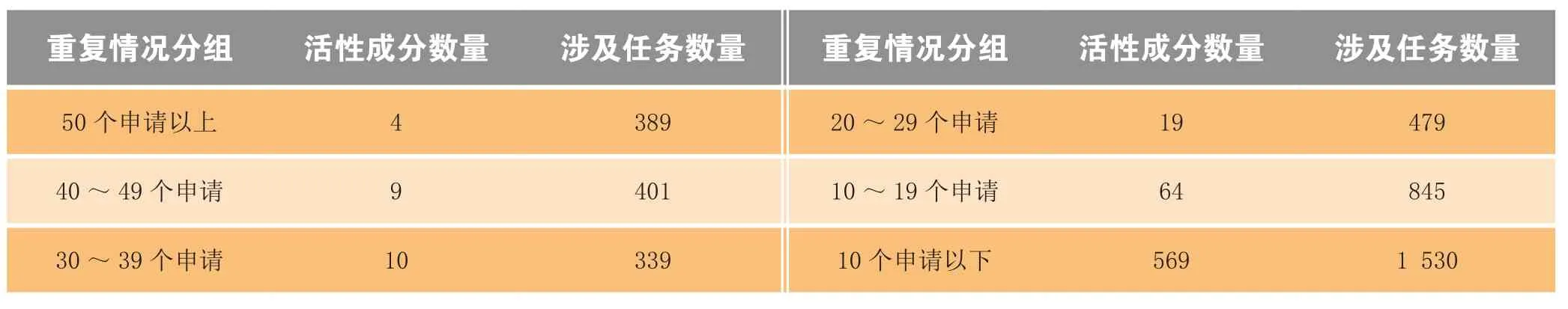
表2 化药验证性临床重复申报情况
1.2.2 中药审评任务接收情况2014年共接收中药注册申请521个,其中69.3%为补充申请。具体见图5。
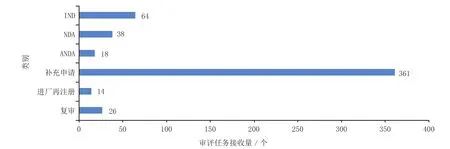
图5 2014年接收中药审评任务分类情况
与前3年比较,IND和NDA接收量相对平稳,ANDA和补充申请接收量有所下降。具体见图6。

图6 2014年中药各类审评任务接收情况与前3年比较
1.2.3 生物制品接收情况2014年共接收生物制品注册申请458个,其中补充申请占49.1%,治疗用生物制品IND占32.5%。具体见图7。

图7 2014年接收生物制品审评任务分类情况
与2013年相比,2014年生物制品除治疗用NDA外,其他各类审评任务接收量均有所下降。具体见图8。
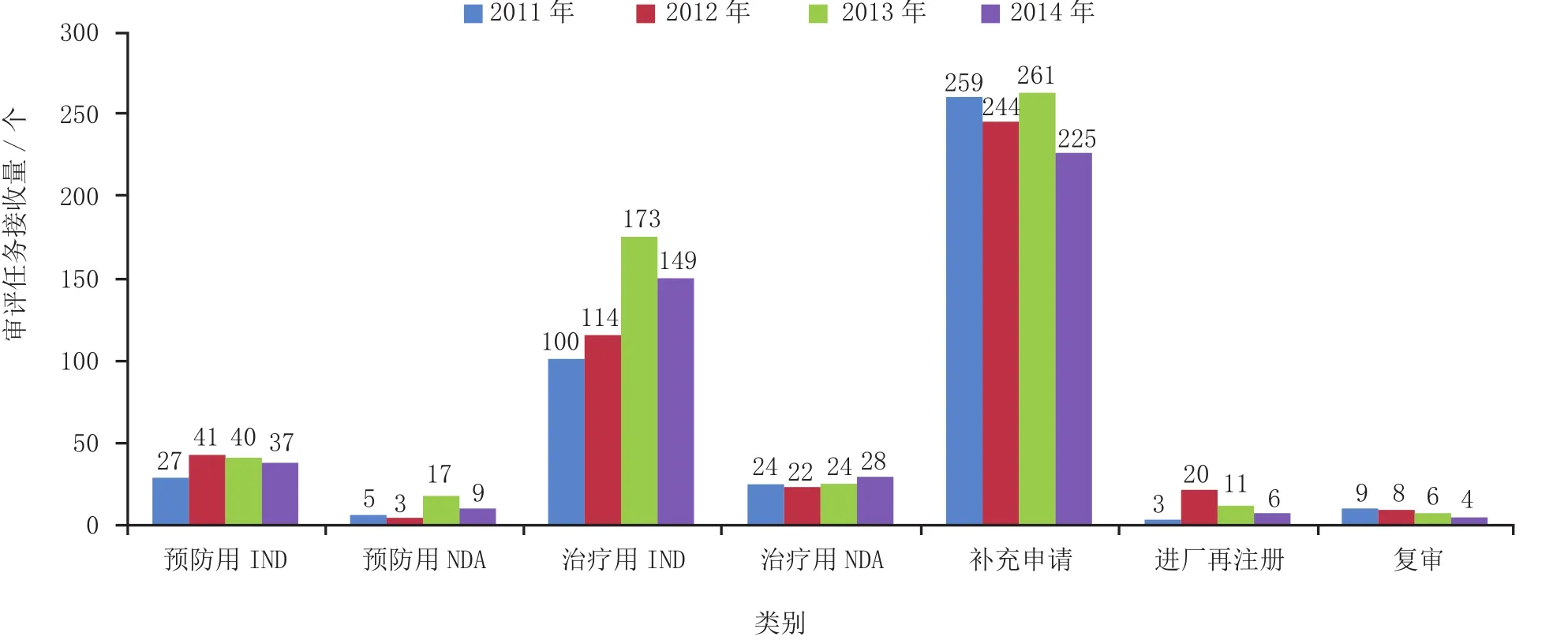
图8 2014年生物制品各类审评任务接收情况与前3年比较
1.3 审评任务完成情况
2014年,药审中心共完成5 261个注册申请的技术审评,比2013年的审评完成量增加了12.9%,但接收任务量较2013年增加了16.5%,待审任务积压量进一步增加。2014年接收、完成审评、待审任务情况与前3年比较见图9。

图9 2014年接收、完成审评、待审任务与前3年比较
2014年,药审中心完成审评建议国家总局批准上市和批准临床研究的情况见表3、表4。

表3 2014年完成审评建议批准上市药品情况
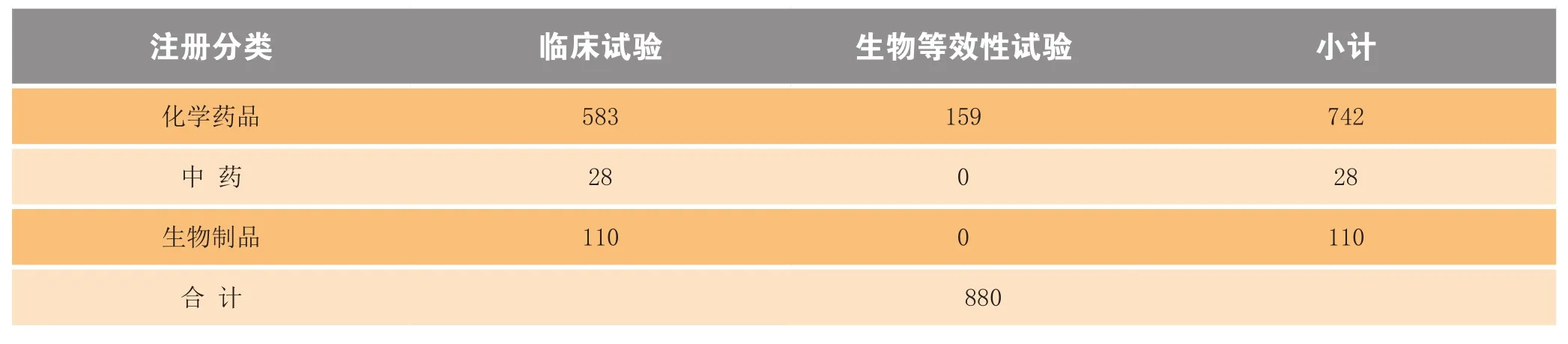
表4 2014年完成审评建议批准临床研究药物情况
1.3.1 化药审评完成情况2014年化药完成审评并呈送总局审批的注册申请共4 091个,另有完成审评通知现场检查的注册申请156个,完成审评通知企业补充资料的注册申请625个。具体情况见表5。
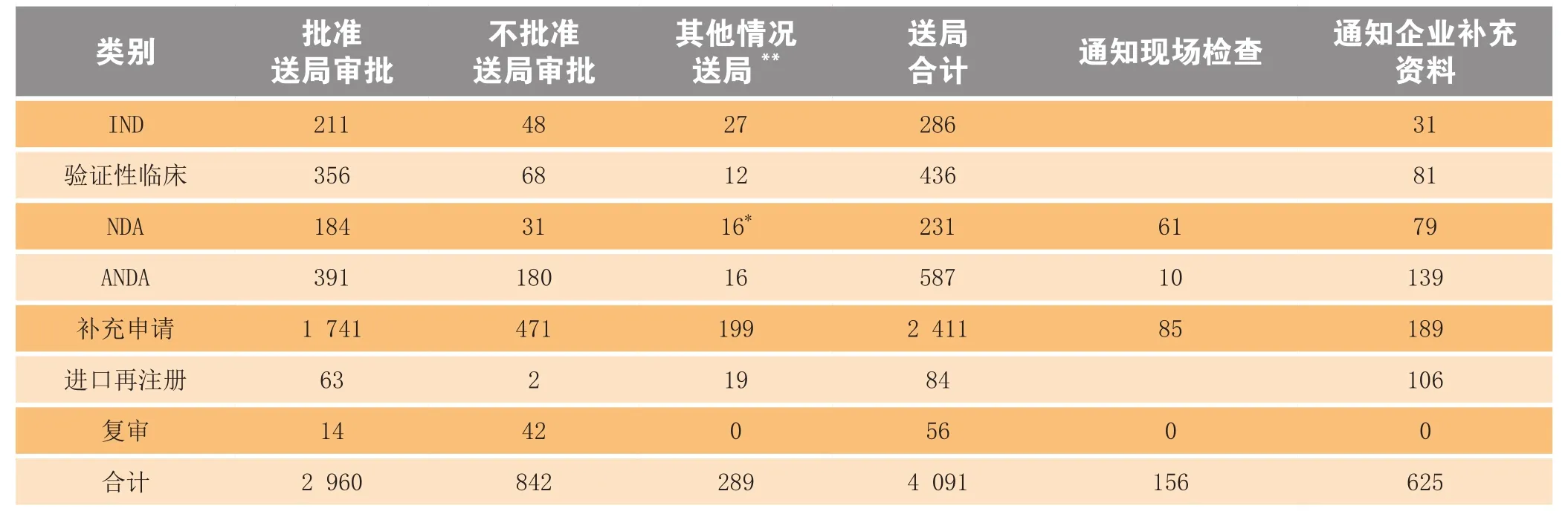
表5 2014年化药审评完成情况
有明确审评结论的注册申请中,建议批准的2 960个,建议不批准的842个,总体不批准率为22.1%。与2013年比较,2014年化药除复审外各类别完成审评送局量均有所增加。2014年化药各类别完成审评送局量与前3年比较情况见图10。
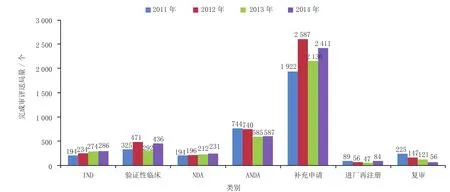
图10 2014年化药各类别完成审评送局量与前3年比较
1.3.2 中药审评完成情况2014年中药完成审评并呈送总局审批的注册申请共647个,另有完成审评已通知现场检查的注册申请8个,完成审评通知企业补充资料的注册申请100个。具体情况见表6。

表6 2014年中药审评完成情况
有明确审评结论的注册申请中,建议批准的200个,建议不批准的300个,总体不批准率为60%。 2014年中药各类别完成审评送局量与前3年比较情况见图11。

图11 2014年中药各类别完成审评送局量与前3年比较
1.3.3 生物制品审评完成情况2014年完成生物制品审评并呈送总局审批的注册申请共523个,另有完成审评已通知现场检查的注册申请22个,完成审评通知企业补充资料的注册申请58个。具体情况见表7。

表7 2014年生物制品审评完成情况

续表7
有明确审评结论的注册申请中,批准结论338个,不批准结论111个,总体不批准率为24.7%。2014年生物制品各类别完成审评送局量与前3年比较情况见图12。
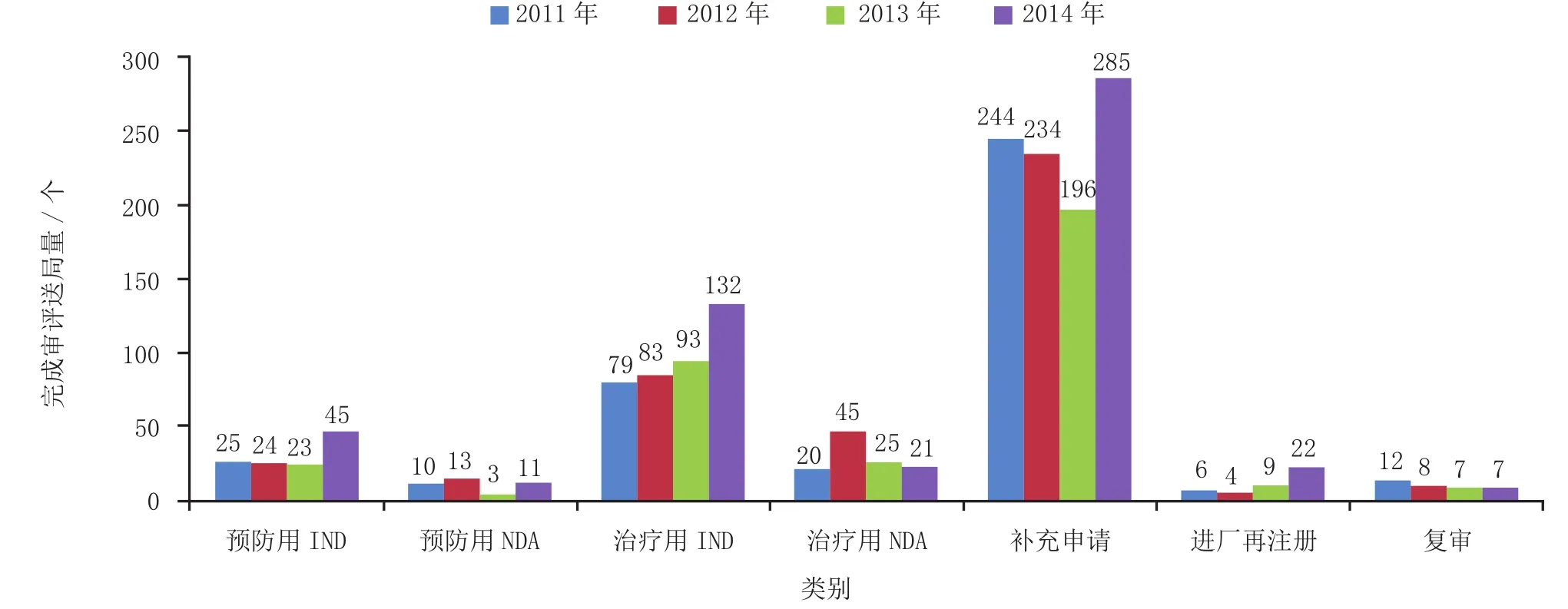
图12 2014年生物制品各类别完成审评送局量与前3年比较
2 2014年主要工作措施及进展
2.1 推进药品审评机制改革,提升审评质量和效率
2.1.1 做好改革方案制定和改革基础工作按照统一部署,积极做好药品审评审批制度综合改革方案的起草制定工作。作为药品审评制度改革的主体单位,完成了《技术审评管理机制改革》、《加强技术审评能力建设》等8个子方案的起草工作。围绕当前审评工作最突出的审评任务积压矛盾,研究制定了消除审评任务积压3年工作方案。为推进药品审评审批制度改革,引导社会投资和医药产业结构优化升级,对已批准上市的品种和待审评的品种进行了整理对比,并对重复申报的药品注册申请进行梳理,提供给总局发布《过度重复药品品种目录》;做好审评事权下放的技术支撑工作,完成了对29名地方审评人员的培训工作。
2.1.2 完善鼓励药物创新工作机制加快创新药物临床试验申请的审评;改革新药临床试验申请审评方式,由原有的以分期批准临床试验为主逐渐过渡为一次性批准临床试验为主;加强过程风险管控;改进了创新药药理毒理评价的审评模板;进一步完善了创新药临床开发期间以年度报告方式递交药学研究资料的工作机制;积极探索中药创新研发评价的思路和策略。研究建立了“重大新药创制”重大专项品种的加快审评机制。
2.1.3 完成化药仿制药“立卷审查”试点工作通过试点工作的探索实践,制定了化药仿制药立卷审查标准,评估了立卷审查工作所需的人力资源和时间成本,探索了如何从受理源头保证申报资料质量,为后续实施药品注册受理机制改革奠定了基础。同时,通过试点工作探索了利用立卷审查标准作为快速审评化药仿制药的标准,为解决化药仿制药审评任务积压矛盾提供了实践参考。
2.1.4 优化审评任务管理探索审评计划周期长短结合的任务管理模式,提高了审评任务管理的目标性和可预期性。强化各层级专业团队管理,提高审评工作的协调性。加大上市后补充申请审评资源的投入,保证已上市品种质量改进的及时性,保障公众用药。
2.1.5 探索专家网络审评及咨询工作机制通过调研分析,制定了详细工作方案,探索构建专家网络函审和咨询系统,通过网络和信息技术提高专家咨询和参与审评的便捷性,以更加高效地利用专家审评资源。
2.2 清理历史遗留问题,推进解决各种矛盾
对历史遗留品种和疑难品种进行全面梳理,开展
了复方高血压药物、复方抗生素、抗生素祛痰药复方、专利问题品种、涉及《药品注册管理办法》第72条品种、资料雷同复审品种,以及莫西沙星、达托霉素、拉布立海等疑难品种的审评专题工作,通过和有关部门进行沟通协调,分析研究审评处理原则,积极推进审评工作。
2.3 加强制度规范建设,完善技术标准体系
梳理整合药审中心已有的200多个规章制度,制定了《药审中心制度建设3年工作规划》和《药审中心制度建设2015—2017年工作实施方案》,有序推进中心规章制度“立、改、废”。继续推动技术指导原则的制定和修订工作,2014年经总局审核发布12项,5项完成上网征求意见。围绕国际生物类似药研究进展,组织药审中心各专业人员及社会有关行业机构起草制定了《生物类似药研究技术指导原则》。为推进中药研发的进一步规范化和科学化,起草完成了《中药新药治疗恶性肿瘤临床研究技术指导原则》征求意见稿,已上网征求意见。启动了《化药新药临床试验一般指导原则》的撰写工作,并已完成初稿。
2.4 积极推进用人机制改革,全面加强人才队伍建设
拓宽渠道增加审评力量,全年新招聘事业编审评人员10人,完成了首批聘用制审评员招聘试点工作。从相关技术单位和省局借调技术人员37人,协助开展审评工作。积极探索购买服务,与北京药学会等单位合作抽调专家协助开展立卷审查试点工作,与法律专业机构合作组成律师团队。充分利用社会资源,推动药品审评社会共治体系建设,与北京大学第一医院、中国药科大学、沈阳药科大学签署合作框架协议,增强审评工作的开放性,促进审评人才队伍建设。
2.5 继续完善审评质量保障体系,保证审评质量
2.5.1 继续实施并完善专家咨询会制度专家咨询会制度是审评质量保障体系的重要组成部分。2014年,药审中心在完善咨询专家库、改进专家聘请模式、强化专家会纪律、完善专家咨询会操作规程等方面取得了长足进步。全年共集中召开专家咨询会议11次,其他单独品种或指导原则等专题咨询会43次,共涉及177个品种,邀请专家1736人次。
2.5.2 做好世卫组织NRA再评估工作2014年4月,世卫组织对我国疫苗国家监管体系(简称NRA)进行再次评估,与首次评估相比,再评估标准提高,评估内容更完整。根据世卫组织NRA评估工作要求和总局NRA工作整体部署,落实好组织筹备工作。在世卫组织专家检查期间,做好上市许可(MA)板块的各项现场迎检工作,并获得高分评估,为我国顺利通过NRA再评估提供了有力支撑。
2.5.3 推进审评质量体系建设及ISO9001认证工作2014年药审中心疫苗审评质量管理体系再次顺利通过监督审核,获得确认证书。同时,根据药品审评审批制度改革要求,将审评质量管理工作从疫苗体系,扩大到覆盖中药、化药和生物制品的全中心质量管理体系,进一步明确了药品审评质量管理目标,制定了《药审中心建立药品审评质量管理体系工作实施方案》,积极采用购买服务方式,借助外部专业机构,构建药审中心审评质量管理体系。
2.5.4 进一步加强信息化建设完成了符合信息化发展规律的技术审评系统升级工作,为实现审评人员数量扩增以及多地点、多种途径开展审评工作提供了有效的信息化支持,提高了信息技术对审评工作质量的保障水平;推进信息标准化体系建设,利用数字化手段促进审评标准的科学性和审评尺度的一致性,提高审评质量和效率;做好信息系统安全等级保护工作,通过公安部测评,符合国家信息安全等级保护第3级要求,提高了中心网络及系统的安全防护水平。
3 2014年批准重要治疗领域药品情况
2014年,经过药审中心的审评,提出建议批准以下多个重要治疗领域的药品上市,为患者获得最新治疗手段提供了可能性,也为患者用药可及性提供了重要保障。
3.1 抗肿瘤用药
3.1.1 甲磺酸阿帕替尼片我国自主研发的首个血管内皮细胞生长因子受体(VEGFR)抑制剂,也是全球首个批准用于治疗晚期胃癌的小分子靶向产品。胃癌是我国高发肿瘤,晚期胃癌二线化疗失败后目前尚无公认的有效治疗选择,存在迫切临床需求。该产品的上市,对胃癌患者的治疗提供了新的用药选择。
3.1.2 西达本胺片我国自主研发的首个组蛋白去乙酰化酶抑制剂,也是国内首个批准用于治疗复发难治的外周T 细胞淋巴瘤的药物。复发难治的外周T 细胞淋巴瘤缺乏有效治疗,预后差,该产品上市对复发难治外周T细胞淋巴瘤治疗提供了新的治疗机会。
3.1.3 多西他赛注射液紫杉醇类化疗药,微管解聚抑制剂,已在我国批准用于乳腺癌、非小细胞肺癌,以及非激素依赖的前列腺癌的患者。现国内批准增加晚期胃癌
的新适应证,为胃癌患者的治疗提供了新的用药选择。
3.1.4 盐酸帕洛诺司琼注射液5-羟色胺3(5-HT3)受体的竞争性拮抗剂,已在我国批准用于预防肿瘤患者因化疗引起的恶心和呕吐。现国内批准增加用于预防术后24小时恶心呕吐的新适应症,为外科手术患者提供了预防术后恶心呕吐的新治疗手段。
3.2 疫苗领域
我国自主研发的全球首个Sabin株脊髓灰质炎灭活疫苗(单苗),填补了我国在脊髓灰质炎灭活疫苗生产领域的空白,消除了目前计划免疫规划中数千万剂使用的口服脊髓灰质炎减毒活疫苗潜在的致病危险(疫苗株或衍生株引发的相关病例),安全性更好。药审中心按特殊审批程序完成了该疫苗上市注册申请的审评,有效配合了WHO全球根除脊髓灰质炎病毒的行动计划。同时,该疫苗的批准上市,对我国乃至全球,特别是发展中国家消灭脊髓灰质炎都会产生积极的影响。
3.3 内分泌系统用药
盐酸西那卡塞片被批准用于治疗慢性肾脏病维持性透析患者的继发性甲状旁腺功能亢进症。目前我国仅批准了帕立骨化醇注射液用于治疗接受血液透析的慢性肾功能衰竭患者的继发性甲状旁腺功能亢进,给药途径为静脉注射。本品是我国批准用于治疗该疾病的首个口服药物,为此类患者提供了一个新的治疗手段。
3.4 眼科用药
曲伏噻吗滴眼液被批准用于降低成人开角型青光眼或高眼压症患者升高的眼压,适用于β受体阻滞剂或前列腺素类似物局部治疗效果不佳者。本品较现有治疗有更优的治疗后24小时药物谷底降眼压效应,并可减少眼部充血不良事件的发生,有效拓展了该疾病领域的用药选择空间。
3.5 消化系统用药
新的中药复方制剂复方苦参结肠溶胶囊,被批准用于治疗轻、中度溃疡性结肠炎(活动期),中医辨证属于湿热内蕴者。溃疡性结肠炎是传统中医药治疗的优势病种。本品即继承了传统中医药理论,又通过现代制药技术将释药部位定位在结肠,其批准上市为溃疡性结肠炎患者提供了新的治疗手段。
3.6 心血管系统用药
国产替奈普酶(TNK-tPA)制剂注射用重组人组织型纤溶酶原激活剂TNK突变体(rhTNK-tPA),为天然tPA的改构体,属于第3代纤维蛋白特异性溶栓剂,被批准用于急性心肌梗死症状发作6小时内,伴持续ST段抬高或新近出现左束支传导阻滞的心肌梗死患者的溶栓治疗。与先前已经在国内外上市的alteplase(阿替普酶,rt-PA)相比,具有对新产生的血凝块溶解作用更强、对纤溶酶原活化剂抑制因子Ⅰ(PAI-I)有抵抗力、更高的纤溶特异性、更长的半衰期、给药方式更加简单、单次弹丸式静脉注射给药即可完成溶栓治疗、方便院外溶栓、缩短心肌再灌注的时间等优点。同品种已经在美国和欧盟获得上市,国产品种的批准上市显著提高了我国患者的用药可及性。
3.7 生殖系统用药
国产西地那非片为治疗阴茎勃起功能障碍(ED)的主流药物,由于专利保护致使市场垄断,长期以来进口原研品种在国内销售价格昂贵。2014年在原研厂家的西地那非片专利到期之际,审评批准了国产西地那非片的生产上市许可,将有效提升国内ED患者的用药选择空间。
3.8 麻醉与镇痛用药
盐酸右美托咪定注射液是一种选择性α2肾上腺素能受体激动剂,已在我国批准用于行全身麻醉的手术患者气管插管和机械通气时的镇静。现国内批准增加用于重症监护期间开始插管和使用呼吸机病人的镇静的新适应证,为国内重症监护病人的镇静提供了新的用药选择。
3.9 抗风湿用药
新的藏药复方制剂然降多吉胶囊,被批准用于治疗藏医真布(类风湿关节炎),藏医辨证为湿痹寒湿阻络证,症见关节疼痛、关节肿胀、晨僵。西藏属于类风湿类疾病高发的高寒地区,传统藏医药对类风湿性关节炎(藏医称真布)积累了丰富的经验,类风湿性关节炎是藏医药治疗的优势病种。本品是根据知名藏医药专家经验方研制的现代藏药新药,其批准上市为类风湿性关节炎的治疗提供了新的治疗选择。
4 结语
在党的十八届三中、四中全会精神指引下,在国家食品药品监督管理总局的坚强领导下,药审中心将继续深化推进改革,认真履行职责,积极做好药品技术审评工作,切实维护和促进公众健康。
2014 Annual Report on Drug Evaluation in China
Center for Drug Evaluation of China Food and Drug Administration
R95
A
1001-5094(2015)04-0241-10
