非酒精性脂肪性肝病患者血清TNF-α、IL-6水平与胰岛素抵抗相关性研究
2015-02-09范小芬邓银泉吴国琳
范小芬,邓银泉,吴国琳
(浙江大学医学院附属第一医院,浙江 杭州 310003)
非酒精性脂肪性肝病患者血清TNF-α、IL-6水平与胰岛素抵抗相关性研究
范小芬,邓银泉,吴国琳
(浙江大学医学院附属第一医院,浙江 杭州 310003)
目的检测非酒精性脂肪性肝病(NAFLD)患者血清肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)表达水平,并探讨其与胰岛素抵抗的相关性。方法测定106例 NAFLD患者血清TNF-α、IL-6、空腹血糖(FBG)、空腹胰岛素(FINS)水平,采用稳态模式评估胰岛素抵抗指数(HOMA-IR),根据患者身高、体质量结果计算体质量指数(BMI),并以同期不嗜酒的30名健康人为对照组进行比较。结果NAFLD组患者血清TNF-α、IL-6、FBG、FINS 水平及 BMI、HOMA-IR均明显高于健康对照组(P均<0.01)。NAFLD组患者血清TNF-α、IL-6 水平与BMI、FINS 及HOMA-IR 呈正相关性(P均<0.01)。结论NAFLD 患者存在炎症反应,血清 TNF-α、IL-6 水平升高与肥胖及以高胰岛素血症为主的胰岛素抵抗密切相关。
非酒精性脂肪性肝病;肿瘤坏死因子-α;白细胞介素-6;胰岛素抵抗
近年来,低度系统性炎症反应在非酒精性脂肪性肝病(NAFLD)、肥胖、2型糖尿病等代谢疾病中备受重视,越来越多的研究表明某些炎性因子如肿瘤坏死因子-α(TNF-α)、白细胞介素-6 (IL-6) 、C反应蛋白参与了胰岛素抵抗所致的NAFLD发病、发展过程,在NAFLD患者中高度表达[1-3]。本研究旨在观察NAFLD患者血清TNF-α、IL-6水平情况,并探讨其与胰岛素抵抗的相关性,为NAFLD防治提供参考。
1 临床资料
1.1一般资料 选取2010年3月—2013年2月我院脂肪肝专科门诊及普通门诊收治的NAFLD患者106例作为NAFLD组,均符合《非酒精性脂肪性肝病诊疗指南》诊断标准[4]且知情同意参加研究,其中男56例,女50例;年龄28~69(56.9±8.74)岁。排除年龄<18岁及>70岁者,妊娠或哺乳期妇女及精神病患者,酒精性肝病、病毒性肝炎、自身免疫性肝病、药物等所致的脂肪肝,合并糖尿病、冠心病、肿瘤、感染性疾病者。对照组30例为同期不嗜酒的健康者,男16例,女14例;年龄30~66(55.5±8.6)岁。2组年龄、性别比较差异无统计学意义(P均>0.05),具有可比性。
1.2方法 所有研究对象均空腹测体质量、身高并行静脉抽血。采用酶联免疫(ELISA)法测定血清TNF-α、IL-6水平,试剂盒由深圳晶美生物工程公司提供;采用葡萄糖氧化酶法测定空腹血糖(FBG);采用放射免疫法测定空腹胰岛素(FINS)。根据身高、体质量计算体质量指数(BMI),BMI=体质量(kg)/身高(m)2,采用稳态模式评估法评估胰岛素抵抗指数(HOMA-IR),HOMA-IR=FBG×FINS/22.5。

2 结 果
2.12组血清TNF-α、IL-6、FBG、FINS、HOMA-IR水平及BMI比较NAFLD组患者血清TNF-α、IL-6、FBG、FINS、HOMA-IR水平及BMI均明显高于对照组(P均<0.05)。见表1。
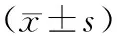
表1 2组血清TNF-α、IL-6、BMI、FBG、FINS、HOMA-IR水平比较
2.2NAFLD组患者血清TNF-α、IL-6水平与BMI、FBG、FINS、HOMA-IR的相关性Pearson相关分析显示,NAFLD组患者血清TNF-α、IL-6水平与FINS、HOMA-IR、BMI呈正相关(P<0.05)。见表2。
3 讨 论
随着生活水平的提高和饮食结构的改变,非酒精性脂肪性肝病已成为我国常见的慢性肝病之一,严重危害了人民健康。脂肪肝的防治涉及多个学科,不仅是临床医学问题,还是预防医学、社会医学和卫生行政部门共同面临的重大课题[5]。
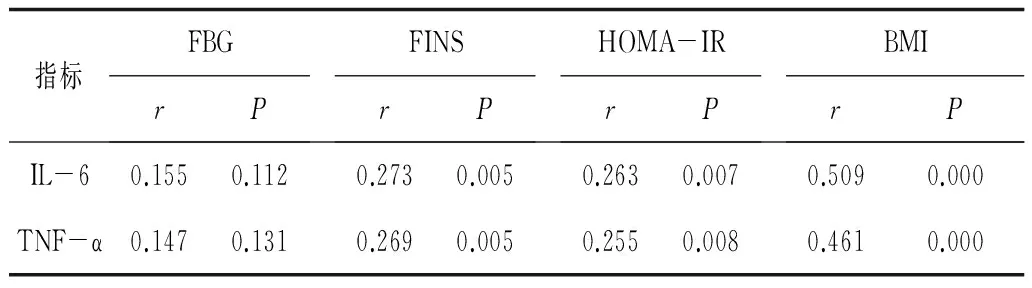
表2 NAFLD组患者血清TNF-α、IL-6水平与BMI、FBG、FINS、HOMA-IR的相关性
NAFLD的发病机制比较复杂,这是一个多因素引起肝脏脂肪沉积、氧化应激、线粒体功能受损和肝细胞慢性低度炎症反应导致的肝细胞损伤、坏死、纤维化的病理生理过程。现在国内广泛接受的是“二次打击”学说,初次打击主要是胰岛素抵抗引起的肝脏脂肪病变,二次打击主要是反应性氧化代谢产物增多,使脂肪变性的肝细胞发生持续低度炎性反应。而胰岛素抵抗贯穿于脂肪肝“二次打击”的始终,多种炎性细胞因子如TNF-α、IL-6、C反应蛋白可通过多种途径引起胰岛素抵抗,促进、加速NAFLD的发生发展。
TNF-α、IL-6是一类作用广泛的促炎症细胞因子,主要来源于巨噬细胞、脂肪细胞或内皮细胞,是机体炎性反应和免疫应答反应的主要调节因子。正常情况下,健康人血液中含有生理水平的TNF-α、IL-6,具有抗感染和增强免疫功能的作用;当机体持续释放过多或与其他细胞因子关系失调时,则损伤组织、加剧机体免疫功能紊乱。越来越多的研究表明NAFLD发生时血清TNF-α、IL-6表达增加,提示NAFLD患者可能由于肥胖、脂肪堆积而致TNF-α、IL-6分泌增加并通过多种途径参与胰岛素抵抗,在NAFLD的发病、发展中起着重要作用。分析其机制是:①TNF-α、IL-6可能通过抑制胰岛素受体和胰岛素受体底物-1(IRS-1)的酪氨酸残基磷酸化,从而抑制磷脂酰肌醇3激酶(PI3K)活性而损害胰岛素信号通路,诱导胰岛素抵抗[6-7]。②TNF-α和IL-6通过下调或抑制脂肪细胞中葡萄糖转运因子4(GLUT-4) 、IRS-1的表达,从而抑制胰岛素刺激的葡萄糖转运、影响胰岛素信号的转导,诱发胰岛素抵抗[8-9]。③TNF-α、IL-6可促进脂肪细胞的分解,增加脂肪氧化,使体内游离脂肪酸升高,通过游离脂肪酸抑制葡萄糖代谢的氧化与非氧化途径,使胰岛素的生物学效应减低,产生胰岛素抵抗。④细胞因子信号转导抑制因子家族(SOCS)通过抑制胰岛素受体和IRS-1酪氨酸磷酸化从而抑制胰岛素的信号转导,TNF-α、IL-6能诱导SOCS-3的表达,抑制胰岛素信号转导,参与胰岛素抵抗的形成[7]。此外,细胞因子之间还存在着具有相互作用的复杂调节网络系统,TNF-α、IL-6分泌过多可能导致改变的细胞因子表达谱间接作用于胰岛素信号途径,从而诱发胰岛素抵抗。因此,TNF-α和IL-6可能是通过多种途径引起胰岛素抵抗,参与NAFLD的发生发展,而胰岛素抵抗的发生又降低了胰岛素潜在的抗炎作用,又进一步促进了炎性因子的表达及炎症的发展,二者交叉作用,互相影响。
本研究发现NAFLD组血清TNF-α、IL-6的表达水平明显较对照组显著增高,且NAFLD组血清TNF-α、IL-6水平与BMI、FINS、HOMA-IR呈正相关,提示脂肪肝患者存在的慢性低度炎症反应,炎症反应程度与肥胖和以高胰岛素血症为主的胰岛素抵抗有密切关系,它们彼此间相互作用加重胰岛素抵抗及炎症反应。因此,NAFLD的发生是多因素、多途径的一个过程,深入研究炎性细胞因子的生理作用及其机制,对NAFLD及其相关疾病的防治具有重要意义。
[1] 谢伶俐,周力,李丽滨,等.TNF-α和IL-6在非酒精性脂肪性肝病患者血清中的水平及意义[J]. 世界华人消化杂志,2010,18(14):1492-1496
[2] 施军平,郑亚琴,娄国强. 脂肪肝胰岛素抵抗与IL-6、IL-8及TNF-α相关性研究[J]. 医学研究通讯,2005,34(10):18-20
[3] 赵燕萍,刘军. 非酒精性肝脏疾病IL-6、IL-10测定及其临床意义[J]. 临床消化病杂志,2005,17(5):217-219
[4] 中华医学会肝脏病学分会脂肪肝和酒精性肝病学组. 非酒精性脂肪性肝病诊疗指南[J]. 中华肝脏病杂志,2006,14(3):161-163
[5] 危北海,陈治水,梁健,等. 跨入2011年中西医结合消化病学面临挑战和机遇[J]. 中国中西医结合杂志,2011,31(2):149-154
[6]NanesMS.Tumornecrosisfactor-α:molecularandcellularmechanismsinskeletalpathology[J].Gene, 2003,321(1):1-15
[7]IshizukaK,UsuiI,kanataniY,etal.Chronictumornecrosisfactor-alphatreatmentcausesinsulinresistanceviainsulinreceptorsubstrate-1serinephosphorylationandsuppressorofcytokinesignaling-3inductionin3T3-L1adipocytes[J].Endocrinology,2007,148(6):2994-3003
[8]RuanH,LodishHF.Insulinresistanceinadiposetissue:directandindirecteffectsoftumornecrosisfactoralpha[J].CytokineGrowthFactorRev,2003,14(5):447-455
[9]RotterV,NagaevI,SmithU.Interleukin-6inducesinsulinresistancein3T3-L1adipocytesandis,likeIL-8andtumornecrosisfactor-alpha,overexpressedinhumanfatcellsfrominsulin-resistantsubjects[J].JBiolChem,2003,278(46):45777-45784
浙江省中医药管理局项目(2012ZB081)
10.3969/j.issn.1008-8849.2015.33.012
R575.5
B
1008-8849(2015)33-3683-02
2015-04-01
