悬浮红细胞对异体T淋巴细胞增殖的影响及机制
2015-02-08赵学涛杨从容任晓亮解晓元巨红妹
赵学涛,杨从容,任晓亮,李 明,解晓元,巨红妹
(河北医科大学第四医院,河北 石家庄 050011)
悬浮红细胞对异体T淋巴细胞增殖的影响及机制
赵学涛,杨从容,任晓亮,李 明,解晓元,巨红妹
(河北医科大学第四医院,河北 石家庄 050011)

目的体外观察悬浮红细胞对异体T淋巴细胞增殖的影响并探讨其可能机制。方法采用Ficoll低密度离心法和免疫磁珠法从人外周血中分离纯化出CD3+T淋巴细胞,给予CD3/CD28抗体共刺激,并分别与异体非去白悬浮红细胞或去白悬浮红细胞混合培养72h。采用H3-胸腺嘧啶核苷掺入法检测各组T淋巴细胞增殖的情况。采用流式细胞仪检测各组培养体系中CD4+/CD8+及CD4+CD25+/CD4+细胞亚群比例。结果与阴性对照组(细胞培养液组)对比,非去白悬浮红细胞组和去白悬浮红细胞组T淋巴细胞增殖明显受到抑制,CD4+/CD8+细胞亚群比例下降(P<0.01),而CD4+CD25+/CD4+细胞亚群比例明显增加(P<0.01)。与去白悬浮红细胞相比,非去白悬浮红细胞的作用更明显(P<0.05)。结论悬浮红细胞可能通过上调CD4+CD25+调节性T细胞比例抑制异体T淋巴细胞增殖,而这种作用可能主要取决于悬浮红细胞内残留的白细胞。
悬浮红细胞;异体T淋巴细胞;CD4+/CD8+细胞亚群;CD4+CD25+Treg
临床研究证实,同种异体血输注(allogenic blood transfusion,ABT)可以诱导受血者产生免疫抑制,并由此可增加术后感染率和恶性肿瘤的复发率[1-2]。目前,这种输血相关免疫抑制的确切机制仍不清楚。CD4+CD25+T细胞是最近才被人们认识的一类免疫调节性T细胞(regulatory T cells,Treg),高表达CD25和CD4,参与机体的免疫抑制和免疫无能。成分血中何种因素引起了免疫抑制,以及这种免疫抑制机制是否与CD4+CD25+Treg有关目前国内外尚未见报道。为此,本研究以悬浮红细胞为研究对象,探讨其中哪种成分可影响异体T淋巴细胞的增殖,并从CD4+CD25+Treg角度进一步分析其可能的机制。
1 实验资料
1.1试剂 RPMI 1640培养基和胎牛血清购自Gibco公司;人淋巴细胞分离液购自挪威AXIS SHIELD公司;CD3+T细胞磁珠分选试剂盒购自Miltenyi Biotec公司;抗CD3单克隆抗体、抗CD28单克隆抗体购自Becton Dickinson公司;抗CD4-FITC、抗CD8-PE和抗CD25-PE荧光抗体均购自eBioscience公司。
1.2血液样品 外周全血取自健康自愿献血者。去白悬浮红细胞和非去白悬浮红细胞由河北医科大学第四医院输血科提供。
1.3方法
1.3.1外周血单个核细胞(PBMC)的分离 取无菌肝素钠抗凝全血,用生理盐水将其等倍稀释,稀释后的血标本缓慢加入人淋巴细胞分离液液面上,比例为1∶1,4℃下2000r/min离心15min,轻轻吸取第2层环状乳白色单个核细胞层,以PBS液洗涤2次,所得白色细胞沉淀即为PBMC,计数细胞后备用。
1.3.2磁珠分离纯化T淋巴细胞 取1×107个PBMC,用PBS调整细胞溶液体积至50μL;加入CD3抗体磁珠溶液10μL,混匀,4~8℃孵育20min;加入150μL PBS洗涤细胞,4℃下3000r/min离心10min;收集细胞,重悬细胞并调整细胞悬液体积至500μL;将分选柱固定于磁柱上,用500μL PBS预湿分选柱;将结合磁珠的细胞悬液加入分选柱内,洗涤3次,每次1000μL PBS;将分选柱从磁柱分开,加入1000μL PBS,收集流出液,4℃下3000r/min离心10min,所得沉淀物即为富集的T淋巴细胞,以含10%胎牛血清的RPMI1640培养液重悬,计数备用。
1.3.3混合培养 取上述T淋巴细胞悬液加入到含有CD3抗体(2μg/mL)和CD28抗体(5μg/mL)包被的96孔板中[1×105个/(100μL·孔)],然后分为3组:A组于上述T细胞悬液中加入细胞培养液100μL/孔作为阴性对照,B组加入非去白悬浮红细胞2×105个/(100μL·孔),C组加入去白悬浮红细胞2×105个/(100μL·孔),每组终体积200μL,设3个复孔。于37℃、5%CO2细胞培养箱中培养。
1.3.4T淋巴细胞增殖实验 采用H3-胸腺嘧啶核苷掺入(3H-TdR)法检测T淋巴细胞增殖情况。将上述各组细胞混合培养72h,在终止培养前16h每孔加入3H-TdR 20μL,继续培养16h,用多头细胞收集器将每孔培养物分别吸收于直径24mm的玻璃纤维滤纸上,抽气过滤并用蒸馏水充分洗涤。将滤纸片放在80℃烘干约1h,然后将滤纸片浸入加了10mL脂溶性闪烁液的闪烁杯中,置于β-液体闪烁记数仪中测定每个样品的每分钟脉冲数(cpm值)。
1.3.5CD4+/CD8+细胞亚群比例检测 混合培养72h后,收集各组细胞,用PBS洗涤2次,调整每管细胞数为2×105个,分别加入抗CD4-PE和抗CD8-FITC荧光抗体及相应同型对照,4℃避光孵育30min,用PBS洗涤3次,将细胞重悬至200μL,采用BD LSRⅡ流式细胞仪检测。
1.3.6CD4+CD25+/CD4+细胞亚群比例检测 混合培养72h后,收集各组细胞,调整每管细胞数为2×105个,分别加入抗小鼠CD25+-FITC荧光抗体、抗小鼠CD4+-PE荧光抗体及相应同型对照,冰上孵育30min,加入2% FBS-PBS液洗涤去除未结合抗体,1300r/min离心6min,洗2次,将细胞重悬至200μL,采用BD LSRⅡ流式细胞仪检测。
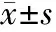
2 结 果
2.1各组异体T淋巴细胞增殖情况 3H-TdR掺入实验显示,A、B、C组T淋巴细胞数分别为2718±63.20,1584±46.88,1878±82.35,与A组相比,B组和C组均显著地抑制了CD3/CD28刺激引起的T淋巴细胞增殖(P均<0.01),且B组较C组抑制作用更明显(P<0.05)。
2.2各组CD4+、CD8+及CD4+/CD8+比例比较 流式细胞分析结果显示:与A组相比,B组和C组CD4+及CD4+/CD8+比例均明显降低(P均<0.01),且B组低于C组(P<0.05)。见表1。
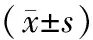
表1 各组CD4+/CD8+T细胞亚群情况比较
注:①与A组比较,P<0.01;②与C组比较,P<0.05。
2.3各组CD4+CD25+/CD4+比例比较 流式细胞分析结果显示:B组和C组CD4+CD25/CD4+比例均高于A组(P均<0.01),B组高于C组(P<0.05)。见图1~3。
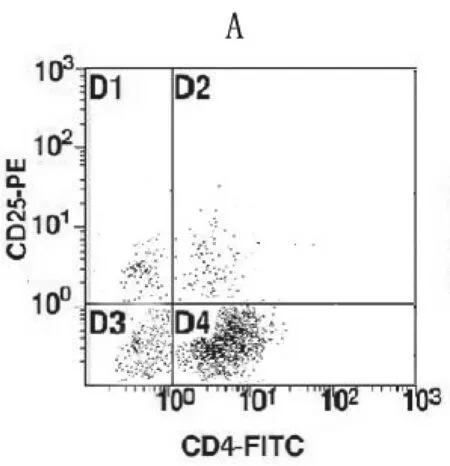
图1 A组CD4+CD25+/CD4+流式细胞图

图2 B组CD4+CD25+/CD4+流式细胞图

图3 C组CD4+CD25+/CD4+流式细胞图
3 讨 论
同种异体输血发挥临床治疗作用的同时,也会并发免疫相关的不良反应,如恶性肿瘤复发率增加、术后感染率上升、慢性病毒感染急性发作等,这些输血引起的一系列涉及免疫调节的反应称为输血相关性免疫调节(transfusion-associated immunomodulation,TRIM)[3]。目前,引起TRIM的具体机制仍不明确。Vamvalas等[4]认为白细胞(WBC)、血小板分泌并随着储存时间延长而蓄积的可溶性生物反应递质可能是引起TRIM的机制。Dzik等[5]也指出TRIM非特异性效应的产生可能是血液制品中的WBC引起的。如果TRIM效应确实由WBC源性可溶性分子介导产生,那么实行血制品储存前WBC滤过技术应该可以消除其相关的有害临床效应,因为在可溶性分子释放到血制品之前就已将WBC滤除。为此本研究通过体外实验比较了去白悬浮红细胞和非去白悬浮红细胞与异体T淋巴细胞共培养后对T细胞增殖及CD4+/CD8+T细胞亚群比例的影响,结果显示:悬浮红细胞可抑制异体T淋巴细胞的增殖,并降低CD4+/CD8+T淋巴细胞比例,而非去白悬浮红细胞组的作用更明显。CD4+/CD8+比值为一重要的免疫指标,正常情况下相对恒定,此比值显著降低常视为疾病严重和预后不良。本研究结果提示去除悬浮红细胞内残留的WBC可能会减轻但无法消除对异体T淋巴细胞的免疫抑制作用;同时也提示,红细胞悬液中除了WBC还有其他因素引起TRIM。国外早期一些临床随机对照实验显示,输注未去WBC的红细胞悬液会使术后感染率升高,而在欧美国家在临床上广泛实行去WBC的红细胞悬液输注政策后,研究者们将大量去WBC和未去WBC的病例做了回顾性的调查,分析结果显示除心脏手术外,去WBC的血液制品并未降低术后感染率和术后病死率[6-8],与本研究结果不符,分析原因可能是悬浮红细胞内残留的WBC较少,输入体内后被稀释,对异体T淋巴细胞的免疫抑制作用不占主导地位,因此去白血液制品对术后感染率和术后病死率影响不明显,在体内环境中对异体的免疫抑制起主导作用的可能是血液制品中其他因素。既往研究发现,在储存期间红细胞本身的生化功能及形态也会发生变化,细胞形态由圆盘状向球状改变,红细胞悬液中的ATP、2,3-DPG、磷脂均会减少,细胞浮密度、渗透溶血的易感性等会增加[9],这些变化都有可能是引起TRIM的原因。这也是本课题组下一步研究的重点。
异体血输注是通过何种途径引起免疫抑制目前尚不明确,CD4+CD25+Treg细胞具有抑制T细胞增殖活化的作用早已得到公认,于是本研究进一步检测了CD4+T细胞中的调节性细胞亚群CD4+CD25+细胞是否成比例地增加。结果显示:与阴性对照组相比,两悬浮红细胞组CD4+CD25+Treg细胞比例明显增加,而与去白悬浮红细胞相比,非去白悬浮红细胞的这种作用更明显一些。提示悬浮红细胞可能通过上调CD4+CD25+Treg细胞比例起到免疫抑制作用,在体外环境下这种作用主要依赖于悬浮红细胞内残留的WBC。
综上所述,去白悬浮红细胞和非去白悬浮红细胞均可抑制异体T细胞增殖,而在体外环境下非去白悬浮红细胞的抑制作用更加明显,并且首次证实这种抑制作用与上调CD4+CD25+Treg细胞表达有关。实验同时提示除WBC外,悬浮红细胞中还存在其他因素介导T淋巴细胞免疫抑制,在临床用血中,去白悬浮红细胞输注可能并不能避免TRIM的发生,但具体是何种成分起作用还有待进一步研究。
[1] Bilgin YM,van de Watering LM,Versteegh MI,et al.Effects of allogeneic leukocytes in blood transfusions during cardiac surgery on inflammatory mediators and postoperative complications[J].Crit Care Med,2010,38(2):546-552
[2] Linder BJ,Frank I,Cheville JC,et al.The impact of perioperative blood transfusion on cancer recurrence and survival following radical cystectomy[J].Eur Urol,2013,63(5):839-845
[3] Vamvakas EC,Blajchman MA.Deleterious clinical effects of transfusion-associated immunomodulation:fact or fiction?[J].Blood,2001,97(5):1180-1195
[4] Vamvakas EC.Possible mechanisms of allogeneic blood transfusion-associated postoperative infection[J].Transfus Med Rev,2002,16(2):144-160
[5] Dzik WH.Apoptosis,TGF beta and transfusion-related immunosuppression:Biologic versus clinical effects[J].Transfus Apher Sci,2003,29(2):127-129
[6] Titlestad IL,Ebbesen LS,Ainsworth AP,et al.Leukocyte-depletion of blood components does not significantly reduce the risk of infectious complications.Results of a double-blinded, randomized study[J].Int J Colorectal Dis,2001,16(3):147-153
[7] Garancini M,Degrate L,Carpinelli MR,et al.Impact of pre-storage and bedside filtered leukocyte-depleted blood transfusions on infective morbidity after colorectal resection:a single-center analysis of 437patients[J].Surg Infect (Larchmt),2013,14(4):374-380
[8] Rahbari NN,Holoch J,Michalski I,et al.Leucocyte-depleted blood transfusion is an independent predictor of surgical morbidity in patients undergoing elective colon cancer surgery-a single-center analysis of 531patients[J].Ann Surg Oncol,2011,18(5):1404-1411
[9] 尹建平,张庆武,王曦,等.贮存过期红细胞的生化功能及形态的恢复研究[J].中国输血杂志,2005,18(2):106-109
Effect of red blood suspension on proliferation of allogene T lymphocytes and it’s mechanisms
ZHAO Xuetao, YANG Congrong, REN Xiaoliang, LI Ming, XIE Xiaoyuan, JU Hongmei
(The Fourth Hospital of Hebei Medical University, Shijiazhuang 050011,Hebei,China)
Objective It is to explore the effect of red blood suspension on proliferation of allogene T lymphocytes in vitro and to explore its possible mechanisms.Methods CD3+T cells from human peripheral blood were isolated and purified by Ficoll density gradient centrifugation combined with adherence MACS selection.Purifed human T cells were stimulated with anti-CD3/anti-CD28and then exposed to allogene leukocyte-containing red blood suspension or leukocyte-depleted red blood suspension for 72h.T cell proliferation was determined by 3H-thymidine.The ratios of CD4+/CD8+and CD4+CD25+/CD4+subgroup from different co-culture systems were detected by flow cytometry.Results Compared with that of negative group (culture media), the proliferations of allogene T lymphocytes were greatly suppressed,the ratio of CD4+/CD8+subgroup decreased, but the ratio of CD4+CD25+/CD4+subgroup increased in leukocyte-containing group and leukocyte-depleted group (P<0.01), while the influences were more obvious in leukocyte-containing group (P<0.05).Conclusion Red blood suspension could suppress significantly allogene T cell proliferation by up regulation of CD4+CD25+regulatory T (Treg) cells.This regulation, to a large extent, depending on the the remaining white blood cells in red blood suspension.
red blood suspension; allogene T lymphocytes; CD4+/CD8+subgroup; CD4+CD25+Treg cells
赵学涛,男,主管技师,博士,从事输血与肿瘤免疫研究工作。
10.3969/j.issn.1008-8849.2015.19.006
R0457.13
A
1008-8849(2015)19-2071-03
2015-01-20
