尿酸和NT-proBNP联合预测急性心力衰竭患者的短期不良预后
2015-02-07李荣陈爱文苏星烽李少霞甘敏陈玉环
李荣,陈爱文,苏星烽,李少霞,甘敏,陈玉环
• 论著 •
尿酸和NT-proBNP联合预测急性心力衰竭患者的短期不良预后
李荣,陈爱文,苏星烽,李少霞,甘敏,陈玉环
目的探讨联合尿酸和NT-proBNP对急性心力衰竭(AHF)患者短期不良预后的预测价值。方法连续入选2011年10月至2014年1月在高新区人民医院内科住院并诊断为AHF的患者193例,分别测定血尿酸(UA)和N-端脑利钠钛(NT-ProBNP)水平,随访6个月,记录期间发生的心血管事件,定义为心源性死亡和/或因心力衰竭而再住院。结果193例患者中,有23例死亡(11.9%),20例(10.4%)在随访期内因心力衰竭(HF)再住院。单因素回归分析显示,短期心血管不良事件发生的预测因素包括高水平的UA和NT-proBNP、低肾小球滤过率、未使用血管紧张素转换酶抑制剂或血管紧张素受体阻断剂及高龄等。多因素Cox回归分析表明,UA水平与心血管事件的发生率增加独立相关(HR=1.115;95%CI:1.006~1.235;P=0.037)。Kaplan-Meier生存分析显示,UA水平>8.0 mg/dL及NTProBNP>4210 pg/mL的患者发生心血管事件的风险最高(P=0.01)。结论对于AHF患者,UA和NTProBNP水平联合可作为短期不良预后的独立预测因素,且比其中单用一种标志物更有效。
尿酸;N端脑利钠肽;急性心力衰竭
心力衰竭(心衰,HF)是常见心血管疾病之一,可显著增加患者发病率和死亡率,严重影响生存质量和预后。尽管心衰的诊治取得了许多进展,但其死亡率较高,除了改善患者症状,更重要的是如何有效筛查发生不良预后的高危人群,加强此类人群的管理,针对心肌重构机制,延缓心肌重构发展,从而降低心衰住院率和死亡率。尽管既往研究已发现许多用于评估HF患者预后的指标。但指标耗费太多,仅在研究中才对其进行评估,临床实际应用较差。目前需可以在任何环境下简单而廉价进行测量的预后评估指标。
N-端脑利钠钛(NT-ProBNP)水平对HF患者具有诊断和预后价值。在HF诊断中,NT-proBNP水平是急性呼吸困难的标记物[1,2]。同时,NTProBNP水平是临床结局——如再次入院和死亡率的重要预测因素[3,4]。最近有研究发现,尿酸(UA)水平与心血管危险因素或不良心血管事件相关[5,6],UA水平升高也与HF有关。对于中度至重度慢性心力衰竭(CHF)患者,较高血清UA水平是不良预后的独立危险因素[7]。本研究的目的是评估联合UA和NT-proBNP水平对急性心力衰竭(AHF)患者短期不良心血管事件的预测价值。
1 对象与方法
1.1 研究对象连续入选2011年10月至2014年1月在高新区人民医院内科住院并诊断为AHF患者。入选标准:AHF患者,年龄≥18岁;排除标准:具有血液系统疾病;已接受血液或者腹膜透析;肝脏或肾脏移植;恶性肿瘤;已知或可疑妊娠女性。AHF定义为由于心脏结构或功能的异常,引起心排量的急剧降低,导致组织器官低灌注和急性淤血的一组临床综合征。本研究获得我院研究伦理委员会批准,所有患者均签署知情同意书。
1.2 研究方法(1)研究最终入选符合标准的AHF患者193例,详细登记患者的年龄、性别,身高,体重,既往高血压、糖尿病等病史,入院后的临床特征、实验室检查、药物治疗及出入量管理。(2)患者于入院时抽血测血尿酸,NT-ProBNP,血常规、肾功能等指标。入院24~48 h内行超声心动图,评估左室射血分数(LVEF)。估算肾小球滤过率(eGFR)通过简化MDRD公式计算:175×(Scr-1.234)×(age-0.179)×0.79(女性)。(3)随访观察的主要终点事件:最初入院后3个月内的心血管死亡和/或因HF再次入院。患者出院后通过门诊或者电话进行随访,并对随访期间的不良事件进行详细记录。
1.3 统计学分析采用SPSS16.0统计软件处理数据。符合正态分布的计量资料以(±s)描述,非正态分布计量资料以M表示;正态分布且方差齐的计量资料两组间均数比较采用独立样本t检验,对于符合正态分布但方差不齐的采用t检验,非正态分布计量资料的比较采用Mann-Whithy秩和检验。计数资料以率、构成比表示,采用χ2或Fisher检验;应用单因素logistic回归分析可能的危险因素如年龄、糖尿病、低血压等;再采用逐步回归法(P<0.1)对上述经单因素分析显示有统计学及临床意义的因素进行多因素logistic回归分析,得出独立危险因素。计算Kaplan-Meier乘积极限确定达到临床终点的累积概率。采用受试者工作特征(ROC)曲线下面积分析UA和NT-ProBNP对预后的预测价值。标准检验水准a=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 研究人群基线特征本研究共纳入193例AHF患者,平均年龄为69±13岁,男性76例(39.4%)。所有患者均完成6个月随访。其中,23例患者(11.9%)死于心血管事件,20例患者(10.4%)因HF再入院。心血管疾病死亡的原因包括心源性休克、由于心衰恶化产生的肺水肿、可能由于室性心律失常引起的猝死。
发生心血管事件患者(n=28)的年龄高于未发生患者(n=165),且使用血管紧张素转换酶抑制剂(ACEI)或血管紧张素受体阻滞剂(ARBs)的比例更低。然而,发生心血管事件组和无心血管事件组的糖尿病和高血压发生率相似,且两组的超声心动图参数亦无统计学差异(表1)。
同时,心血管事件组和无心血管事件组之间生化指标的比较显示,与无事件组相比,发生心血管事件患者NT-proBNP和UA水平更高及肾功能更差(NT-proBNP,8.80±1.35 vs. 8.11±1.35,P=0.013;UA,9.18±3.65 vs. 7.89±2.87,P=0.023;eGFR,38.72±26.49 vs. 56.11±47.13,P=0.057)。两组间的生化指标无显著差异(表2)。
2.2 单因素和多因素回归分析单因素回归分析显示,UA水平和NT-ProBNP水平高和年龄大的患者短期心血管事件的风险更高。而未使用ACEI或ARBs的患者发生心血管事件的风险也更高。多因素回归分析显示,校正其他因素后,高UA水平是心血管事件的唯一显著独立危险因素(HR=1.114;95%CI:1.009~1.230;P=0.033)(表3)。
2.3 ROC曲线和生存分析UA和NT-ProBNP的ROC曲线下面积相似(分别为AUC=0.682;95% CI:0.494~0.751,P=0.012;AUC=0.623,95% CI:0.528~0.757,P=0.001)。UA的最佳预测值为8.0 mg/dL,敏感度为67.9%,特异性为60.4%。NT-ProBNP的最佳预测值为4210 pg/mL,敏感度为71.4%,特异性为50.3%(图1)。
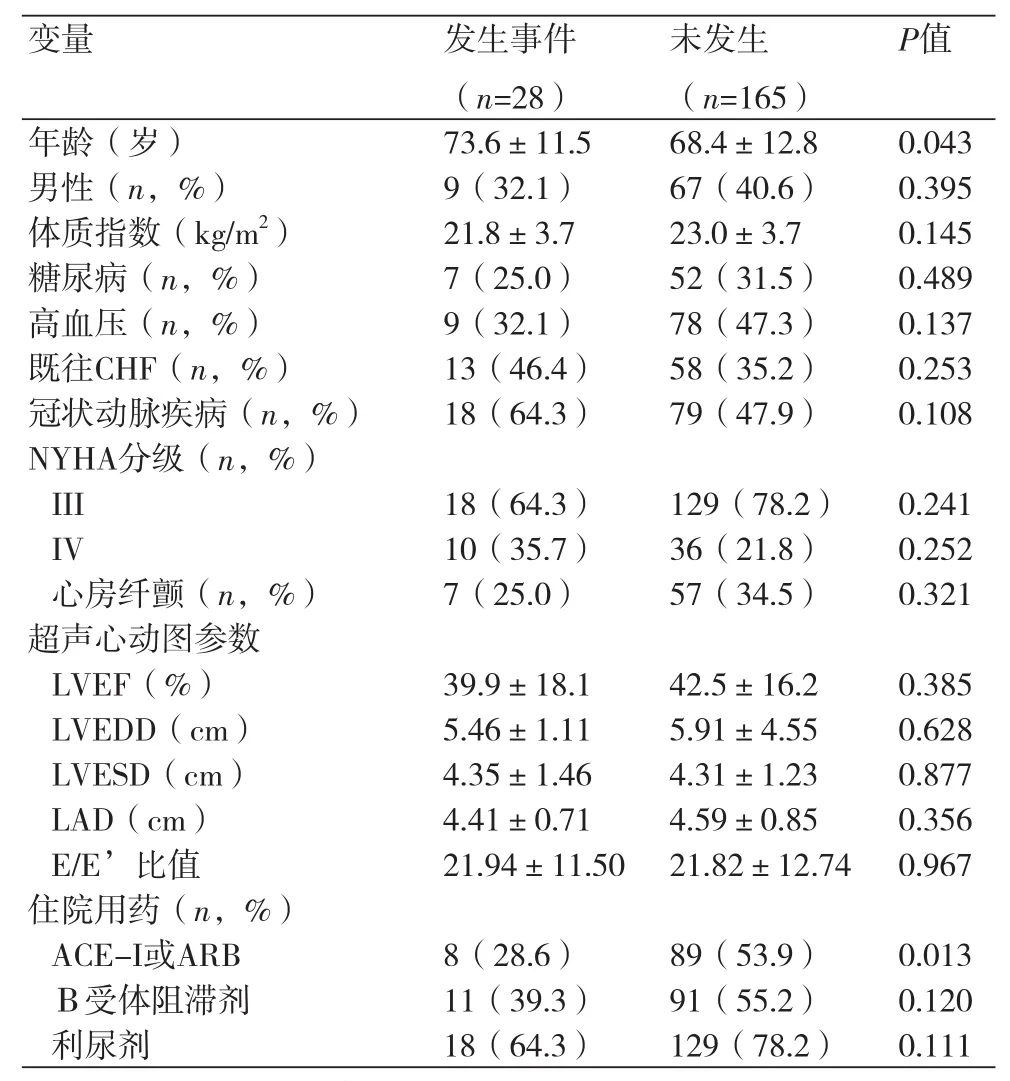
表1 不同事件状态下患者的基线特征比较
Kaplan-Meier生存曲线显示,与UA≤8.0 mg/ dL和NT-ProBNP ≤4210 pg/mL的患者相比,UA水平>8.0 mg/dL和NT-ProBNP>4210 pg/mL的患者心血管事件风险更高(HR=5.840;95%CI:1.677~20.333;P=0.006)。卡方分析显示,与传统危险因素如年龄、肾小球滤过率相比,NT-proBNP水平加入后,预测值出现了4倍的增量改善,而UA水平加入后,增量改善为8。各组间两两比较差异均有统计学差异(P<0.05)(图2)。
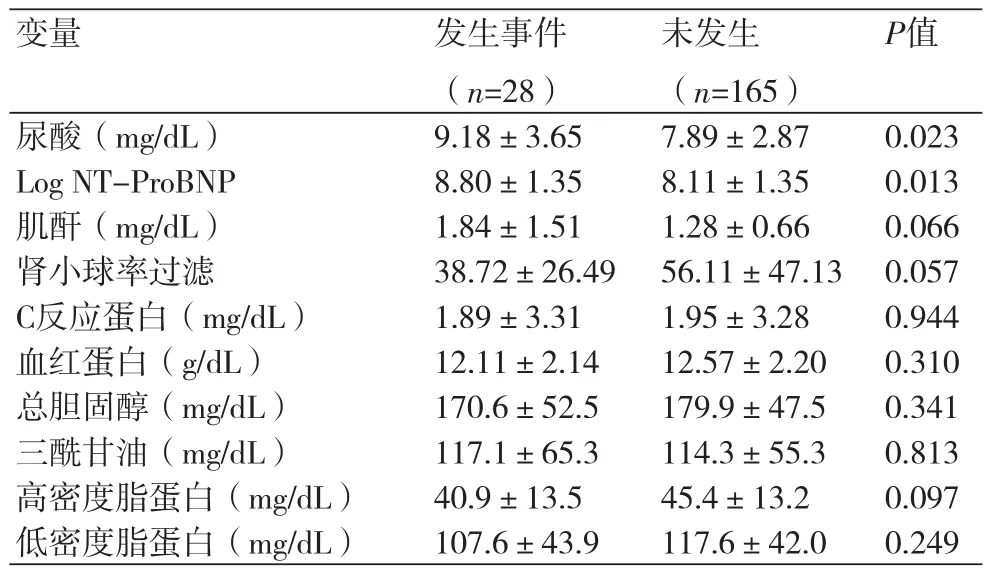
表2 两组患者的生化指标比较
3 讨论
本研究表明,UA是AHF患者短期不良心血管事件的一个重要预测因素。此外,联合UA和NT-proBNP水平可以更有效的预测AHF患者的不良预后发生。
UA是嘌呤代谢的最终产物[8],缺氧会引起血清UA水平的提高[9]。组织缺氧导致黄嘌呤氧化酶(XO)系统激活会增加UA的生成,引起高尿酸血症。因此,高尿酸血症是氧化应激,内皮功能不全的标志物,而UA水平则反映了XO激活的程度[9]。HF中,细胞死亡、组织缺氧和代谢受损都会增加XO的活性,导致UA的过量生成。尽管HF患者血液循环中的UA提高可能源于UA产生增加,UA排泄下降或两者兼有;然而,UA的过量生成却是CHF中UA水平升高的主导因素[10]。
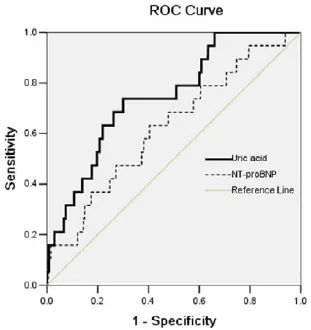
图1 UA和NT-ProBNP的ROC曲线
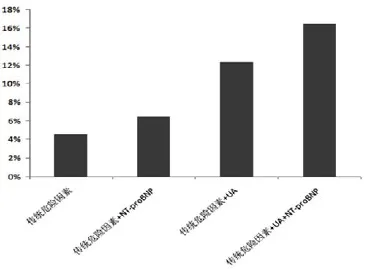
图2 传统危险因素与新增UA和 NT-ProBNP后的两两比较
大量研究已表明,高尿酸血症对CHF患者不良预后的重要性。Anker等[7]发现,对于中重度CHF患者,血清UA水平升高是预后不良的独立危险因素。Sakai等[11]研究表明,UA从CHF患者的心脏中释放出来,UA的血清浓度变化与左室射血分数相关,血清UA水平高是 死亡率的重要预测因素,且独立于已知的危险因素之外,如肾小球滤过率和BNP等因素。其它研究亦表明,XO抑制可改善HF患者的心肌功能[12]和射血分数[13]。此外,Málek F等[14]表明,长期、高剂量而非长期、低剂量的别嘌醇治疗,可能与CHF患者死亡率的降低相关。
最近有研究发现,UA水平可能是AHF患者的一种预后标志物。Pascual-Figal等[15]探讨了高尿酸血症对AHF患者的长期临床预后价值,研究表明UA水平与更高的死亡率、心衰入院和两事件兼有的风险相关,该研究还认为,血清UA对于AHF患者具有预后价值。与本研究结果相似。
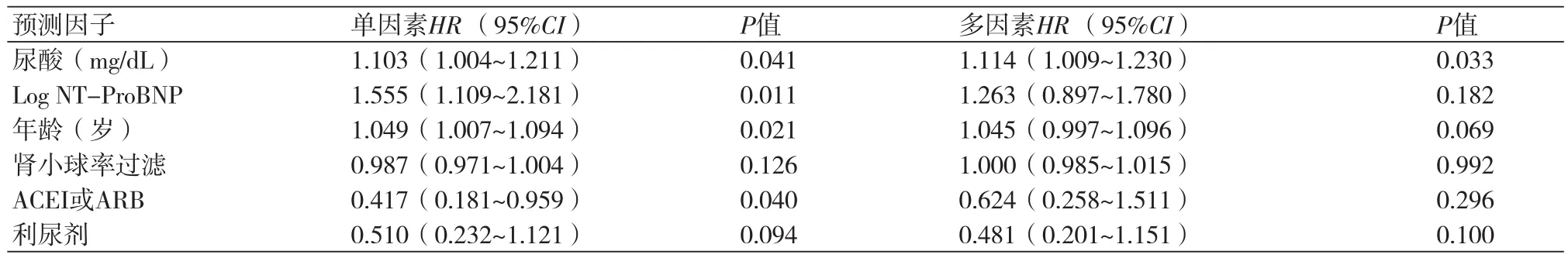
表3 单因素和多因素cox回归分析结果
XO激活导致的UA过量生成是CHF患者高尿酸血症的主要机制[12]。高尿酸血症对AHF和CHF的病理生理机制可能存在差异。然而,目前无明确的机制解释AHF患者高尿酸血症的原因。我们认为,缺血性损伤或肾功能急性恶化引起的细胞死亡或凋亡可能是AHF中高尿酸血症的主导因素。目前尚需更多的研究以确定AHF患者高尿酸血症的病理生理机制。
BNP为HF患者预后的重要预测因素[16]。本研究的假设是,联合UA和NT-proBNP可提高对AHF患者预后的预测价值。研究发现,相比于这两种水平更低的患者,UA水平或NT-ProBNP水平高的患者的预后更差。此外,UA和NT-proBNP水平的联合提供的预后价值高于传统的危险因素。因此,UA和NT-pro BNP水平的联合似乎是AHF患者短期不良心血管事件的更有利预后指标,且根据UA和NT-proBNP水平对患者进行风险分层也是可行的。
本研究中分析中使用的是入院时血清UA和NT-proBNP水平。出院前获取的生化标志物由于不能反映对临床事件如住院死亡的影响,因此在预测短期不良预后上它们有其局限性。本研究的目的是评估UA和NT-proBNP水平在预测短期不良事件的预后价值,是入院时获取的实验数据。同时,UA主要由肾脏排出,因此预想UA水平、肾功能和利尿剂治疗之间存在相关性。然而,以往研究表明,UA的预后价值独立于这些变量[15]。本研究的多因素分析显示,UA的预测价值也独立于肾功能和利尿剂治疗。虽然NT-proBNP的浓度同样受肾功能的影响,但NT-ProBNP仍对HF患者的评估具有价值,无论肾功能状态如何[17]。
总之,UA水平是AHF患者短期不良事件的独立预测因素,UA和NT-proBNP水平的联合检测是AHF短期不良心血管事件更有效的预后标志物。
[1] Maries L,Manitiu I. Diagnostic and prognostic values of B-type natriuretic peptides (BNP) and N-terminal fragment brain natriureticpeptides (NT-pro-BNP)[J]. Cardiovasc J Afr,2013, 24(7):286-9.
[2] Song BG,Jeon ES,Kim YH,et al. Correlation between levels of N-terminal pro-B-type natriuretic peptide and degrees of heart failure[J]. Korean J Intern Med,2005,20(1):26-32.
[3] Bettencourt P,Azevedo A,Pimenta J,et al. N-terminal-pro-brain natriuretic peptide predicts outcome after hospital discharge in heart failure patients[J]. Circulation,2004,110(15):2168-74.
[4] Uraizee I,Cheng S,Hung CL,et al. Relation of N-terminal pro-B-type natriuretic peptide with diastolic function in hypertensive heart disease[J]. Am J Hypertens,2013,26(10):1234-41.
[5] Gotsman I,Keren A,Lotan C,et al. Changes in uric acid levels and allopurinol use in chronic heart failure: association with improved survival[J]. J Card Fail,2012,18(9):694-701.
[6] Bos MJ,Koudstaal PJ,Hofman A,et al. Uric acid is a risk factor for myocardial infarction and stroke: the Rotterdam study[J]. Stroke,2006, 37(6):1503-7.
[7] Anker SD,Doehner W,Rauchhaus M,et al. Uric acid and survival in chronic heart failure: validation and application in metabolic, functional, and hemodynamic staging[J]. Circulation, 2003,107(15):1991-7.
[8] Leyva F,Chua TP,Anker SD,et al. Uric acid in chronic heart failure: a measure of the anaerobic threshold[J]. Metabolism, 1998,47(9):1156-9.
[9] Leyva F,Anker S,Swan JW,et al. Serum uric acid as an index of impaired oxidative metabolism in chronic heart failure[J]. Eur Heart J, 1997,18(5):858-65.
[10] Henry-Okafor Q,Collins SP,Jenkins CA,et al. Relationship between Uric Acid Levels and Diagnostic and Prognostic Outcomes in Acute Heart Failure[J]. Open Biomark J,2012,13(5):9-15.
[11] Sakai H,Tsutamoto T,Tsutsui T,et al. Serum level of uric acid, partly secreted from the failing heart, is a prognostic marker in patients with congestive heart failure[J]. Circ J,2006,70(8):1006-11.
[12] Cappola TP,Kass DA,Nelson GS,et al. Allopurinol improves myocardial efficiency in patients with idiopathic dilated cardiomyopathy[J]. Circulation,2001,104(26):2407- 11.
[13] Cingolani HE,Plastino JA,Escudero EM,et al. The effect of xanthine oxidase inhibition upon ejection fraction in heart failure patients: La Plata Study[J]. J Card Fail,2006,12(7):491-8.
[14] Málek F,Ostádal P,Parenica J,et al. Uric acid, allopurinol therapy, and mortality in patients with acute heart failure--results of the Acute HEart FAilureDatabase registry[J]. J Crit Care,2012,27(6):737. e11-24.
[15] Pascual-Figal DA,Hurtado-Martínez JA,Redondo B,et al. Hyperuricaemia and long-term outcome after hospital discharge in acute heart failure patients[J]. Eur J Heart Fail,2007,9:518-24.
[16] Scali MC,Simioniuc A,Dini FL,et al. The potential value of integrated natriuretic peptide and echo-guided heart failure management[J]. Cardiovasc Ultrasound,2014,18(12):27.
[17] Anwaruddin S,Lloyd-Jones DM,Baggish A,et al. Renal function, congestive heart failure, and amino-terminal pro-brain natriuretic peptide measurement: results from the ProBNP Investigation of Dyspnea in the Emergency Department (PRIDE) Study[J]. J Am Coll Cardiol,2006,47(1):91-7.
Uric acid combining N-terminal pro brain natriuretic peptide for predicting short-term poor prognosis in patients with acute heart failure
LI Rong*, CHEN Ai-wen, SU Xing-feng, LI Shao-xia, GAN Min, CHEN Yuhuan.*Department of Internal Medicine, People's Hospital of Zhongkai High-Tech Zone, Huizhou City, Guangdong Province, Huizhou 516229, China.
LI Rong, E-mail: lirong201411@126.com
ObjectiveTo discuss the predictive value of uric acid (UA) combining N-terminal pro brain natriuretic peptide (NT-proBNP) to short-term poor prognosis in patients with acute heart failure (AHF).MethodsAHF patients (n=193) were chosen from Oct. 2011 to Jan. 2014, and their levels of UA and NT-ProBNP were detected and followed up for 6 m. The major adverse cardiovascular events (MACE) and rehospitalized cases due to cardiac death and/or heart failure were recorded.Results Of 193 patients, there were 23 (11.9%) died and 20 (10.4%) rehospitalized due to AHF. Single-factor regression analysis showed that predictive factors of short-term MACE risk included high levels of UA and NT-proBNP, lower glomerular filtration rate, angiotensin converting enzyme inhibitor, angiotensin receptor blocker and elderly age. Multi-factor Cox regression analysis showed that UA level was independently correlated to increase of MACE incidence (HR=1.115; 95%CI:1.006~1.235; P=0.037). Kaplan-Meier survival analysis showed that risk of MACE was the highest in patients with UA>8.0 mg/dL and NT-ProBNP>4210 pg/mL (P=0.01).ConclusionUA combining NT-ProBNP can be taken as an independent predictive factor for shortterm poor prognosis in AHF patients, which is more effective than any single one of them.
Uric acid; N-terminal pro brain natriuretic peptide; Acute heart failure
R541.6
A
1674-4055(2015)03-0390-04
2015-01-26)
(责任编辑:孙竹)
516229 惠州,广东省惠州市仲恺高新区人民医院内科
10.3969/j.1674-4055.2015.03.33
