MIF在兔心肌缺血/再灌注及急性心肌梗死中的动态变化
2015-02-07张存季祥武
张存,季祥武
• 论著 •
MIF在兔心肌缺血/再灌注及急性心肌梗死中的动态变化
张存,季祥武
目的探究巨噬细胞移动抑制因子(MIF)在兔心肌缺血/再灌注及急性心肌梗死模型中的动态变化。方法实验动物为雄性新西兰大白兔18只,随机分为假手术组、心肌梗死组及再灌注组,每组各6只。以“二线二结法”构造再灌注及心梗模型,假手术组仅穿线不结扎。心肌梗死组一直结扎左前降支;再灌注组均给以结扎30 min再灌注60 min处理。分别在术前1h、术后3 h、6 h、24 h、48 h、72 h股静脉穿刺抽血,酶联免疫吸附法检测血浆MIF浓度。结果三组术前MIF浓度无统计学差异(P均>0.05)。与假手术组比较,再灌注组以及心肌梗死组术后3 h、6 h、24 h、48 h、72 h MIF浓度均升高,差异有统计学意义(P均<0.05)。结论急性心肌梗死及缺血/再灌注过程中,MIF释放增加,浓度升高。
巨噬细胞移动抑制因子;心肌再灌注损伤;急性心肌梗死;心肌标志物;兔
巨噬细胞移动抑制因子(MIF)为炎性细胞因子,在动脉粥样硬化、肿瘤、糖尿病、缺血-再灌注损伤和心肌梗死等疾病中发挥重要作用。MIF由115个氨基酸组成,形成一个同源三聚体,每个单体由2个反向平行的α螺旋和6个β片层组成,3个β片层由6个α螺旋围绕成一端开放的中空桶样隧道形状,能结合小分子配体,如谷胱甘肽、多巴色素、神经节苷脂等[1]。单核细胞、巨噬细胞、B淋巴细胞、嗜酸性粒细胞、中性粒细胞、嗜碱性粒细胞、T淋巴细胞、肥大细胞、树突状细胞等均表达MIF[2]。冠状动脉斑块不稳定和破裂是急性冠脉综合症(acute coronary syndrome,ACS)发生发展的关键步骤。MIF参与动脉粥样斑块形成、发展及破裂。目前研究发现MIF能够诱导单核细胞和T淋巴细胞向动脉粥样硬化病变区聚集,调节血管平滑肌细胞的迁移和增殖,促进病变巨噬细胞向泡沫细胞转变,并上调基质金属蛋白酶(MMPs),尤其是MMP-2和MMP-9,增加细胞外基质金属蛋白的降解,导致斑块不稳定的发生[3]。另外,最新研究[4]发现其在缺血再灌注过程中发挥心肌保护功能。因此,MIF潜在的生物学功能为冠心病的诊断治疗提供新的思路。本实验旨在研究兔再灌注心梗模型的制备和在再灌注及心梗时血浆MIF含量的变化。
1 材料与方法
1.1 试剂与仪器兔巨噬细胞移动抑制因子ELISA试剂盒(上海桥杜生物科技有限公司)、心电图仪、高速离心机(Heraeus-SORVALL)、全自动酶标仪(Bio-Tek power ware)、超低温冰箱(Thermo-991)、碘尔康消毒液、肝素钠及柠檬酸钠溶液、微量移液器、3%戊巴比妥钠溶液。
1.2 动物模型的建立及分组实验动物为雄性新西兰大白兔(潍坊医学院动物实验中心提供)共18只,月龄4~6月,体重2.0~3.5 Kg,适应性喂养一周后,随机分为假手术组、心肌梗死组及再灌注组,每组各6只。实验动物经麻醉固定后,均采用“二线二结法”构建急性心肌梗死及再灌注模型[5],结扎部位以肺动脉圆锥与左心耳交界处的左冠状静脉主干为标志,于左心耳下方2 mm处穿线结扎左前降支。各组均以心电图记录Ⅱ导联形态(图1)。假手术组仅穿线不结扎。心肌梗死组一直结扎左前降支,以心电图Ⅱ导联ST段上抬>0.1 mV,结扎线以下心肌颜色变暗为结扎成功标志;再灌注组均给以结扎30 min再灌注60 min处理,心电图出现抬高的ST段回落>0.2 mV,或是T波振幅降低或倒置,提示再灌注成功。剖面撒少量青霉素粉,逐层缝合肌肉和皮肤。各组均于术前1 h,术后3 h、6 h、24 h、48 h、72 h于股静脉处采血2 ml,置于EP管中,并以柠檬酸钠作为抗凝剂,混合后静置10~20 min后,以1000×g离心15 min,收集上清液,-70℃冻存,成批测量相关指标。
图1 Ⅱ导联心电图(A术前;B 结扎10 min后;C再灌注1h)
1.3 血浆MIF含量检测按照顺序添加标准品溶液50μl,空白对照孔加入50μl蒸馏水,其余微孔中加入样品40μl,然后再加生物素标记的MIF抗体10μl。封板膜封板后置37℃温育30 min。揭掉封板膜,弃去液体,洗涤5次。标准品、待测样本各孔中加入50μl酶标溶液(空白对照孔除外),37℃恒温孵育1h。清洗酶标板5次后各孔加入显色剂A液50μl,再加入显色剂B液50μl,混匀,25~37℃避光反应10~15 min,加入50μl终止液。在450 nm波长读取各孔OD值。绘制标准曲线,计算各样品浓度。
1.4 统计学方法全部数据应用SPSS 17.0统计学软件进行分析,计量资料以均数±标准差(±s)表示,多组样本均数比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
三组术前MIF浓度无统计学差异(P均>0.05)。与假手术组比较,再灌注组及心肌梗死组术后3 h、6 h、24 h、48 h、72 h MIF浓度均升高,差异有统计学意义(P均<0.05)(表1)。
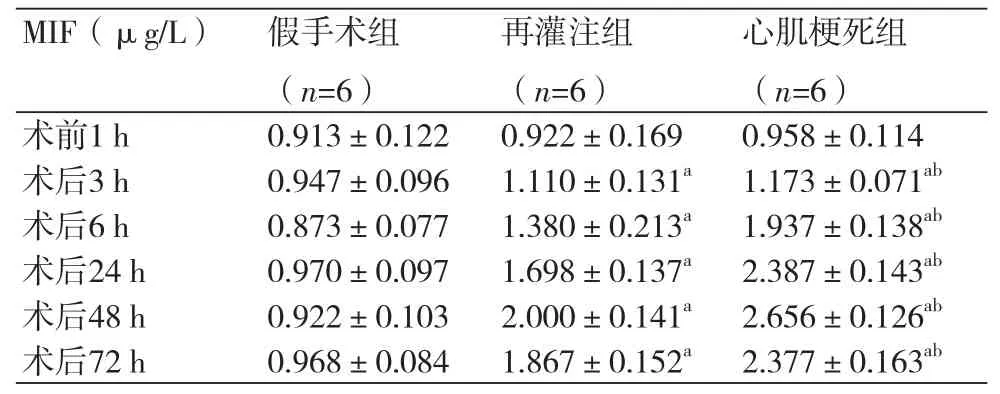
表1 各组血浆MIF浓度动态变化
3 讨论
MIF是1966年发现的第一个可溶性细胞因子,其基因片段小于1kb,包括3个外显子和2个内含子,外显子长度为66、107、172个碱基,内含子为94个和188个碱基,共有115个氨基酸残基,在哺乳动物中的同源性达90%以上。MIF来源广泛,主要由巨噬细胞、淋巴细胞等产生。其不仅参与调节巨噬细胞的吞噬和粘附功能,而且可促进巨噬细胞释放白介素-1(IL-1)、肿瘤坏死因子(TNF-α)、一氧化氮(NO)、过氧化氢(H2O2)等,参与体内急慢性炎症反应和抗肿瘤等过程。MIF还可以通过蛋白多糖CD44和SRCK(Src家族激酶)与CD74形成信号复合物从而激活下游信号转导通路,包括丝裂原活化蛋白激酶诱导的细胞增殖,TLR4受体的表达(Toll样受体),PI3K/Akt和ERK促细胞增殖,以及下调p53抑制细胞凋亡[6]。近年来发现它在动脉粥样硬化、缺血-再灌注损伤和心肌梗死等方面也起到重要作用。
炎症反应是动脉粥样硬化形成的主要因素之一[7-9]。MIF为一种炎症趋化因子,参与动脉粥样硬化进程[10]。MIF在病变区域的内皮细胞、平滑肌细胞、巨噬细胞和T细胞表达上调,提示MIF在不稳定斑块中的作用[11]。在动脉粥样硬化病变区域,MIF和CSN5/JAB1(NF-κB重要的转录因子)之间的相互作用参与动脉粥样硬化相关炎症和免疫过程[12]。MIF为CSN5的抑制因子,可能与JAB1协同调控NF-κB因子,调控动脉粥样硬化中的炎症和免疫信号通路[13]。
本实验中,无论是再灌注组还是心肌梗死组,结扎冠状动脉左前降支后均出现血浆MIF浓度增高,分析其原因为:(1)MIF为组成性表达,以蛋白前体的形式储存于心肌细胞中。当心肌细胞发生缺血、坏死时,储存在内部的MIF蛋白被释放进入血液循环,导致血浆MIF浓度的增高。(2)心肌细胞缺血、坏死,从而引发剧烈的炎症反应,导致各种炎症介质的释放以及炎症细胞的浸润,炎症细胞如中性粒细胞及巨噬细胞等都是MIF的来源。
若发生长时间的缺血,MIF不仅会失去保护心肌的作用,反而会因其广泛的促炎作用,诱导炎症介质如IL-1、TNF-α等的释放,促进巨噬细胞、T细胞大量聚集于梗死部位,导致心肌细胞损伤[14]。另外,MIF还可通过抑制糖皮质激素的抗炎作用,加剧炎症反应。MIF自急性心肌梗死3 h后开始增加,6 h后显著升高。更重要的是,早期MIF释放的水平,可能在预测梗死面积及预后方面发挥重要作用,将有望成为一种潜在的心肌标志物[15]。
[1] Sun HW,Bernhagen J,Bucala R,et al. Crystal structure at 2.6-A resolution of human macrophage migration inhibitory factor[J]. Proc Natl Acad Sci USA,1996,93(11):5191-6.
[2] Wilson JM,Coletta PL,Cuthbert RJ,et al. Macrophage migration inhibitory factor promotes intestinal tumorigenesis[J]. Gastroenterology, 2005,129(5):1485-503.
[3] Kong YZ,Yu X,Tang JJ,et al. Macrophage migration inhibitory factor induces MMP-9 expression: implications for destabilization of human atherosclerotic plaques[J]. Atherosclerosis,2005,178(1):207-15.
[4] Miller EJ,Li J,Leng L,et al. Macrophage migration inhibitory factor stimulates AMP-activated protein kinase in the ischaemic heart[J]. Nature,2008,451(7178):578-82.
[5] 薛枫,杨向军,李勋,等. 兔在体心脏缺血再灌注模型的制作方法的改进[J]. 中国比较医学杂志,2010,2(2):52-61.
[6] Morand EF,Leech M,Bernhagen J,et al. MIF: a new cytokine link between rheumatoid arthritis and atherosclerosis[J]. Nat Rev Drug Discov,2006,5(5):399-410.
[7] Libby P. Inflammation in atherosclerosis[J]. Nature,2002,420(9):868-74.
[8] 贾乙,周丽. Nod样受体蛋白3炎症小体与动脉粥样硬化关系的研究现状与进展[J].中国动脉硬化杂志,2014,22(1):79-84.
[9] 李冠臻,张新超.大炎肽/同种异体移植炎症因子1与动脉粥样硬化的相关研究进展[J].中国动脉硬化杂志,2014,22(9):970-2.
[10] Noels H,Bernhagen J,Weber C. Macrophage migration inhibitory factor: a noncanonical chemokine important in atherosclerosis[J]. Trends Cardiovasc Med,2009,4(3):76-86.
[11] Schmeisser A,Marquetant R,Illmer T,et al. The expression of macrophage migration inhibitory factor 1alpha (MIF 1alpha) in human atherosclerotic plaques is induced by different proatherogenic stimuli and associated with plaque instability[J]. Atherosclerosis,2005, 178(1):83-94.
[12] de Winther MP,Kanters E,Kraal G,et al. Nuclear factor kappaB signalling in atherogenesis[J]. Arterioscler Thromb Vasc Biol,2005,25(5):904-14.
[13] Kleemann R,Hausser A,Geiger G,et al. Intracellular action of the cytokine MIF to modulate AP-1 activity and the cell cycle through Jab1[J]. Nature,2000,408(6809):211-16.
[14] Dayawansa NH,Gao XM,White DA,et al. Role of MIF in myocardial ischaemia and infarction: insight from recent clinical and experimental findings[J]. Clin Sci,2014,127(3):149-61.
[15] Chan W,White DA,Wang XY,et al. Macrophage migration inhibitory factor for the early prediction of infarct size[J]. J Am Heart Assoc,2013,2(5):e000226.
Dynamic changes of macrophage migration inhibitory factor in myocardial ischemia/reperfusion and acute myocardial infarction in rabbits
ZHANG Cun*, JI Xiang-wu.*Graduate Department, Weifang Medical College, Weifang 261000, China.
JI Xiang-wu, E-mail: jxwwf@126.com
ObjectiveTo study the dynamic changes of macrophage migration inhibitory factor (MIF) in myocardial ischemia/reperfusion and acute myocardial infarction (AMI) in rabbits.MethodsMale New Zealand rabbits (n=18) were randomly divided into sham-operation group, AMI group and reperfusion group (each n=6). The models of reperfusion and AMI were established by using 2-suture 2-ligation method, sham-operation group was not given ligation, AMI group was given ligation of left anterior descending branch, and reperfusion group was given ligation for 30 min and reperfusion for 60 min. The blood samples were collected from femoral vein at different time points including 1 h before operation and 3 h, 6 h, 24 h, 48 h and 72 h after operation for detecting plasma MIF concentration by using enzyme-linked immunosorbent assay (ELISA).ResultsThe plasma MIF concentration had no statistical difference among 3 groups before operation (all P>0.05), and increased in reperfusion group and AMI group 3 h, 6 h, 24 h, 48 h and 72 h after operation compared with sham-operation group (all P<0.05).ConclusionMIF will release more and its concentration will increase during the process of AMI and ischemia/reperfusion.
Macrophage migration inhibitory factor; Myocardial reperfusion injury; Acute myocardial infarction; Myocardial markers; Rabbits
R541.4
A
1674-4055(2015)03-0320-03
2014-11-20)
(责任编辑:姚雪莉)
261000 潍坊,潍坊医学院研究生部(张存);潍坊市人民医院心内一科(季祥武)
季祥武,E-mail:jxwwf@126.com
10.3969/j.1674-4055.2015.03.09
