芽胞杆菌高效分泌表达异源蛋白的研究进展
2015-02-02王培立伍宁丰
王培立, 王 平, 田 健, 伍宁丰*, 姚 斌
1.中国农业科学院饲料研究所, 北京 100081;2.中国农业科学院生物技术研究所, 北京 100081
芽胞杆菌属于革兰氏阳性菌,为严格需氧或兼性厌氧的有荚膜杆菌。细胞呈现直杆状,大小为(0.5~2.5) μm×(1.2~10) μm,常以链状或成对排列,具圆端或方端。该属细菌的重要特性是能够产生对不利条件具有特殊抵抗力的芽胞。本属包括对人和动物具有致病性的炭疽芽胞杆菌(Bacillusanthracis),能够引起食物中毒的蜡状芽胞杆菌(Bacilluscereus),以及非致病性的枯草芽胞杆菌(Bacillussubtilis)、多粘芽胞杆菌(Paenibacilluspolymyxa)、蕈状芽胞杆菌(Bacillusmycoides)、短小芽胞杆菌(Bacilluspumilus)、解淀粉芽胞杆菌(Bacillusamyloliquefaciens)和地衣芽胞杆菌(Bacilluslicheniformis)等近50种。1835年,Ehrenberg发现了枯草芽胞杆菌,命名为Vibriosubtilis。1872年,德国科学家科赫建立了第一个细菌分类系统,依据细菌形态特征命名了芽胞杆菌属(Bacillus),并且将枯草芽胞杆菌改名为Bacillussubtilis[1]。
在亚洲一些国家,枯草芽胞杆菌被用来制作发酵性食品豆豉,被公认为是具有食品安全性的菌种,归为一般认为的安全微生物范畴[2,3]。由于枯草芽胞杆菌的安全特性,使其及多种芽胞杆菌,如地衣芽胞杆菌、巨大芽胞杆菌(Bacillusmegatherium)、解淀粉芽胞杆菌(Bacillusamyloliquefaciens)、嗜热脂肪芽胞杆菌(Bacillusstearothermophillus)和蜡样芽胞杆菌(Bacilluscereus)等成为了重要的工业菌种,并在食品、医药、饲料、畜牧业和环境保护等领域得到广泛应用[1,4~6]。
1 芽胞杆菌作为基因工程菌株的优势
诺贝尔奖得主德国科学家Cohen教授及他的学生曾对枯草芽胞杆菌表达系统做过系统的阐述[7,8],可归结如下:
①枯草芽胞杆菌是非致病的土壤微生物,在有氧条件下生长繁殖迅速,易于培养。
②芽胞杆菌具有与高效分泌相关的信号肽和分子伴侣等,使其能高效分泌蛋白质,蛋白质被直接释放到培养基中,通过简单处理便可从发酵上清液回收并纯化目的蛋白,而且多数情况下芽胞杆菌分泌的异源蛋白质具有天然构象及生物活性。
③芽胞杆菌遗传背景清晰,具有可以应用的一些质粒载体,易于进行操作,并且具有良好的发酵基础和生产技术。
基于以上优点,目前枯草芽胞杆菌和解淀粉芽胞杆菌等在工业上已广泛用于生产淀粉酶、普鲁兰酶、蛋白酶、脂肪酶及药用蛋白等(表1)。
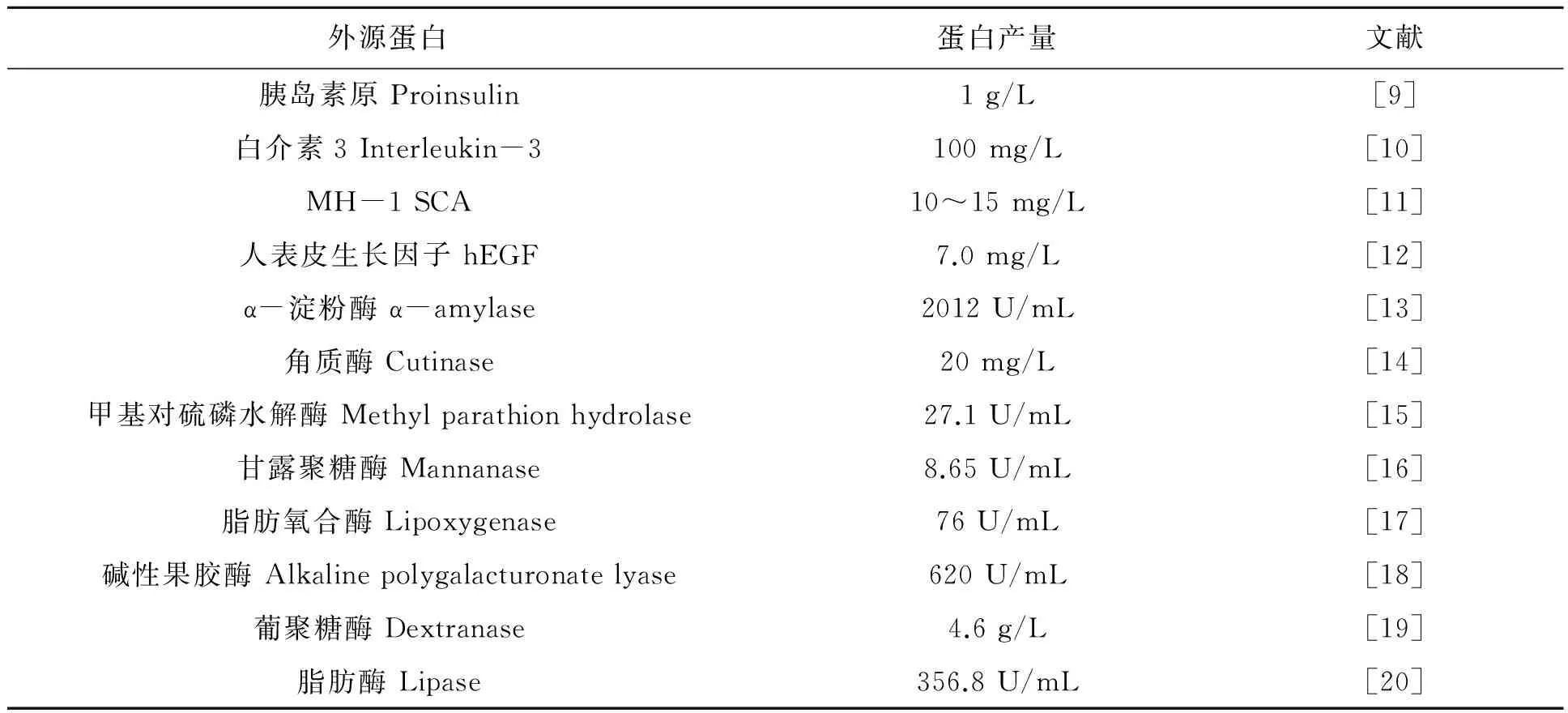
表1 枯草芽胞杆菌分泌表达的外源蛋白Table 1 Secretory expression of proteins from Bacillus subtilis.
2 芽胞杆菌分泌表达系统
2.1 芽胞杆菌分泌途径
芽胞杆菌蛋白分泌的研究主要是以枯草芽胞杆菌为模式菌株。带有信号肽的蛋白质主要通过图1所示的4种途径分泌到胞外。在枯草芽胞杆菌中,超过90%以上的胞外蛋白是通过Sec-SRP(sec-signal peptide recognition particle)途径分泌的[21],它是蛋白质分泌的主要途径。另外还存在双精氨酸途径(twin-arginine translocation pathway,Tat转运途径)、ATP结合转运途径(ATP-bing cassette transporters pathway,ABC转运途径)和假纤毛蛋白(pseudopilin)转运途径(Com转运途径)[22]。其中,ATP结合转运途径主要用于细菌素等一些分子的输出[23],假纤毛蛋白转运途径则参与枯草芽胞杆菌感受态的形成[24],这两种转运途径只输出特定且分子量相对较小的蛋白质分子。
2.1.1Sec-SRP途径 Sec-SRP途径的主要组分有信号肽、信号肽酶、SecYEG通道及各种细胞因子等。该途径的特点是:核糖体首先合成带有信号肽的蛋白前体,在一些蛋白因子及动力蛋白的作用下使其通过细胞膜上由一组膜蛋白组成的极性通道(该通道在真核生物、细菌、古菌中结构都比较保守)转移到细胞膜外,穿膜后信号肽被信号肽酶切割,在分子伴侣和一些细胞因子的作用下形成正确的构象,运送出细胞外。Sec-SRP分泌途径见图2。蛋白通过哪种途径分泌到胞外是由其所携带的信号肽类型所决定的。经Sec-SRP途径分泌的蛋白质其N端含有Sec型信号肽,该类信号肽约含有28个氨基酸残基,N端是带正电荷的N-域,中间是疏水的H-域,而C-端是信号肽切割区,最典型C端氨基酸序列是 Ala-X-Ala (X表示任一氨基酸),由第一类信号肽酶切割。
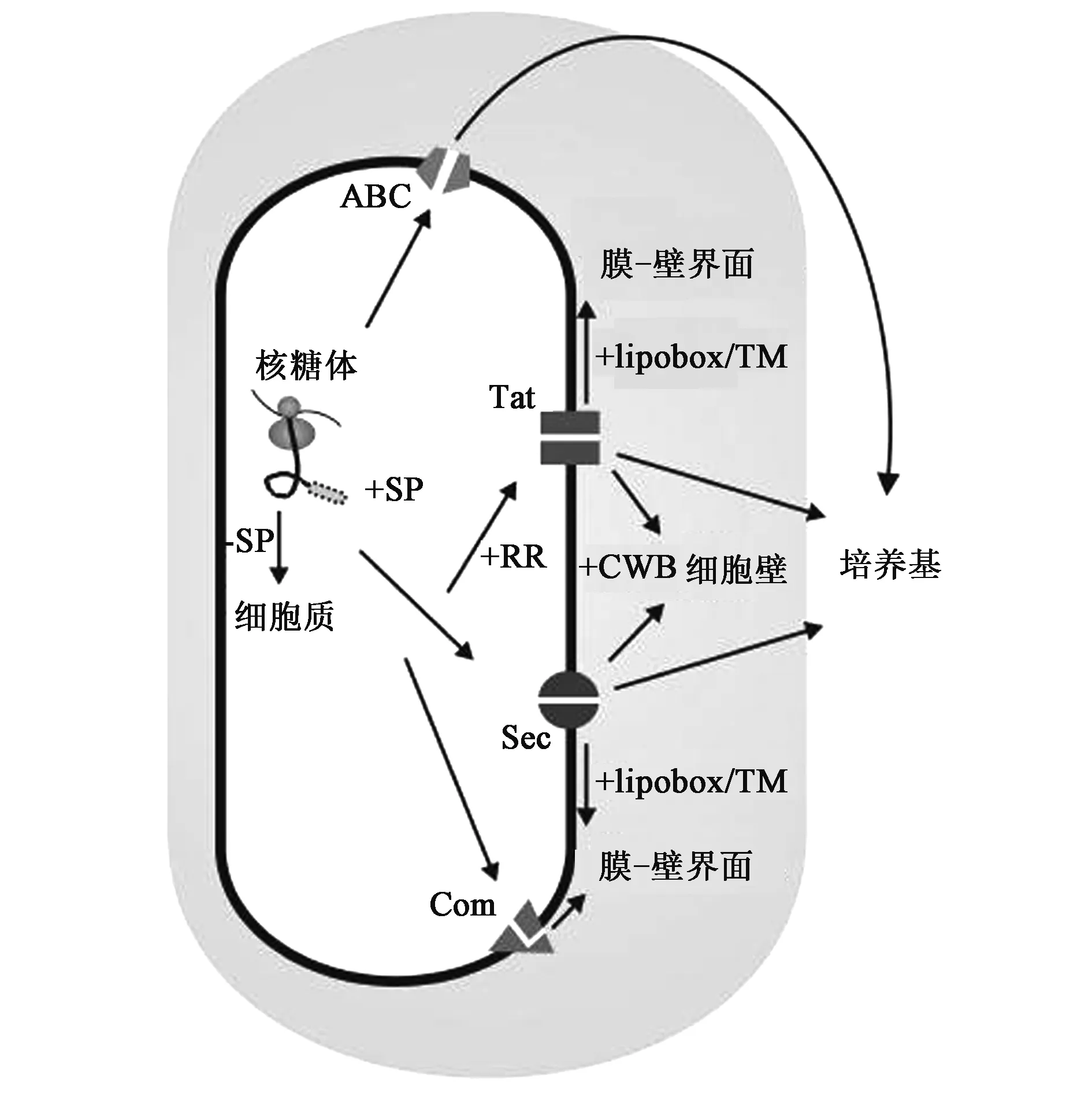
图1 枯草芽胞杆菌的分泌途径[21].Fig.1 Protein secretory pathways in Bacillus subtilis[21].
2.1.2Tat转运途径 Tat转运途径因分泌蛋白的信号肽中含有两个相邻的精氨酸残基而得名。经Tat转运途径分泌的蛋白其N端信号肽约含有36个氨基酸残基,其N-域有双精氨酸(RR/KR)序列,中间是疏水的H-域,C-端也是信号肽切割区。Tat转运途径可以转运紧密折叠的蛋白质或是多亚基酶复合物,而这部分蛋白质是不能通过Sec分泌途径进行分泌的。在枯草芽孢杆菌胞外蛋白中有27个蛋白前体N-端为Tat信号肽,但仅有磷酸二酯酶PhoD被确认是严格按Tat途径进行分泌的[21]。
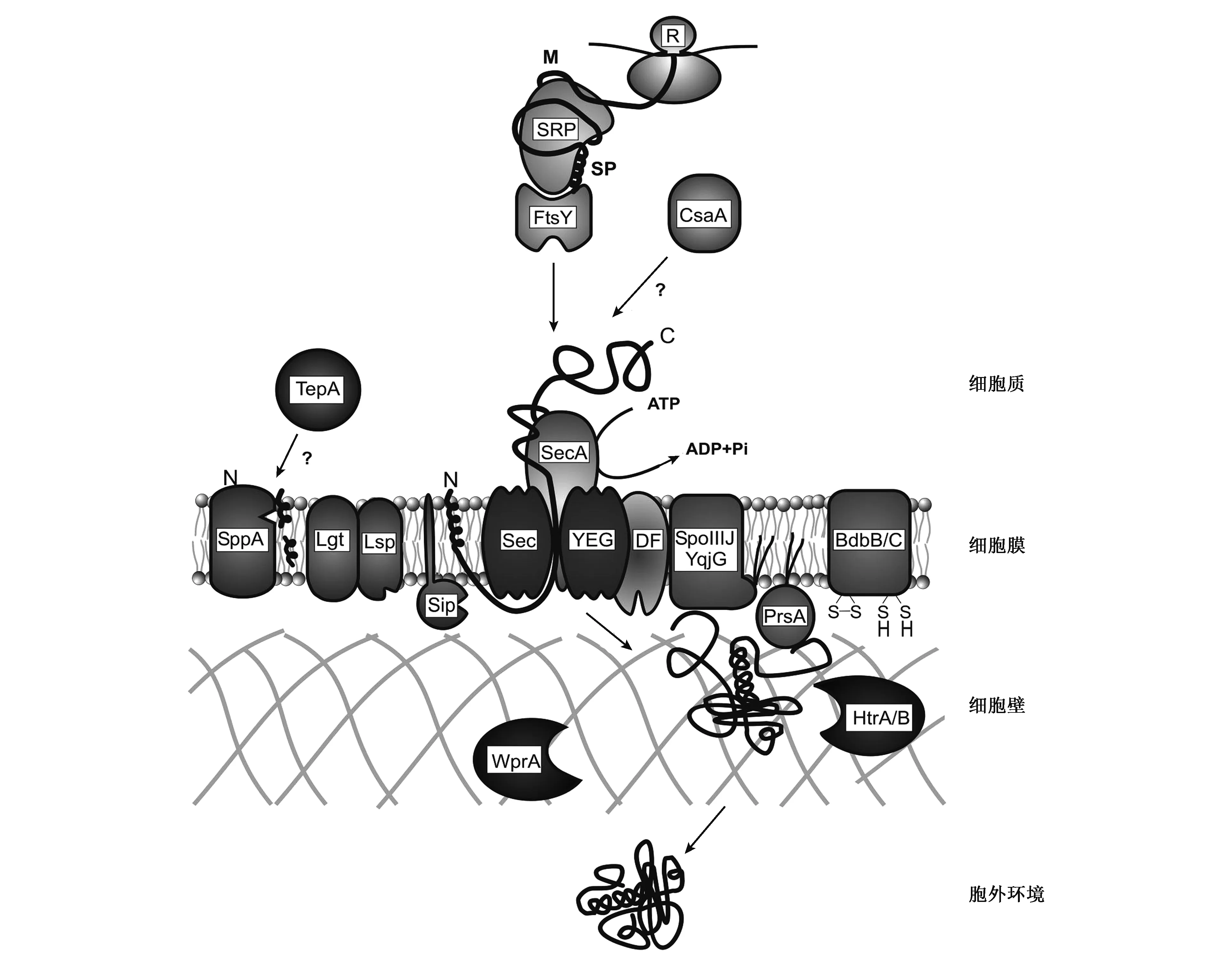
图2 枯草芽胞杆菌中的Sec-SRP分泌途径 [21].Fig.2 Protein secretory pathways of Sec-SRP in Bacillus subtilis[21].
2.2 外源基因在芽胞杆菌中的分泌表达
在分泌表达外源蛋白方面,芽胞杆菌一直被认为是很有潜力的宿主菌,如由各类芽胞杆菌生产的碱性蛋白酶、α-淀粉酶等几种重要的酶制剂,在2004年的总产值就已经占据世界酶制剂市场的50%[25]。迄今,仅枯草芽胞杆菌就表达了大约200种蛋白。1992年,Simonen等[26]总结了在B.subtilis中表达的蛋白质,虽然大部分蛋白都表达成功,但遗憾的是有些蛋白分泌量低,特别是来源于真核细胞和革兰氏阴性菌的外源蛋白质,如MH-1 SCA抗体在芽胞杆菌中可成功表达但产量只有10~15 mg/L(表1)[11]。造成蛋白质分泌量低的原因可能有:芽胞杆菌在对数末期会表达分泌大量的蛋白酶,对外源蛋白产生水解作用,造成目的蛋白的量降低甚至无法得到目的蛋白;芽胞杆菌中存在限制修饰系统会造成表达质粒不稳定;外源蛋白对细胞有毒性或影响细胞的生长等。因此,建立高效的芽胞杆菌分泌表达系统是十分必要的一项研究工作。近年来从宿主改造、基因及发酵途径等方面对提高外源基因在芽胞杆菌中的表达与分泌开展了一系列研究。
3 芽胞杆菌蛋白分泌表达的限制因素及改造策略
3.1 载体与基因
3.1.1基因结构及密码子优化 基因的二级结构影响其分泌表达,因此可以通过密码子优化来平衡基因中的GC含量,去除一些反向重复序列,计算并优化mRNA的二级结构等方法提升外源基因的分泌表达量。目前,与密码子优化相关的文献有很多,相关的软件也层出不穷,而优化的标准也因菌株而异。整体而言,目前密码子优化已经从传统的只考虑密码子使用频率,到现在需要综合考虑转录时mRNA的结构、翻译时翻译暂停等。目前常用的软件有DNAWorks(http://mcl1.ncifcrf.gov/dnaworks/)、Jcat(http://www.jcat.de/),日本还还开发了一个专门的密码子数据库(http://www.kazusa.or.jp/codon/)。
3.1.2使用串联启动子及启动子、信号肽的优化 在芽胞杆菌中启动子主要有单个启动子和复合启动子两种方式。只具有单个启动子的基因,大多数在生长比较快速的时候表达;复合启动子包括重叠启动子和串联启动子,在表达外源基因时具有一定的优势。Yamagata等[28]通过使用B.brevis47的串联启动子在B.brevis中成功高效表达了来源于地衣芽胞杆菌的α-淀粉酶基因bla,使α-淀粉酶的融合基因在B.brevis中的胞外表达量提升了50倍。
信号肽可以帮助蛋白质前体折叠,帮助蛋白质移位,对蛋白质分泌有重要作用。在芽胞杆菌宿主的系统中,来源于革兰氏阳性菌株的基因通常能够利用自身启动子以及信号肽进行分泌表达,然而来源于革兰氏阴性菌和真核细胞的胞外蛋白通常需要借助于芽胞杆菌胞外蛋白的启动子和信号肽才能够进行表达分泌。通常选用的启动子和信号肽有来源于芽胞杆菌的蛋白酶、淀粉酶等的启动子或信号肽。同一种蛋白在不同启动子、信号肽下的分泌效率也是不一样的[29],可以通过对启动子、信号肽等进行优化来提高外源蛋白的分泌量[46]。
3.1.3基因剂量的增加 表达载体的拷贝数或目的基因整合到基因组上的拷贝数,也就是通常所说的基因剂量,可以影响外源基因的分泌表达,提高基因剂量可以增加蛋白的表达量。通过使用多拷贝质粒载体或在基因组上整合多个拷贝的基因等手段可以提高外源蛋白表达分泌量。但是基因表达剂量并不是越高越好,只有合理提高基因剂量才可以增加外源蛋白的表达量,若外源蛋白的过量表达会使芽胞杆菌分泌系统过载,将会影响目的蛋白的分泌。Diderichsen等[30]在枯草芽胞杆菌中表达来源于嗜热脂肪芽孢杆菌(B.stearothermophilus)的α-淀粉酶基因时发现,α-淀粉酶过量表达会使菌体不稳定,并且过量的酶蛋白前体会饱和与分泌相关的蛋白运输元件,从而影响菌体的生理活性。通过脉冲示踪实验分析蛋白质分泌饱和程度表明,在一定范围内基因剂量和蛋白分泌成正相关。过高的基因剂量不仅不会使蛋白分泌增加,反而会造成大量的前体蛋白胞内积累,必然会对菌体生长产生影响。
3.2 与分泌过程相关的优化
3.2.1分泌途径中的改造 信号肽酶对信号肽的加工速度是影响蛋白质分泌的又一个限制因素。芽胞杆菌具有向胞外分泌蛋白的能力,其分泌途径主要为Sec-SRP途径,其中secA、secD、secE、secF、secY、ffh和ftsY等编码的蛋白参与枯草芽胞杆菌的蛋白分泌过程,在枯草芽胞杆菌中还发现了5种Ⅰ型信号肽酶的基因,分别为sipS、sipT、sipU、sipV和sipW。其中,SipW类似于真核生物的I型信号肽酶[27]。细胞中存在多个信号肽酶的作用主要是增加信号肽酶的总量,有助于提高细胞处理外泌蛋白质的通量。许多研究也发现,通过筛选合适的信号肽及过表达相关的信号肽酶可以提升外源基因的分泌表达量[46]。过量表达信号肽加工酶可以显著提高α-淀粉酶的分泌。Vitikainen等[31]过量表达信号肽加工酶SipT增加了枯草芽胞杆菌α-淀粉酶的分泌量。Pummi等[32]发现蛋白酶ClpXP的突变使信号肽加工酶SipS、SipT、SipV的表达水平提高2~5倍,从而提高了淀粉酶前体的加工速度,α-淀粉酶分泌量得以提高。
3.2.2分子伴侣与蛋白折叠相关因素的改造 分子伴侣具有调节胞内多肽折叠、装配,并介导蛋白质跨膜转运等多重功能。芽胞杆菌表达系统分泌表达外源蛋白时,由于缺乏有效的分子伴侣,外源蛋白无法被折叠形成正确的转运构象而被滞留在细胞内,从而影响到外源蛋白的分泌,因此分泌表达正确折叠的蛋白是非常重要的。通常外源蛋白被折叠成合适的转运构象需要合适的分子伴侣及其靶基因共同完成。芽胞杆菌本身具有一些较高水平的分子伴侣,如GroES、GroEL、DnaJ和GrpE等。Wong等[33]发现,在枯草芽胞杆菌中过量表达分子伴侣GroES和GroEL可以提升抗地高辛药物antidigoxin·SCA蛋白表达量。在芽胞杆菌Sec-SRP的分泌途径中,外源蛋白的前体合成后需要在胞内首先形成一定的构象才能穿过细胞膜运输到胞外,这就需要一些分子伴侣的辅助才能完成外源蛋白在细胞膜间的转运过程。因此过表达分子伴侣如PrsA等也有可能会影响外源基因在芽胞杆菌中的分泌表达[36]。
通过Sec-SRP途径进行蛋白分泌时涉及到的主要分子伴侣总结如下:
①CsaA。枯草芽胞杆菌中一种促进蛋白正确折叠并分泌的分子伴侣,其编码基因csaA是枯草芽胞杆菌体内的必需基因。CsaA有助于蛋白的分泌,可以帮助变性的蛋白质复性,防止变性蛋白质发生聚合,并能够作用于枯草芽胞杆菌转位酶来帮助外泌蛋白的分泌[21,34,35]。基于CsaA的这些作用,超量表达CsaA应该有助于提高芽胞杆菌表达系统中蛋白质的分泌量。
②PrsA。芽胞杆菌蛋白分泌后期的一种重要的分子伴侣,位于细胞膜和肽聚糖壁之间,是由292个氨基酸残基组成的一种脂蛋白,可以协助蛋白在细胞膜外进行正确的折叠,并形成具有天然构象的活性蛋白,起到胞外分子伴侣的作用,还有人认为PrsA可能具有蛋白酶抑制剂的作用,可以保护分泌蛋白不被蛋白酶水解[31],从而促进蛋白质的分泌[36]。Vitikainen等[31]通过实验证明过量表达prsA基因可以使外源蛋白在枯草芽胞杆菌中的分泌量增加。Lindholm等[37]发现枯草芽胞杆菌的prsA基因突变将影响其α-淀粉酶的分泌,乳酸球菌(Lactococcuslactis)中提高prsA基因表达水平可使α-淀粉酶的分泌量升高。
③WprA和HtrA/B。芽胞杆菌的细胞壁会影响新生蛋白的折叠及其稳定性,尤其是细胞壁上的一些金属离子,如很多蛋白质的折叠需要Ca2+,而蛋白质转移到胞外如不能被及时折叠就可能被一些蛋白酶降解掉,WprA和HtrA/B可能就具有降解错误折叠的外源蛋白的功能,这样就可以避免一些错误折叠的蛋白质封闭细胞壁的孔道[29]。WprA与HtrA/B两个组分组成了枯草芽胞杆菌的蛋白分泌的质量控制体系。WprA是枯草芽胞杆菌的一个胞外蛋白酶,是结合在细胞壁上的蛋白,具有两个功能结构区:一个是具有丝氨酸蛋白酶活性的功能区;另一个是具有分子伴侣活性的功能区。相对于两个功能区来讲,WprA同时具有两种功能:一是可以降解部分外源蛋白或细胞膜外错误折叠的蛋白质;二是WprA也可以帮助蛋白质折叠形成正确的构象[29]。蒋红亮等[29]敲除了wprA基因发现碱性果胶酶分泌量下降了36%。
④BDB和PPI。影响蛋白质结构的另一重要因素是与蛋白质折叠相关的酶,如二硫键氧化还原酶(BDB)和肽基脯氨酰顺反异构酶(PPI),它们可以分别帮助蛋白质结构中二硫键的形成和脯氨酸残基的顺反异构化,有利于新生肽链的折叠。这两种酶已被克隆到了芽胞杆菌宿主中,用于提高蛋白分泌[29]。
3.2.3蛋白酶与蛋白降解相关方面的改造 芽胞杆菌能够分泌多种蛋白酶[38],芽胞杆菌分泌的外源蛋白经常会被芽胞杆菌自身分泌的蛋白酶降解,严重影响目的蛋白的产量,所以蛋白酶相关基因的删除可能会提升外源蛋白在芽胞杆菌系统中的分泌量。以枯草芽胞杆菌的蛋白酶为例,中性蛋白酶NprE和碱性蛋白酶AprE为其主要蛋白酶,两种蛋白酶活性占蛋白酶总活力的95%以上,Vehmaanper等[39]敲除碱性蛋白酶基因aprE和中性蛋白酶基因nprE,使α淀粉酶产量提升了大约2倍。此外,枯草芽胞杆菌细胞壁蛋白酶WprA的蛋白酶活性可影响某些外源蛋白胞外表达的稳定性。如,Stephenson等[40~42]发现,WprA对转运后蛋白的稳定性有重要影响,敲除wprA或抑制其表达,可使α-淀粉酶产量显著增加。但蛋白酶基因的删除会影响菌株对物质的利用率,也会影响后续的发酵工艺。除了删除相关蛋白酶基因外,还可选用蛋白酶抑制剂或选择分泌蛋白酶较少的芽胞杆菌作为宿主菌。
3.2.4基于发酵工艺的分子改造 采用分子手段对发酵工艺相关方面进行改造可以使外源基因的分泌量增加,比如增加细胞的溶氧率[43]。Kallio等[44]将来源于透明颤菌的血红蛋白基因vhb克隆到枯草芽胞杆菌中,提升了细胞对溶氧限制的抵抗,使得外源蛋白表达总量提高了1.5倍。除此之外,还可以通过对芽胞杆菌芽胞生成的相关基因进行操作,破坏其芽胞生成的基因,从而延长菌株的稳定期,增加外源基因的分泌表达。芽胞杆菌的芽胞形成是由数百个基因协同完成的复杂过程。现在已有研究表明,控制芽胞生成的主要调控因子为Spo0A和sigma因子σH、σF、σE、σK、σG。同时Spo0A因子的磷酸化状态在芽胞形成的过程中起着重要的调控作用。近期研究发现,Spo0A受到磷酸化激酶KinA的激活,只有KinA达到一定程度Spo0A才能起到相应的作用,而且KinA对σF和σE的激活作用更加灵敏[45]。因此基于上述研究,可以对芽胞生成的关键基因进行改造从而提升外源基因在芽胞杆菌表达系统中的分泌表达。
4 展望
目前,大量不同来源的外源基因已在芽胞杆菌中实现了分泌表达,有些还获得了较高产率。使用各类芽胞杆菌已成功生产了碱性蛋白酶、α-淀粉酶等几种重要的酶制剂,其中α-淀粉酶的分泌表达量能达到20~30 mg/mL。正是因为芽胞杆菌的这种高产值,使许多研究者对其分泌表达机理进行了更加深入的研究。基于分子机理的研究,可以通过对其分泌过程中的相关因素,如信号肽、信号肽酶、分子伴侣和蛋白酶基因等进行改造来提升芽胞杆菌对外源蛋白的分泌表达量,特别是对于产量已经较高但市场需求较大的一些蛋白,比如α-淀粉酶。另一重点研究对象是分泌表达量还较低的蛋白,尤其是来源于革兰氏阳性菌和真核生物的外源蛋白。
基因表达是一个复杂的过程,表达系统也是一个复杂的体系。近年来,外源蛋白在芽胞杆菌中分泌表达方面取得很大的进展,已建立了有效的外源蛋白表达系统,但是相比大肠杆菌的表达体系,芽胞杆菌的表达体系相对不成熟,还需要结合不同靶基因的分泌表达差异或通过对同一芽胞杆菌不同的突变体进行基因组重测序寻找关键元件,简化复杂的分泌表达影响因素,使该表达系统适用范围更广,更加方便、高效,以实现实际应用中的“细胞工厂”化。
[1] 刘国红,林乃栓,林营志,等.芽胞杆菌的分类与应用研究进展[J].福建农业学报,2008,23(1):92-99.
[2] Djien K S,Hesseltine C W. Tempe and related foods[J]. Econ. Microbiol, 1979, 4: 116-140.
[3] Oggioni M R,Pozzi G,Valensin P E,etal.. Recurrent septicemia in an immunocompromised patientdue to probiotic strains ofBacillussubtilis[J]. J. Clin. Microbiol., 1998,36(1):325-326.
[4] Schallmey M,Singh A,Ward O P. Developments in the use ofBacillusspecies for industrial production[J]. Can. J. Microbiol.,2004,50(1):1-17.
[5] 王 良.地衣芽胞杆菌的应用现状及展望[J].生物技术世界,2013,(4):172.
[6] 王晓阁.枯草芽胞杆菌的研究进展与展望[J].中山大学研究生学刊:自然科学· 医学版,2012,3:14-22.
[7] Chang S, Cohen S N. High frequency transformation ofBacillussubtilisprotoplasts by plasmid DNA[J]. Mol. Gen. Genet.,1979,168(1):111-115.
[8] Chang S,Gary O,Ho D,etal.. Expression of eukaryotic genes inBacillussubtilisusing signals ofpenP[A]In:Molecular Cloning and Gene Regulation inBacilli[M]. Academic Press,1982,159-169.
[9] Olmos-Soto J,Contreras-Flores R. Genetic system constructed to overproduce and secrete proinsulin inBacillussubtilis[J]. Appl. Microbiol. Biotechnol.,2003,62(4):369-373.
[10] Westers L,Dijkstra D S,Westers H,etal.. Secretion of functional human interleukin-3 fromBacillussubtilis[J]. J. Biotechnol.,2006,123(2):211-224.
[11] Wu S C,Yeung J C,Duan Y J,etal.. Functional production and characterization of a fibrin-specific single-chain antibody fragment fromBacillussubtilis:Effects of molecular chaperones and a wall-bound protease on antibody fragment production[J]. Appl. Environ. Microbiol.,2002,68(7):3261-3269.
[12] Lam K H E,Chow K C,Wong W K R. Construction of an efficientBacillussubtilissystem for extracellular production of heterologous proteins[J]. J. Biotechnol.,1998,63(3):167-177.
[13] Heng C,Chen Z J,Du L X,etal.. Expression and secretion of an acid-stable alpha-amylase gene inBacillussubtilisby SacB promoter and signal peptide[J]. Biotechnol. Lett.,2005,27(21):1731-1736.
[14] Brockmeier U,Wendorff M,Eggert T. Versatile expression and secretion vectors forBacillussubtilis[J]. Curr.Microbiol.,2006,52(2):143-148.
[15] Zhang X Z,Cui Z L,Hong Q,etal.. High-level expression and secretion of methyl parathion hydrolase inBacillussubtilisWB800[J]. Appl. Environ. Microbiol.,2005,71(7):4101-4103.
[16] Guo S,Tang J J,Wei D Z,etal.. Construction of a shuttle vector for protein secretory expression inBacillussubtilisand the application of the mannanase functional heterologous expression[J].J. Microbiol. Biotechnol.,2014,24(4):431-439.
[17] Zhang C,Tao T T,Ying Q,etal.. Extracellular production of lipoxygenase fromAnabaenaspPCC 7120 inBacillussubtilisand its effect on wheat protein[J]. Appl. Microbiol. Biotechnol.,2012,94(4):949-958.
[18] Zhang J J,Kang Z,Ling Z M,etal.. High-level extracellular production of alkaline polygalacturonate lyase inBacillussubtiliswith optimized regulatory elements[J].Bioresour.Technol.,2013,146:543-548.
[19] Hatada Y,Hidaka Y,Nogi Y,etal.. Hyper-production of an isomalto-dextranase of anArthrobactersp. by a proteases-deficientBacillussubtilis: Sequencing,properties,and crystallization of the recombinant enzyme[J].Appl. Microbiol. Biotechnol.,2004,65(5):583-592.
[20] Lu Y P,Lin Q A,Wang J,etal.. Overexpression and characterization inBacillussubtilisof a positionally nonspecific lipase fromProteusvulgaris[J]. J. Ind. Microbiol. Biotechnol.,2010,37(9):919-925.
[21] Tjalsma H,Antelmann H,Jongbloed J D,etal.. Proteomics of protein secretion byBacillussubtilis:Separating the “secrets” of the secretome [J]. Microbiol. Mol. Biol. Rev.,2004,68(2):207-233.
[22] Simonen M, Palva I. Protein secretion inBacillusspecies[J]. Microbiol. Mol. Biol. Rev.,1993,57(1):109-137.
[23] Banerjee S,Hansen J N. Structure and expression of a gene encoding the precursor of subtilin,a small protein antibiotic[J]. J. Biol. Chem.,1988,263(19):9508-9514.
[24] Chung Y S,Breidt F,Dubnau D. Cell surface localization and processing of the ComG proteins,required for DNA binding during transformation ofBacillussubtilis[J]. Mol. Microbiol., 1998,29(3):905-913.
[25] 马 明,杜金华.枯草芽胞杆菌酶在工业生产中的应用[J].山东科学,2006,19(3):35-38.
[26] 王光强. 枯草芽胞杆菌中Sec分泌途径底物特性及非经典分泌途径的研究[D]. 江苏无锡:江南大学,博士毕业论文, 2013.
[27] Tjalsma H,Noback M A,Bron S,etal..Bacillussubtiliscontains four closely related type I signal peptidases with overlapping substrate specificities. Constitutive and temporally controlled expression of differentsipgenes [J]. J. Biol. Chem.,1997,272:25983-25992.
[28] Yamagata H,Adachi T,Tsuboi A,etal.. Cloning and characterization of the 5’region of the cell wall protein gene operon inBacillusbrevis47 [J]. J. Bacteriol.,1987,169(3):1239-1245.
[29] 邓兵兵,熊凌霜.外源蛋白在芽胞杆菌中分泌表达的研究进展[J].生物工程进展,2000,20(5):62-66.
[30] Diderichsen B,Christiansen L.Cloning of a maltogenic alpha-amylase fromBacillusstearothermophilus[J]. FEMS Microbiol. Lett.,1988,56(1):53-59.
[31] Vitikainen M,Pummi T,Airaksinen U,etal.. Quantitation of the capacity of the secretion apparatus and requirement for PrsA in growth and secretion of α-amylase inBacillussubtilis[J]. J. Bacteriol.,2001,183(6): 1881-1890.
[32] Pummi T,Leskelä S,Wahlström E,etal.. ClpXP protease regulates the signal peptide cleavage of secretory preproteins inBacillussubtiliswith a mechanism distinct from that of the Ecs ABC transporter [J]. J. Bacteriol.,2002,184(4):1010-1018.
[33] Wong S L. Advances in the use ofBacillussubtilisfor the expression and secretion of heterologous proteins[J]. Curr. Opin. Bioteehnol.,1995,6(5):517-522.
[34] Endo A,Kurusu Y. Identifaction ofinvivosubtrates of the chaperonin GroEL fromBacillussubtilis[J] . Biosci. Biotechnol. Biochem.,2007,71(4):1073-1077.
[35] Müller J P,Ozegowski J,Vettermann S,etal.. Interaction ofBacillussubtilis CasA with SecA and precursor proteins[J] . Biochem. J.,2000,348(2):367-373.
[36] Kontinen V P,Sarvas M.The PrsA lipoprotein is essential for protein secretion inBacillussubtilisand sets a limit for high-level secretion[J]. Mol. Microbiol.,1993,8(4):727-737.
[37] Lindholm A,Ellmén U,Tolonen-Martikainen M,etal.. Heterologous protein secretion inLactococcuslactisis enhanced by theBacillussubtilischaperone-like protein PrsA [J]. Appl. Microbiol. Biotechnol.,2006,73(4): 904-914.
[38] He X S,Brückner R,Doi R H. The protease genes ofBacillussubtilis[J].Res. Microbiol.,1991,142(7-8):797-803.
[39] Vehmaanperä J,Steinborn G,Hofemeister J. Genetic manipulation ofBacillusamyloliquefaciens[J]. J. Biotechnol.,1991,19(2):221-240.
[40] Stephenson K,Harwood C R.Influence of a cell-wall-associated protease on production of α-amylase byBacillussubtilis[J]. Appl. Environ. Microbiol.,1998,64(8):2875-2881.
[41] Stephenson K,Jensen C L,Jørgensen S T,etal.. The influence of secretory-protein charge on late stages of secretion from the Gram-positive bacteriumBacillussubtilis[J]. Biochem. J.,2000,350:31-39.
[42] Stephenson K,Jensen C L,Jørgensen S T,etal.. Simultaneous inactivation of thewprAanddltBgenes ofBacillussubtilisreduces the yield of α-amylase[J]. Lett. Appl. Microbiol.,2002,34(6):394-397.
[43] Suthar D H,Chattoo B B.Expression ofVitreoscillahemoglobin enhances growth and levels of α-amylase inSchwanniomycesoccidentalis[J].Appl. Microbiol. Biotechnol.,2006,72(1):94-102.
[44] Kallio P T,Bailey J E. Intracellular expression ofVitreoscillahemoglobin (VHb) enhances total protein secretion and improves the production of α-amylase and neutral protease inBacillussubtilis[J]. Biotechnol. Prog.,1996,12(1): 31-39.
[45] Narula J,Devi S N,Fujita M,etal.. Ultrasensitivity of theBacillussubtilissporulation decision[J]. Proc. Natl. Acad. Sci. USA,2012,109(50):3513-3522.
[46] Kang Z,Yang S,Du GC,etal.. Molecular engineering of secretory machinery components for high-level secretion of proteins inBacillusspecies[J]. J. Ind. Microbiol. Biotechnol.,2014,41(11):1599-1607.
