转GmTMT2a基因玉米抗旱功能分析
2015-02-02王晓萍
张 靓, 张 兰, 王晓萍
1.哈尔滨师范大学生命科学与技术学院, 哈尔滨 150025;2.中国农业科学院生物技术研究所, 北京 100081
维生素E,又称为生育酚,是一种脂溶性分子,它分为生育酚和三烯生育酚两种;根据芳香环上甲基的数量以及其在环上的位置不同,又分别有四种不同的组分,即α-,β-,γ-,δ-生育酚和α-,β-,γ-,δ-三烯生育酚。其中α-生育酚的活性最高且是人及动物最好吸收的。生育酚只能由植物和光合藻类合成。高等植物的种子、根、茎、叶、块茎、下胚轴、子叶等部位均已发现生育酚的存在,但不同部位的含量和组成不同[1~3]。α-生育酚通常是光合组织中的主要形式,γ-生育酚在种子中的含量最高。种子中生育酚的含量通常是叶片中的10~20倍[4]。
植物已经进化出多种机制来对抗活性氧,如超氧化物歧化酶、过氧化氢酶、过氧化物酶和脂溶性的抗氧化剂,主要有生育酚和类胡萝卜素[5]。在植物抗氧化功能方面,生育酚能够有效地淬灭单线态氧,清除各种自由基尤其是脂质过氧化自由基,从而终止脂质过氧化链式反应[6~8]。植物的有氧代谢不断产生活性氧,包括单线态氧、超氧化物、过氧化氢、羟自由基和脂质过氧化物,这是在生物胁迫和非生物胁迫中普遍产生的共同特性。过量活性氧的积累会对各种细胞器、质膜以及核酸、蛋白质等大分子造成损伤,最终导致细胞死亡[9]。为了防止这种现象,一个未知的信号转导机制会引发多个针对抗氧化剂活性和代谢调整的基因的表达,维持活性氧浓度的稳定。
为了提高植物的抗氧化能力,本课题组将来自大豆的维生素E合成关键酶基因GmTMT2a转化到玉米中,获得了α-生育酚含量显著提高的转基因玉米株系[10],本研究对该提高玉米株系的抗氧化能力及其分子机制进行了初步的分析。
1 材料和方法
1.1 实验材料
转GmTMT2a基因玉米(transgenic plant,TP)由本实验室创制[10],对照材料郑58(wild type,WT)为本实验室保存。
本研究中使用的普通化学试剂购自国药集团化学试剂有限公司;Trizol试剂购自Invitrogen公司(美国);反转录试剂盒5×All in one RT Master Mix购自ABM公司(加拿大);实时定量2×qRT PCR Mix购自TOYOBO公司(日本)。
1.2 方法
1.2.1生长条件和处理方法 种子播种于盛有蛭石的花盆中,温室中正常生长。每盆播种4粒,待苗长至3叶期停止浇水,停水一周和两周时取样测定,设三组重复。
1.2.2H2O2含量测定 取0.5 g叶片研磨,加5 mL 0.1%(W/V)三氯乙酸,混匀离心12 000 g,15 min,取5 mL上清加入0.5 mL 1 mol/L磷酸钾缓冲液(pH 7.0),1 mL 1 mol/L 碘化钾,混匀后测390 nm吸光值。
H2O2(μmol/g Fw)=1+227.8×OD390[11]
1.2.3酶活性测定 粗酶液的提取:取0.5 g叶片于预冷的研钵中, 加5 mL预冷的0.05 mol/L PBS(pH 7.8)在冰浴上研磨成匀浆, 在4℃,10 000 r/min下, 离心20 min, 分离上清液, 4℃下保存备用。该上清液即为酶提取液[12]。
超氧化物歧化酶(SOD)活性测定:按邹琦[13]的方法测定。取酶液0.05 mL 加入2.95 mL反应液(0.05 mmol/L PBS1.5 mL,130 mmol/L Met 0.3 mL, 750 mmol/L NBT 0.3 mL, 100 μmol/L EDTA-Na20.3 mL, 20 μmol/L 核黄素0.3 mL, 蒸馏水0.25 mL), 在4 000 lx日光下反应20 min, 在560 nm下测定光密度SOD活性单位以抑制NBT光化还原的50%为一个酶活性单位。
过氧化氢酶(CAT)活性测定:按李合生[13]的方法测定。取酶液0.1 mL加入2.9 mL反应液(pH 7.0 Tris-HCl 1.0 mL,200 mmol/L H2O20.2 mL, 蒸馏水1.7 mL)在240 nm下测定吸光度, 每隔1 min读数一次, 共测4 min。1 min内A240减少0.1的酶量为1个酶活单位(U)。
过氧化物酶(POD)活性测定:按李合生[14]的方法测定。取酶液1 mL加入0.1%愈创木酚1 mL, 蒸馏水6.9 mL, 摇匀, 最后加入0.18% H2O21.0 mL,25℃反应10 min, 加入5%偏磷酸0.1 mL, 终止反应, 并在470 nm下比色。
结果计算:以每分钟吸光度变化值表示酶活性大小,即以△A470/[min·g(鲜重)]表示,也可以用每min内A470变化0.01为1个过氧化物酶活性单位(U)表示。
过氧化物酶活性[U/(g·min)]=△A470×VT/(w×VS×0.01×t)
式中:△A470:反应时间内吸光度的变化。w:植物鲜重(g)。VT:提取酶液总体积(mL)。Vs:测定时取用酶液体积(mL)。t:反应时间(min)。
1.2.4抗旱基因表达量的变化 选取三种抗旱基因P5CS、P5CR和TPS。P5CS、P5CR分别是吡咯啉-5-羧酸合成酶、吡咯啉-5-羧酸还原酶,植物中P5CS对干早胁迫下的脯氨酸合成起主要作用。TPS是海藻糖-6-磷酸合酶,海藻糖广泛存在于动物、植物和微生物中,当细胞处于逆境时,胞内海藻糖含量迅速上升,能稳定蛋白质、核酸等生物大分子的结构,起保护剂的作用。以玉米actin1基因作为内参。应用Primer 5设计引物,进行实时定量PCR分析(qRT-PCR)。引物序列见表1。
2 结果与分析
2.1 H2O2含量变化
在正常生长条件下,TP和WT植株的H2O2含量无明显差异,干旱处理后,TP和WT植株的H2O2含量均有所增加,但TP植株增加至正常情况下的1.2倍;而WT植株增加至约1.8倍(图1),表明α-生育酚含量提高的TP植株在逆境条件下清除活性氧的能力高于WT植株。

表1 PCR扩增引物Table 1 Sequence of primers for PCR amplification.
2.2 抗氧化酶活性变化
为了分析转基因玉米中α-生育酚的提高对体内的抗氧化酶类活性的影响,分别对SOD、POD和CAT的酶活进行了测定(图2)。在正常生长情况下,TP和WT植株中的SOD、POD和CAT的酶活性都相对较低,而且无显著差异;在干旱处理以后,SOD的活性没有显著变化;POD的酶活性无论是在TP植株还是WT植株中,其增幅都约为42%。CAT酶活性增幅最大,WT植株中提高了350%,TP植株中提高了467%,而且两者达到了极显著差异,这也与上述转基因植株中H2O2含量较低相一致,CAT酶活性提高,H2O2含量降低。推测逆境条件下α-生育酚的提高能够促进CAT的表达。

图1 干旱处理条件下H2O2含量测定Fig.1 Analysis of H2O2 content under drought stress.
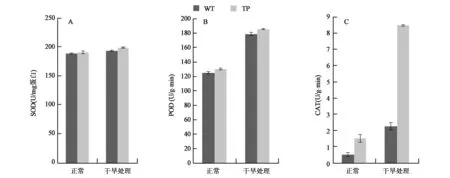
图2 干旱处理条件下SOD(A)、POD(B)、CAT(C)酶活性测定Fig.2 Enzyme activity of SOD(A), POD(B), CAT(C) under drought stress.
2.3 抗旱基因的qRT-PCR结果
为了分析其他抗旱基因在转基因植株中是否受到α-生育酚提高的影响,对其中的3个基因的表达进行了分析(图3)。结果表明,经过两周的干旱处理,无论是TP植株还是WT植株中,三个基因均是先下调表达,再上调表达。P5CS基因在处理一周后,在WT植株和TP植株中的表达量分别变为处理前的58%和45%,而在处理两周后表达量则分别上升为处理前的1.4倍和1.6倍,在转基因和野生型玉米之间没有显著性变化。P5CR基因在处理一周后,在WT植株和TP植株中的表达量分别变为处理前的68%和44%,处理两周后表达量则为处理前的1.6倍和2.6倍。TPS基因在处理一周后,在WT植株和TP植株中的表达量分别变为处理前的29%和27%,处理两周后的表达量分别为处理前的2.2倍和4.1倍。结果表明在干旱条件下α-生育酚的提高能够促进P5CR和TPS基因的表达。

图3 干旱处理条件下逆境相关基因的表达分析Fig.3 Expression analysis of drought-tolerance genes under drought stress.A:P5CS; B:P5CR; C:TPS
3 讨论
植物在干旱等非生物逆境条件下会产生大量的活性氧,导致氧化逆境,为此植物进化形成了多个抗氧化逆境的机制,包括抗氧化酶类以及抗氧化小分子物质如维生素E、维生素C和谷胱甘肽等,生育酚是其中一种有效地抗氧化分子。它可以淬灭单线态氧,清除各种自由基。在生育酚的四种形式中,α-生育酚是抗脂质过氧化最有效的组分。Collakova等[15]通过提高拟南芥中的生育酚含量提高了植株对强光及高温低温等的耐受性。2010年,Yusuf等[16]通过提高芥菜中的α-生育酚提高了植株对高盐和重金属的耐受性。2015年,Bimal等[17]通过提高紫苏中的α-生育酚提高了植株的抗氧化活性。本研究表明,过表达GmTMT2a提高了玉米α-生育酚含量,同时其抗氧化能力得到了明显提高。
为了进一步探讨干旱条件下转基因玉米H2O2降低的分子机制,对抗氧化相关的酶类 SOD、POD和CAT的酶活性进行了测定,其中只有CAT在转基因玉米中的表达提高最为显著,而CAT可以分解H2O2;此外干旱条件下在转基因玉米中抗渗透胁迫相关的基因PC5S和TPS的表达也有显著提高。综合上述结果,推测α-生育酚对植株抗逆性的影响包括两方面:一是α-生育酚的提高能够促进CAT的表达,进而导致过氧化氢含量的下降,表现为植物抗氧化能力的增强;另一方面是α-生育酚的提高促进了一些渗透胁迫相关基因的表达,从而提高了植株的抗渗透胁迫能力,抗逆性增强。至于α-生育酚如何促进抗逆相关基因CAT、PC5S和TPS的表达还有待进一步研究。
[1] DellaPenna D. A decade of progress in understanding vitamin E synthesis in plants[J]. J. Plant Physiol., 2005, 162: 729-737.
[2] Horvath G, Wessjohann L, Bigirimana J. Differential distribution of tocopherols and tocotrienols in photosynthetic and non-photosynthetic tissues[J]. Phytochemistry,2006, 67:1185-1195.
[3] Munne-Bosch S, Alegre L. The functions of tocopherols and tocotrienols in plants[J]. Crit. Rev. Plant Sci.,2002,21 :31-57.
[4] Cahoon E B, Hall S E, Ripp K G. Metabolic redesign of vitamin E biosynthesis in plants for tocotrienol production and increased antioxidant content[J]. Nat. Biotechnol., 2003,21:1082-1087.
[5] Mittler R. Oxidative stress, antioxidants and stress tolerance[J]. Trends Plant Sci.,2002,7:405-410.
[6] Liebler D C, Burr J A. Oxidation of vitamin E during ironcatalyzed lipid peroxidation—evidence for electron-transfer reactions of the tocopheroxyl radical[J]. Biochemistry,1992, 31: 8278-8284.
[7] Bramley P M, Elmadfa I, Kafatos A. Vitamin E[J]. J. Sci. Food Agric., 2000, 80:913-938.
[8] Schneider C. Chemistry and biology of vitamin E[J].Mol. Nutr. Food Res.,2005,49:7-30.
[9] Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction[J]. Ann. Rev. Plant Biol.,2004,55:373-399.
[10] Zhang L, Luo Y, Zhu Y. GmTMT2a from soybean elevates the alpha-tocopherol content in corn andArabidopsis[J]. Transgenic Res.,2013,22:1021-1028.
[11] Velikova V, Edreva A, Loreto F. Endogenous isoprene protectsPhragmitesaustralisleaves against singlet oxygen[J]. Physiol. Plant, 2004,122:219-225.
[12] 李合生.植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2000,164-169.
[13] 邹 琦.植物生理学[M].北京:中国农业出版社,2000,163-166.
[14] 李合生,陈翠莲, 等.植物生理生化实验原理和技术[M]. 武汉:华中农业大学出版社, 1998:136-137.
[15] Collakova E, DellaPenna D. The role of homogentisate phytyltransferase and other tocopherol pathway enzymes in the regulation of tocopherol synthesis during abiotic stress[J].Plant Physiol.,2003, 133:930-940.
[16] Yusuf M A,Kumar D, Rajwanshi R. Overexpression of gamma-tocopherol methyl transferase gene in transgenicBrassicajunceaplants alleviates abiotic stress:physiological and chlorophyll a fluorescence measurements[J].Biochim. Biophys. Acta,2010,1797:1428-1438.
[17] Bimal K G, Eun S S, Chan O L. Improved antioxidant activity in transgenicPerillafrutescensplants via overexpression of the γ-tocopherol methyltransferase (γ-tmt) gene[J]. Protoplasma,2015,doi 10.1007/s00709-015-0760-2.
