Toll样受体1基因多态性与胃癌癌前病变的相关性研究
2015-02-02李静,王晓燕,崔艳欣等
Toll样受体1基因多态性与胃癌癌前病变的相关性研究
李静1王晓燕2崔艳欣1姜相君1*
青岛大学医学院附属青岛市市立医院消化内二科1(266000)国际门诊2

背景:大量研究表明,肠化生、异型增生为胃癌的癌前病变。Toll样受体1(TLR1)基因多态性与多种疾病的发生相关,但与胃癌癌前病变关系的研究少见。目的:探讨TLR1基因rs4833095位点多态性与胃癌癌前病变的相关性。方法:选取2008年12月—2014年12月青岛市市立医院432例胃癌癌前病变患者(包括上皮内瘤变84例、肠化生348例),同时以540名健康志愿者作为对照。采用DNA测序法检测TLR1基因rs4833095位点基因型,评估幽门螺杆菌(Hp)感染状态。以多因素Logistic回归模型分析TLR1基因多态性与胃癌癌前病变的关系。结果:病例组TLR1基因rs4833095位点GG、GA、AA基因型频率与对照组相比差异有统计学意义(χ2=19.966,P=0.000),病例组AA基因型频率明显高于对照组(17.6%对8.9%;χ2=16.336,P=0.000)。多因素Logistic回归分析显示,与GG基因型相比,携带AA基因型者胃癌癌前病变的发病风险明显增加(OR=1.329,95%CI:1.002~1.762)。与GG+GA基因型且未感染Hp的患者相比,携带AA基因型并感染Hp者发生胃癌癌前病变的风险明显增加(OR=3.617,95%CI:2.147~6.092)。结论:TLR1 rs4833095基因多态性与胃癌癌前病变发病风险呈正相关。
关键词Toll样受体1;基因多态性;胃肿瘤;癌前状态
肠化生、异型增生为胃癌的癌前病变,其病因、发病机制尚不明确,目前已知幽门螺杆菌(Hp)感染和个体遗传因素等在其中起重要作用[1-3]。Toll样受体(Toll-like receptor, TLR)是参与非特异性免疫的一类重要蛋白质分子,亦是连接非特异性免疫与特异性免疫的桥梁。研究发现,TLR1基因多态性可能与Hp的发病风险相关[4]。TLR1基因多态性还与前列腺癌、儿童IgA肾病、子宫内膜炎、妊娠期疟疾等疾病的发病风险相关[5-8]。但目前关于TLR1基因多态性与胃癌癌前病变关系的研究少见。本研究通过直接测序法检测TLR1 rs4388095位点基因型,旨在探讨其多态性与胃癌癌前病变的关系,从而为阐明胃癌癌前病变的遗传机制提供依据。
对象与方法
一、研究对象
收集2008年12月—2014年12月青岛市市立医院消化科就诊的胃癌癌前病变患者432例,均经胃镜和组织病理学确诊。其中男196例,女236例;年龄26~50岁,平均41岁;上皮内瘤变84例,肠化生348例。取同期行胃镜和组织病理学检查正常者540名作为对照组,其中男272名,女268名;年龄18~50岁,平均38岁。
两组受试者均为无血缘关系的山东省汉族人,检查前2周未服用过抗菌药物、铋剂、质子泵抑制剂、非甾体消炎药。两组受试者的性别、年龄差异无统计学意义(P>0.05),病例组吸烟状况(33.3%对27.2%;χ2=4.273,P=0.039)、Hp感染率(50.0% 对32.6%;χ2=30.220,P=0.000)显著高于对照组。本研究方案经青岛大学临床学院伦理委员会批准,研究对象均取得知情同意。
二、方法
1. DNA提取:取30 mg胃窦组织,用基因组DNA提取试剂盒[离心柱型,天根生化科技(北京)有限公司]提取受检者DNA,Bioteke超微量紫外可见分光光度计(ND5000)检测DNA浓度,并将其稀释至5 ng/μL。
2. 基因型分析:PCR引物序列见参考Hamann等[8]的研究,由上海英潍捷基公司合成。PCR反应体系总体积20 μL,含10 μmol/L上、下游引物各0.5 μL,Power Taq PCR MasterMix(北京百泰克生物技术有限公司)10 μL,DNA模板2 μL,去离子水7 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃ 终末循环10 min。取4 μL PCR产物,行1.5%琼脂糖凝胶电泳。由上海英潍捷基公司采用ABI 3730测序仪对PCR产物进行测序。测序结果分析:采用Chroms 1.62软件读取测序峰图,GA基因型可见GA双峰,GG或AA基因型表现为单一的G或A峰。读取结果后,用DNAMAN 6.0软件进行分析。
3. Hp感染状态检测:根据《第四次全国幽门螺杆菌感染处理共识报告》[9],采用胃黏膜组织快速尿素酶试验(试剂盒购自杭州依灵生物工程有限公司)判定Hp感染。
三、统计学分析
采用SPSS 17.0统计软件,计算各组基因型频率。采用χ2检验行Hardy-Weinberg平衡遗传检验。采用Pearsonχ2检验比较性别、年龄(按年龄中位数分组)、Hp感染和吸烟状况以及各基因型在病例组与对照组中的差异。以非条件Logistic回归模型调整混杂因素,分析基因型与胃癌癌前病变的关系以及基因多态性与Hp感染的交互作用,P<0.05为差异有统计学意义。
结果
一、基因型鉴别
PCR扩增后所得的目的片段长度为347 bp,测序后得到3种基因型,即GG纯合型、GA杂合型和AA纯合型(图1)。总体、病例组和对照组TLR1 rs4833095基因型分布符合Hardy-Weinberg平衡,具有群体代表性(表1)。
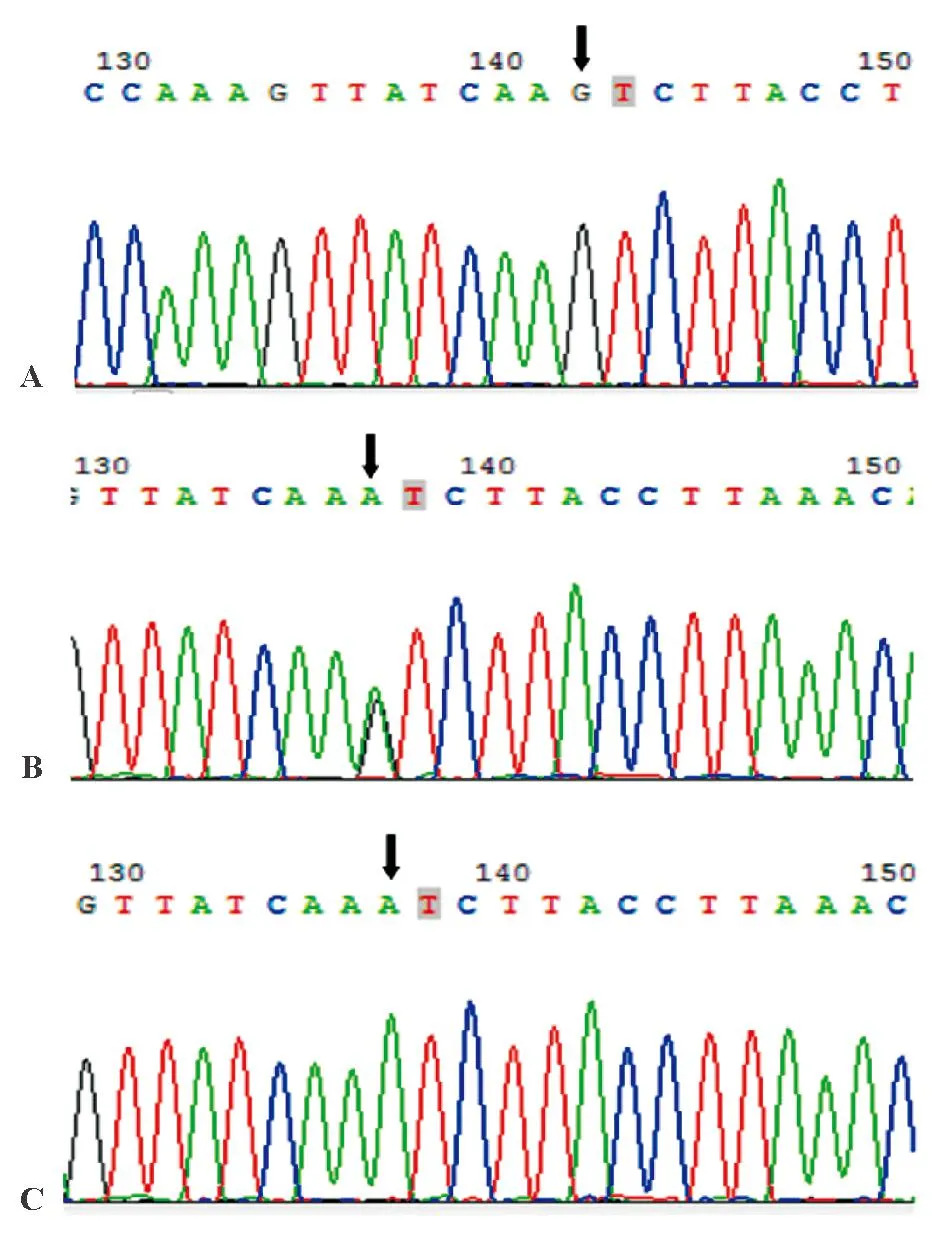
A:GG型;B:GA型;C:AA型

基因型总体(n=972)病例组(n=432)对照组(n=540)GG396(40.7)180(41.7)216(40.0)GA452(46.5)176(40.7)276(51.1)AA124(12.8)76(17.6)48(8.9)χ2值0.0393.9094.826P值0.9810.1420.090
二、TLR1 rs4833095 基因多态性与胃癌癌前病变的相关性
病例组TLR1 rs4833095 基因型分布与对照组相比差异有统计学意义(χ2=19.966,P=0.000),进一步分析发现病例组AA基因型频率明显高于对照组(17.6%对8.9%;χ2=16.336,P=0.000)。与携带GG基因型者相比,携带AA基因型者胃癌癌前病变的发病风险明显增加(OR=1.329,95%CI:1.002~1.762),而携带GA基因型者胃癌癌前病变的发病风险无明显增加(OR=0.812,95%CI:0.523~1.260)。
三、各基因型分布与Hp感染的相关性
Hp阳性组AA基因型频率为18.4%(72/392),明显高于Hp阴性组的9.0%(52/580),组间差异有统计学意义(χ2=37.156,P=0.000);而Hp阳性组GA+GG基因型频率为81.6%(320/392),Hp阴性组为91.0%(528/580),组间差异无统计学意义(P>0.05)。
以Hp阴性且携带GG+GA基因型者为参照,单独携带AA基因型(OR=2.110,95%CI:1.189~3.744)或单独感染Hp(OR=1.999,95%CI:1.507~2.625)者胃癌癌前病变的发病风险增加,而Hp感染阳性且携带AA基因型者胃癌发病风险进一步增加(OR=3.617,95%CI:2.147~6.092)(表2)。
表2Hp感染与TLR1 rs4833095位点多态性联合作用对胃癌癌前病变的影响n(%)

组 别例数Hp阴性GG+GAAAHp阳性GG+GAAA病例组432188(43.5)28(6.5)168(38.9)48(11.1)对照组540340(63.0)24(4.4)152(28.2)24(4.4)
讨论
TLR是Ⅰ型跨膜蛋白受体,可识别来源于微生物的具有保守结构的分子,即病原相关分子模式,对天然和获得性免疫进行调控[10]。当微生物突破物理屏障,如皮肤、黏膜等时,TLR可识别并激活机体产生免疫细胞应答,维持机体免疫系统稳态[11]。TLR1作为单体存在时没有活性,可与TLR2相互作用,形成异二聚体,识别细菌上的抗原,如革兰阴性菌的脂磷壁酸(LTA)和革兰阳性菌的肽聚糖,还能识别内源性分子(如热休克蛋白)以及病毒表面成分等,诱导产生多种细胞因子,参与机体的炎症和相关免疫反应[12]。
TLR1基因位于染色体4p14,长度约8 537 bp,包含4个外显子,其中rs4833095位于第4外显子,突变后编码的氨基酸由丝氨酸(Ser)变成天冬酰胺(Asn)。本研究发现,TLR1 rs4833095位点多态性与胃癌癌前病变风险密切相关,病例组AA基因型频率明显高于对照组。王正强等[4]对200例Hp阳性和200例Hp阴性患者TLR1 rs4833095位点基因型与Hp感染的关系进行研究,结果显示该基因多态性可影响Hp易感性,AA基因型可能是患者感染Hp的易感因素。Yang等[13]的研究发现,非功能性TLR1 602S/S基因型可能通过减少Th1细胞反应,降低Hp相关胃病的发病风险。因此,有必要进一步研究该基因其他潜在功能性多态性位点,分析各基因多态性位点的相互关系以及与胃癌癌前病变风险的关系。
TLR1 rs4833095基因AA型导致胃癌癌前病变风险增加的可能机制是由于Ser248Asn氨基酸替换位置紧邻TLR1配体结合点和二聚体结合位点,使TLR1-TLR2功能改变,无法识别Hp,钝化宿主对Hp的炎症反应,以便于Hp的定植[14]。小鼠模型研究证明,TLR2、TLR8、TLR9通过树突细胞参与Hp的识别,仅TLR2是惟一的细胞表面受体/配体系统,能引发明显抗炎应答[15-16]。TLR2、TLR4还与Hp的某些致病机制有关[17-18]。TLR1-TLR2可识别革兰阴性菌包膜上的三酰基脂肽。Hp脂质A由三酰基脂肽构成,这使其成为TLR1-TLR2的理想配体[19]。因此,TLR1为Hp最可能的受体,在识别Hp引发的炎症中发挥重要作用。本研究进一步分析了Hp与该基因多态性的联合效应,结果显示携带AA基因型且Hp阳性的胃癌癌前病变发病风险明显增高,提示遗传因素与环境因素可能存在联合作用。
总之,本研究显示TLR1基因rs4833095位点多态性与胃癌癌前病变的发病风险密切相关,AA纯合子与胃癌癌前病变易感有关,并与Hp感染存在联合效应,共同影响胃癌癌前病变的发病风险。但由于样本量较小,今后应扩大样本量进一步研究。此外,研究发现TLR家族其他基因(如TLR2、TLR4和TLR5等)多态性可能与胃癌癌前病变发生相关[2,20]。因此,有必要在今后的工作中进一步深入开展中国人群基因多态性筛选,研究TLR家族其他基因多态性的分布和频率,系统评价TLR基因多态性与胃癌癌前病变的关系。
参考文献
1 Achyut BR, Ghoshal UC, Moorchung N, et al. Association of Toll-like receptor-4 (AsP299Gly and Thr399Ileu) gene polymorphisms with gastritis and precancerous lesions[J]. Hum Immunol, 2007, 68 (11): 901-907.
2 Fan YF, Wu YM, Liu H, et al. TLR4 polymorphisms associated with developing gastric pre-cancer lesions in a Chinese Han population[J]. Hum Immunol, 2014, 75 (2): 176-181.
3 Hold GL, Rabkin CS, Chow WH, et al. A functional polymorphism of toll-like receptor 4 gene increases risk of gastric carcinoma and its precursors[J]. Gastroenterology, 2007, 132 (3): 905-912.
4 王正强, 于新娟, 王莉莉, 等. Toll受体-1基因多态性与幽门螺杆菌易感性的关系[J]. 实用医学杂志, 2014, 30 (1): 102-104.
5 Stevens VL, Hsing AW, Talbot JT, et al. Genetic variation in the toll-like receptor gene cluster (TLR10-TLR1-TLR6) and prostate cancer risk[J]. Int J Cancer, 2008, 123 (11): 2644-2650.
6 Lee JS, Park HK, Suh JS, et al. Toll-like receptor 1 gene polymorphisms in childhood IgA nephropathy: a case-control study in the Korean population[J]. Int J Immunogenet, 2011, 38 (2): 133-138.
7 Taylor BD, Darville T, Ferrell RE, et al. Racial variation in toll-like receptor variants among women with pelvic inflammatory disease[J]. J Infect Dis, 2013, 207 (6): 940-946.
8 Hamann L, Bedu-Addo G, Eggehe TA, et al. The toll-like receptor 1 variant S248N influences placental malaria[J]. Infect Genet Evol, 2010, 10 (6): 785-789.
9 刘文忠, 谢勇, 成虹, 等. 第四次全国幽门螺杆菌感染处理共识报告[J]. 胃肠病学, 2012, 17 (10): 618-625.
10Akira S, Takeda K, Kaisho T. Toll-like receptors: critical proteins linking innate and acquired immunity[J]. Nat Immunol, 2001, 2 (8): 675-680.
11Medzhitov R, Preston Hurlburt P, Janeway CA Jr, et al. A human homologue of the drosophila Toll protein signals activation of adaptive immunity[J]. Nature, 1997, 388 (6640): 394-397.
12Kang SS, Kauls LS, GasPari AA. Toll-like receptors: applications to dermatologic disease[J]. J Am Acad Dermatol, 2006, 54 (6): 951-983.
13Yang CA, Scheibenbogen C, Bauer S, et al. A frequent Toll-like receptor 1 gene polymorphism affects NK- and T-cell IFN-γ production and is associated withHelicobacterpylori-induced gastric disease[J]. Helicobacter, 2013, 18 (1): 13-21.
14Guan Y, Omueti-Ayoade K, Mutha SK, et al. Identification of novel synthetic toll-like receptor 2 agonists by high throughput screening[J]. J Biol Chem, 2010, 285 (31): 23755-23762.
15Rad R, Ballhoru W, Voland P, et al. Extracellular and intracellular pattern recognition receptors cooperate in the recognition ofHelicobacterpylori[J]. Gastroenterology, 2009, 136 (7): 2247-2257.
16Rad R, Brenner L, Krug A, et al. Toll-like receptor-dependent activation of antigen-presenting cells affects adaptive immunity toHelicobacterpylori[J]. Gastroenterology, 2007, 133 (1): 150-163.
17刘翔, 林漫鹏, 吕建忠, 等.TLR2、TLR4、TLR5和TLR9在小鼠HP感染模型中的表达[J]. 实用医学杂志, 2011, 27 (13): 2327-2329.
18刘翔, 丁元伟, 林虹. Toll样受体4通路在幽门螺杆菌致病机制中的作用[J]. 实用医学杂志, 2012, 28 (19): 3174-3177.
19Suda Y, Ogawa T, Kashihara W, et al. Chemical structure of lipid A fromHelicobacterpyloristrain 206-1 lipopoly-saccharide[J]. J Biochem, 1997, 121 (6): 1129-1133.
20Zeng HM, Pan KF, Zhang Y, et al. Genetic variants of toll-like receptor 2 and 5,helicobacterpyloriinfection, and risk of gastric cancer and its precursors in a chinese population[J]. Cancer Epidemiol Biomarkers Prev, 2011, 20 (12): 2594-2602.
(2015-05-15收稿;2015-08-01修回)
Relationship of Toll-like Receptor 1 Gene Polymorphism with Gastric Precancerous LesionsLIJing1,WANGXiaoyan2,CUIYanxin1,JIANGXiangjun1.1DepartmentofGastroenterologyⅡ,2InternationalClinic,QingdaoMunicipalHospital,QingdaoUniversityMedicalCollege,Qingdao,ShandongProvince(266000)
Correspondence to: JIANG Xiangjun, Email: drjxj@163.com
Background: Intestinal metaplasia and intraepithelial neoplasia are precancerous lesions of gastric cancer. Toll-like receptor 1 (TLR1) gene polymorphism is related with many diseases, however, only few studies have been performed on its relationship with gastric precancerous lesions. Aims: To investigate the relationship between TLR1 rs4833095 polymorphism and gastric precancerous lesions. Methods: A total of 432 patients with gastric precancerous lesions (including 84 intraepithelial neoplasia, 348 intestinal metaplasia) from Dec. 2008 to Dec. 2014 at Qingdao Municipal Hospital were enrolled, and 540 healthy subjects were served as controls. TLR1 rs4833095 polymorphism was determined by DNA sequencing, andHelicobacterpylori(Hp) infection was detected. Relationship of TLR1 gene polymorphism with gastric precancerous lesions was analyzed by multiple Logistic regression model. Results: Significant differences in the frequencies of GG, GA and AA genotype on TLR1 rs4833095 were found between disease group and control group (χ2=19.966,P=0.000).The frequency of AA genotype in disease group was significant higher than that in control group (17.6%vs. 8.9%; χ2=16.336,P=0.000). Compared with GG genotype, patients with AA genotype were obviously more susceptible to gastric precancerous lesions (OR=1.329, 95%CI: 1.002-1.762). Compared with GG+GA genotypes with negative Hp, patients with AA genotype and positive Hp infection had much higher susceptibility to gastric precancerous lesions (OR=3.617, 95%CI: 2.147-6.092). Conclusions: TLR1 rs4833095 polymorphism is positively associated with susceptibility to gastric precancerous lesions.
Key wordsToll-Like Receptor 1;Gene Polymorphism;Stomach Neoplasms;Precancerous Conditions
通信作者*本文,Email: drjxj@163.com
DOI:10.3969/j.issn.1008-7125.2015.12.006
