大鼠肝缺血再灌注后肺细胞凋亡及七氟醚对细胞凋亡及NF-κBp65的影响
2015-02-01管小萌徐桂萍王晓丽
管小萌,徐桂萍,王晓丽
(1.新疆医科大学研究生学院;2.新疆维吾尔自治区人民医院麻醉科,新疆 乌鲁木齐 830000)
大鼠肝缺血再灌注后肺细胞凋亡及七氟醚对细胞凋亡及NF-κBp65的影响
管小萌1,徐桂萍2,王晓丽1
(1.新疆医科大学研究生学院;2.新疆维吾尔自治区人民医院麻醉科,新疆 乌鲁木齐830000)
摘要:目的探讨七氟醚预处理对大鼠肝缺血再灌注后肺细胞凋亡的影响。方法24只 Wister大鼠随机分为3组(n=8):假手术组,缺血再灌注组,七氟醚组,阻断肝门30 min后建立大鼠70%肝缺血再灌注模型。假手术组(S组)仅游离肝门,但不阻断;肝缺血再灌注组(IR组)采用阻断肝门30 min,再灌注1 h的方法制备大鼠肝缺血再灌注损伤模型;七氟醚预处理组(SP组)吸入2.1%七氟醚30 min,停止吸入10 min后制备肝缺血再灌注模型。于再灌注1 h时处死动物,留取肺组织, 测定湿/干重比(W/D比),采用比色法检测超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量,采用原位末端转移酶法(TUNEL)检测细胞凋亡,计算细胞凋亡指数(AI),采用Western blot法测定核蛋白NF-κBp65 表达,光镜下观察肺组织病理学结果。结果与S组比较,IR组和SP组再灌注各时点肺组织W/D比值、细胞凋亡指数(AI)和NF-κB 活性水平及MDA含量均显著增高(均P<0.05);SOD活性显著降低(P<0.05);与IR组比较,SP组W/D比值、细胞凋亡指数(AI)、NF-κB表达水平与MDA含量显著降低(均P<0.05);而SOD活性显著增加(P<0.05);SP组肺组织损伤较IR组减轻。结论细胞凋亡可能在肝缺血再灌注肺损伤发生过程中具有重要意义;七氟醚对大鼠肝缺血再灌注后肺细胞凋亡具有抑制作用,其作用机制可能通过降低肺组织NF-κB的活性,从而清除自由基、抑制脂质过氧化有关。
关键词:七氟醚;细胞凋亡;缺血再灌注
急性呼吸窘迫综合征(ARDS)引起的的急性肺损伤(ALI)越来越受到临床医师的广泛重视,它可产生于肝病、肾病及肠道病变等多种原因。临床上直接性肝脏的创伤如创伤性休克以及间接性肝脏创伤如外科手术均会引起肝脏缺血再灌注(IR)这个病理生理过程,在发生这个过程时会导致远隔脏器之一肺脏损伤,进而导致肺脏功能下降[1]。在此过程中细胞会发生一种主动地死亡,叫做细胞凋亡,这个过程中机体自主的清除了死亡衰老及异常的细胞,进而维持机体正常的稳态。NF-κB作为一种核转录因子具有两种亚单位p50/p65,其正常情况下是无活性的,应激、创伤下均会使其激活。七氟醚是一种具有麻醉诱导迅速,维持平稳,易于掌握,苏醒快速完全的麻醉药,故其在临床上已得到了广泛的应用,本实验拟通过建立大鼠模型,以及应用吸入麻醉药物七氟醚后,观察在体肺细胞凋亡情况,以及此麻醉药物在其中发挥的作用及其可能机制,并为以后的临床麻醉提供可靠的依据。
1材料
1.1动物选用由新疆医科大学实验动物中心提供的健康雄性Wister大鼠24只(SPF级),体重300~350 g,动物使用许可证编号:SYXK(新)2011-0001。标准环境术前适应性喂养1周。
1.2药品七氟醚(商品名:喜保福宁,每瓶250 mL,丸石制药株式会社,批号:1610)。
1.3主要试剂戊巴比妥钠粉剂(购自南昌东湖强生公司),4%中性甲醛溶液,丙二醛(MDA),超氧化物歧化酶(SOD)试剂盒,原位末端转移酶法(TUNEL)试剂盒,BCA蛋白分析试剂盒(购自南京建成生物工程研究所)。
1.4主要仪器小动物呼吸机(成都泰盟科技有限公司),70℃电热恒温鼓风干燥箱(DHG-9123型上海精宏实验设备有限公司),凝胶图像分析系统(Bio—Rad公司,美国)。
2方法
2.1动物分组采用随机数字表法,将实验大鼠分为3组,每组8只:假手术组(S组)、肝缺血再灌注组(IR组)和七氟醚预处理组(SP组)。
2.2动物模型制备及给药实验前,大鼠禁食12 h,自由饮水。参照文献[2]的方法建立70%肝缺血再灌注模型。选用2%戊巴比妥钠80 mg·kg-1进行腹腔注射麻醉后固定于定鼠板,气管切开插管,连接小动物呼吸机行机械通气,通气频率每分钟60~65次,潮气量10~15 mL·kg-1, 呼吸比1.0︰1.5。30 min后对实验大鼠腹部脱毛并碘伏消毒。实验过程中,大鼠腹部正中切口,暴露肝蒂,颈内静脉注射50 U肝素,5 min后大鼠全身肝素化,于呼气末采用无创血管夹夹闭进入肝左、中叶的血管,肝脏颜色由淡红变为暗紫红色,表明阻断成功。阻断30 min后松开血管钳,观察5 min内肝脏颜色恢复,表明再灌注成功。S组仅游离肝蒂,但不阻断肝脏血管;SP组吸入2.1%七氟醚30 min后制备肝缺血再灌注模型。于再灌注1 h后放血处死大鼠,取肺组织进行指标测定。整个术中光照保温,盐水纱布覆盖防止水分丢失减慢大鼠死亡。
2.3标本制备取右肺上叶组织用4℃生理盐水冲洗表面血迹,然后用滤纸吸干表面水分称湿重后,然后放在70℃电热恒温鼓风干燥箱中24 h至恒重,称干重,计算湿干重比(W/D比)。
取右肺下叶组织用4℃生理盐水洗去血迹后,-80℃下冻存,采用比色法测MDA含量与SOD活性。按检测试剂盒说明书操作。
取左肺下叶用10%福尔马林固定24 h后石蜡包埋,连续切4 μm厚石蜡切片2片,用HE染色,并检测细胞凋亡, 采用原位末端转移酶(TUNEL)法检测。
取出部分-80℃冰箱保存的右肺下叶组织,加入细胞裂解液及酶抑制剂,匀浆后离心取上清,BCA法测定蛋白浓度。取20 μL蛋白样品,经SDS-PAGE法分离后,以半干转法电转移至NC膜上,NC膜经5%BSA室温封闭2 h后,用TBST稀释一抗至适当浓度(1︰1 000),4℃孵育过夜。洗涤液冲洗后加入二抗,室温孵育2 h,洗膜。以化学发光检测试剂显色之后水洗终止反应,暗室中用X胶片感光、显影、定影。
取部分左肺上叶组织放入4%中性甲醛溶液中固定,予以常规石蜡包埋、切片、HE染色。
2.4主要观察指标
2.4.1组织损伤程度的测定计算湿干重比(W/D)用来反应各组肺组织损伤程度。
2.4.2脂质过氧化程度的测定丙二醛(MDA)可以用来反映脂质过氧化反应的程度,而超氧化物歧化酶(SOD)用来保护细胞不受氧自由基损伤。
2.4.3肺组织病理学改变及细胞凋亡的测定光镜下观察肺组织HE染色后的形态变化;采用TUNEL法原位检测各组肺细胞凋亡情况。随机选取5个视野光镜下观察,细胞核呈棕黄色为凋亡细胞,400倍光镜下计数凋亡细胞并计算细胞凋亡指数(凋亡细胞数/总细胞数×100%)。
2.4.4肺组织NF-κBp65蛋白表达水平用凝胶图像分析系统扫描测定条带的吸光度值行分析处理,以目的蛋白与β-actin灰度值的比值反映NF-κBp65蛋白的表达水平。
3结果
3.1肺组织W/D比值各组肺组织W/D比值资料见表1。经整体比较(单因素方差分析),3组间均有统计学意义(P<0.05)。再行两两比较,结果为:缺血再灌注组及七氟醚组与假手术组比较,W/D比值显著增加,差异有统计学意义(P<0.05);而七氟醚组与缺血再灌注组比较,W/D比值显著降低,差异有统计学意义(P<0.05)。
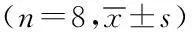
表1 三组大鼠肺组织各项指标比较
注:与S组比较,△P<0.05;与IR组比较,*P<0.05。
3.2肺组织MDA含量与SOD活性3个组整体比较也有显著性意义(P<0.05)。两两组间比较:缺血再灌注组及七氟醚组与假手术组比较MDA含量显著增高,SOD活性显著降低,差异有统计学意义(P<0.05) ;而七氟醚组与缺血再灌注组比较,MDA含量显著降低,SOD活性显著增加,差异有统计学意义(P<0.05) ,见表1。
3.3肺组织细胞凋亡各组镜下均可见凋亡细胞。对细胞凋亡指数(AI)做3组整体比较,结果差异有统计学意义(P<0.05)。两两比较:缺血再灌注组及七氟醚组AI较假手术组显著增高,差异有统计学意义(P<0.05);七氟醚组较缺血再灌注组AI显著降低,差异有统计学意义(P<0.05),见表1。
3.4肺组织NF-κBp65蛋白表达水平缺血再灌注组及七氟醚组与假手术组比较,NF-κBp65蛋白表达水平显著增加,结果差异有统计学意义(P<0.05);而七氟醚组与缺血再灌注组比较,NF-κBp65蛋白表达水平显著降低,结果差异有统计学意义(P<0.05),见表1。原始蛋白条带图见图1,图2。
3.5组织病理学检查光镜下S组肺组织结构未见异常;IR组及SP组细胞结构均有不同程度破坏;IR组肺损伤严重,肺泡腔完整性破坏,肺泡腔缩窄,间隔增厚,可见炎性细胞浸润。肺泡壁及肺泡间质中可见大量中性粒细胞(PMN);SP组肺损伤较IR组减轻,但仍可见肺间质不同程度增生,肺泡壁毛细血管充血,肺间质炎性细胞浸润,肺泡结构仍存在一定损伤。病理学结果见图3。
4讨论
临床工作中,病人院内死亡有多种原因,重大创伤引起的院内死亡之一是多器官衰竭,重大创伤后的败血症,脓毒血症以及全身炎症反应均会发展为多器官功能衰竭,肝缺血再灌注损伤引起远隔脏器肺损伤亦是全身炎症反应失衡的结果[3]。研究证实缺血再灌注的器官因组织受损可向循环中释放细胞因子以及其他促炎性介质等,从而造成多脏器功能障碍[4]。目前,关于缺血再灌注的单个器官引起多器官功能障碍的内在机制我们知之甚少,而在这些仅有的机制中,氧毒性及自由基产物等炎性介质发挥着重要作用[5]。有研究表明肝缺血再灌注中,损伤的肝组织向循环内释放具有破坏性的促炎性细胞因子和氧自由基等是引起远隔脏器损伤的原因[4],肺脏作为呼吸系统的主要脏器比较常见。 七氟醚的器官保护作用已被广泛证实,其在肺脏顺应性方面的保护与NF-κBp65有关也已经被证实[6]。
近年来有关组织缺血再灌注及细胞凋亡的研究越来越多,细胞凋亡使机体保持稳态。肝脏缺血再灌注使机体处于应激状态,必然会打破原有的平衡,这就迫使细胞自我保护,已有国外文献报道,在光学显微镜下观察缺血后的脑组织,其中的病理变化是神经细胞的大量凋亡[7]。另有研究表明,NF-κBp65能够降低急性肺损伤时肺组织损伤程度且与抑制细胞凋亡有关[8]。而已有报道证明七氟醚在降低组织损伤方面与抑制NF-κB蛋白有关[9]。 因此本研究同时测定NF-κBp65的表达以此推测其中发生的变化。
NF-κB作为一种核转录因子具有两种亚单位p50/p65, 但只有p65在蛋白的C末端含有转录激活区域,能直接作用于转录区域而激活转录过程[10]有研究表明[8],正常大鼠细胞内NF-κB表达较少,而人为使大鼠处于急性肺损伤2 h后,其表达含量增加,这就证明了NF-κB参与了急性肺损伤,应用静脉麻醉药丙泊酚后,对比模型组,细胞凋亡的发生率也相应降低, 国外有研究报道[11],人为使大鼠失去p65基因后,器官缺血后脑组织损伤明显减轻。另外,若在大鼠脑组织处于缺血再灌注过程中p65基因被激活,则会加重细胞的凋亡[12]。而在此过程中给予抗氧化剂,降低p65活性后,反而减轻了神经细胞的凋亡[13]。
组织发生缺血再灌注后,细胞释放大量氧自由基,这些氧自由基一方面会进一步激活NF-κB,从而使其编码的下游的炎症因子产生增多;另一方面通过改变周围细胞膜的特性使其产生损伤细胞的氧自由基,在这过程中包括MDA的产生,从而攻击组织。在本次试验中,我们成功建造了模型,肺脏作为缺血再灌注后最先受损的器官,表现在细胞完整性的破坏,大量PMN的浸润,及可见到细胞充血及水肿,W/D用来反映各个实验组细胞受损程度,MDA反映氧自由基水平以及脂质过氧化反应程度,而SOD是细胞的保护者,它的存在使MDA不能作用于细胞,进而维持一种保护性的平衡。对比SP组可发现使用七氟醚后细胞凋亡发生率,远隔器官病理学改变以及组织发生的脂质过氧化反应均减轻,这就提示远隔器官的组织损伤与细胞脂质过氧化反应有关,并且七氟醚对组织损伤的保护可能是通过降低NF-κB的活性这一机制。但是这种机制是如何发生的,还有待进一步研究。
综上所述,七氟烷对大鼠肝缺血再灌注后肺细胞凋亡具有抑制作用,其作用机制可能通过降低肺组织NF-κB的活性,从而抑制脂质过氧化有关。
参考文献:
[1]Miranda LE,Capellini VK,Reis GS,et al.Effects of partial liver ischemia followed by global liver reperfusion on the remote tissue expression of nitricoxide synthase:lungs and kidneys[J].Transplant Proc,2010,42(5):1557-1562.
[2]Zhai Y,ShenXD,O′Connell R, et al. Cutting edge:TLR-4 activation mediates liver ischemia/reperfusion inflammatory response via IFN regulatory factor 3-dependent MyD88-independent pathway[J].J Immunol,2004,173(12):7115-7119.
[3]卢建喜,杨涛.亚甲蓝预处理对大鼠肝缺血再灌注肺损伤的保护作用[J].浙江创伤外科,2012,17(2):169-171.
[4]Jiang H,Meng F,Li W,et al.Splenectomy ameliorates acute multiple organ damage induced by liver warm ischemia reperfusion in rats[J].Surgery,2007,141(1):32-40.
[5]Oltean M, Mera S,Olofsson R,et al.Transplantation of preconditioned intestinal grafts is associated with lower inflammatory activation and remote organ injury in rats[J].Transplant Proc,2006,38(6):1775-1778.
[6]胡蓉,黄燕,姜虹,等.七氟醚对慢性阻塞性肺疾病大鼠气道及肺组织P65及肺功能的影响[J].上海医学,2010,33(6):532-535.
[7]Fano G,Biocca S,Fulle S,et al.The S-100:a protein family in search of a function[J].Proq Neurobiol,1995,46(1):71-82.
[8]李莎,张焰,彭生,异丙酚对急性肺损伤大鼠肺组织凋亡及NF-κBp65的影响[J].中华急诊医学杂志,2011,5(20):494-497.
[9]陈琳,王瑞婷,贺克强,等. 七氟烷预处理对小儿体外循环后肠黏膜屏障功能的影响[J].安徽医药,2015,19(9):1795-1798.
[10] Grinm S,Bacuerle PA.The inducible Transcription factor.kappa B, structure-function relationship of its protein subunits[J].J Bioch,1993,290(2):297-308.
[11] Tiainen M,Roine RO,Pettila V,et al.Serum neuro-specific enolase and S-1 00 protein in cardiac arrest patients treated with hypothermia[J].Stroke,2003,34(12):2881-2886.
[12] Nakagawa H,Yamada M,Kanayama T,et al.Myelin basic protein in the cerebrospinal fluid of patients with brain tumors ischemic territorial MCA infarction[J].Stroke,1997,28(10):1961-1965.
[13] Woertgen C,Rothoel RD,Wiesmann M,et al.Glial and neuronserum markers after controlled cortical impact injury in the rat[J].Acta Neurochir Suppl,2002,81(12):205-207.
基金项目:国家自然科学基金 (No 81160016)
通信作者:徐桂萍,女,主任医师,硕士生导师,研究方向:小儿麻醉,E-mail:XGPSYL@126.com
doi:10.3969/j.issn.1009-6469.2015.12.007
(收稿日期:2015-07-28,修回日期:2015-09-15)
Pneumocyte apoptosis after hepatic ischemia-reperfusion in rats
and the effect of sevoflurane on apoptosis and NF-κBp65
GUAN Xiao-meng1,XU Gui-ping2,WANG Xiao-li1
(1.GraduateSchoolofXinjiangMedicalUniversity;2.DepartmentofAnesthesiology,
People’sHospitalofXinjiangUygurAutonomousRegion,Urumqi830000,China)
Abstract:Objective To explore the influences of sevoflurane pretreatment on apoptosis of rat lung cells after hepatic ischemia reperfusion. Methods Twenty-four Wister rats were randomized into 3 groups (n=8):sham-operation group, hepatic ischemia reperfusion group and sevoflurane group. After 30 min of hepatic portal occlusion, rat models with 70% hepatic ischemia and reperfusion were established. Porta hepatis was only separated but not blocked in the sham-operation group (group S); hepatic ischemia reperfusion rat model was established by 30 min of hepatic portal occlusion and 1 h of reperfusion in hepatic ischemia reperfusion group (group IR); In sevoflurane pretreatment group (group SP), the rats were inhaled with 2.1% of sevoflurane for 30 min, and then stopped. 10 min later, hepatic ischemia reperfusion model was established. The animals were executed at 1h after reperfusion. The lung tissue was taken. Wet/dry weight ratio (W/D ratio) was determined. Colorimetry was adopted to determine activity of superoxide dismutase (SOD) and content of malondialdehyde (MDA). Terminal-deoxynucleoitidyl transferase mediated nick end labeling (TUNEL) was used to determine cell apoptosis. Cell apoptosis index (AI) was calculated. Western blot was used to determine expressions of NF-κBp65. Pathological results of lung tissue were observed under microscope. Results W/D ratios, AIs, NF-κB activity and MDA content of group IR and group SP at each time after reperfusion were significantly increased compared with group S (All P<0.05); SOD activity was decreased significantly (P<0.05); W/D ratios, AIs, NF-κB activity and MDA content of group SP were significantly lower than those of group IR (All P<0.05); and SOD activity was obviously increased (P<0.05); lung tissue injury of group SP was decreased compared with group IR. Conclusions Cell apoptosis may play an important role in lung tissue injury due to hepatic ischemia reperfusion. Sevoflurane has a certain inhibition on rat lung cell apoptosis after hepatic ischemia reperfusion, which may eliminate free radicals and inhibit lipid peroxidation by reducing activity of NF-κB in lung tissue.
Key words:sevoflurane;cell apoptosis;ischemia-reperfusion
