重症监护病房中央导管相关血流感染的干预研究
2015-01-30李六亿贾会学张秀月侯铁英宗志勇李卫光刘运喜文建国0姜亦虹谢金兰吴安华
曾 翠,李六亿,贾会学,张秀月,侯铁英,宗志勇,李卫光,杨 怀,杨 芸,刘运喜,文建国0,陆 群,姜亦虹,谢金兰,吴安华
(1中南大学湘雅医院,湖南 长沙 410008;2北京大学第一医院,北京 100034;3中国医科大学附属盛京医院,辽宁 沈阳110004;4广东省人民医院,广东 广州 510008;5四川大学华西医院,四川 成都 610041;6山东省立医院,山东 济南
250021;7贵州省人民医院,贵州 贵阳 550002;8山西医学科学院山西大医院,山西 太原 030001;9解放军总医院,北京100853;10郑州大学第一附属医院,河南 郑州 450052;11浙江大学医学院附属第二医院,浙江 杭州 310009;12南京大学医学院附属鼓楼医院,江苏 南京 210008;13苏北人民医院,江苏 扬州 225001)
中央导管相关血流感染(central line-associated bloodstream infection,CLABSI)是使用中央静脉导管(central venous cat heter,CVC)最常见的并发症。借助医院感染预防与控制能力建设项目,本研究通过前瞻设计、多中心合作进行重症监护病房(ICU)插管干预与维护干预相结合的依从性干预,并进行了CLABSI发病率的监测,观察干预效果,现将结果报告如下。
1 对象与方法
1.1 研究对象 选取全国12个省及直辖市(北京、辽宁、山东、河南、山西、江苏、浙江、广东、贵州、四川、重庆、湖南)41所医院的54个ICU(综合ICU 35个,内科ICU、急诊ICU各4个,外科ICU、呼吸ICU各3个,神外ICU 2个,心内ICU、儿科ICU、神内ICU各1个),2013年10月1日—2014年9月30日所有入住ICU并留置CVC(仅纳入锁骨下静脉、颈内静脉、股静脉置管)的患者(包括成人及儿童)均为监测对象。2013年10月1日—2014年3月30日进行基线调查,调查数据为干预前数据;2014年4月1日—9月30日为持续干预期,调查数据为干预后数据。
1.2 调查方法 调查内容包括CLABSI发病率与CLABSI防控措施依从性。ICU护士每日登记监测科室住院患者人数和留置中央静脉导管患者人数,并观察与登记CLABSI防控措施依从性情况;医院感染监控专职人员负责检查护士填写的患者日志,根据患者临床症状体征、实验室检查(微生物学检测)结果判断是否为CLABSI,完善相关置管信息与感染信息,并抽查CLABSI防控措施依从性。
1.3 诊断标准 依据2013年美国疾病控制与预防中心(CDC)颁布的CLABSI的诊断最新定义[1]稍作修改:中央导管留置后至拔管2个日历日内的患者(留置或拔管当天为第1个日历日),首次满足以下标准之一时,诊断为CLABSI。标准1:至少1套或1套以上血培养中分离出公认的病原菌,且与其他部位的感染无关。公认的病原菌:如金黄色葡萄球菌、肠球菌属、大肠埃希菌、假单胞菌属、克雷伯菌属、假丝酵母菌属等。标准2:以下条件必须均满足。(1)不同时段抽血的2套或多套血培养,所分离出的微生物为常见共生菌;常见皮肤共生菌包括:类白喉杆菌(棒状杆菌属,白喉杆菌除外)、芽胞杆菌属(炭疽杆菌除外)、丙酸杆菌属、凝固酶阴性葡萄球菌(包括表皮葡萄球菌)、草绿色链球菌、气球菌属、微球菌属。(2)患者至少有以下1种症状或体征:发热(>38℃),寒战,低血压。(3)症状和体征及阳性实验室结果与其他部位的感染无关。标准3:以下条件必须均满足。(1)≤1岁的婴儿不同时段抽血的2套或多套血培养,所分离出的微生物为常见皮肤共生菌。(2)至少具有下列症状或体征之一:发热(肛温>38℃),低体温(肛温<36℃),呼吸暂停,或心动过缓。(3)症状和体征及阳性实验室结果与其他部位的感染无关。
1.4 干预方法 2014年4月1日—9月30日,各医院根据自身情况采取培训、督导等方式持续推广,监督下列干预措施的实施:(1)减少股静脉及两部位或两部位以上同时置管的比例。(2)置管者和配合者按照《医务人员手卫生规范》执行手卫生。(3)置管者戴口罩、圆帽、无菌手套,穿无菌手术衣。(4)置管时铺大无菌单(巾),覆盖除穿刺部位以外的全身。(5)中央导管置管时,推荐选择≥0.5%氯己定乙醇消毒剂消毒皮肤,未使用氯己定乙醇消毒剂时,可用≥0.5%有效碘液、碘酊、70%乙醇;皮肤消毒范围的直径应在15 c m以上(成人);消毒方法应以穿刺点为中心,螺旋状旋转用力擦拭,消毒至少2~3遍,待消毒剂自然干后方可穿刺。(6)保持中央导管连接端口的清洁,注射药物前,应用合适的消毒剂(氯己定乙醇、聚维酮碘、70%乙醇)用力擦拭消毒至少15 s,如有血迹等污染时,应立即更换。(7)每日评估置管的重要性及是否需要拔管,并记录。其中(1)、(2)、(3)、(4)、(5)为置管干预措施,(6)、(7)为维护干预措施。
1.5 统计学分析 应用SPSS 16.0软件进行统计分析,Stata 9.0软件进行发病密度比较,计算RR(Rate Ratio),P≤0.05为差异有统计学意义。
2 结果
2.1 监测患者一般情况 干预前与干预后分别监测3 745、5 773例CVC置管患者。干预前与干预后患者年龄、性别、APACHEⅡ评分差异均无统计学意义,见表1。
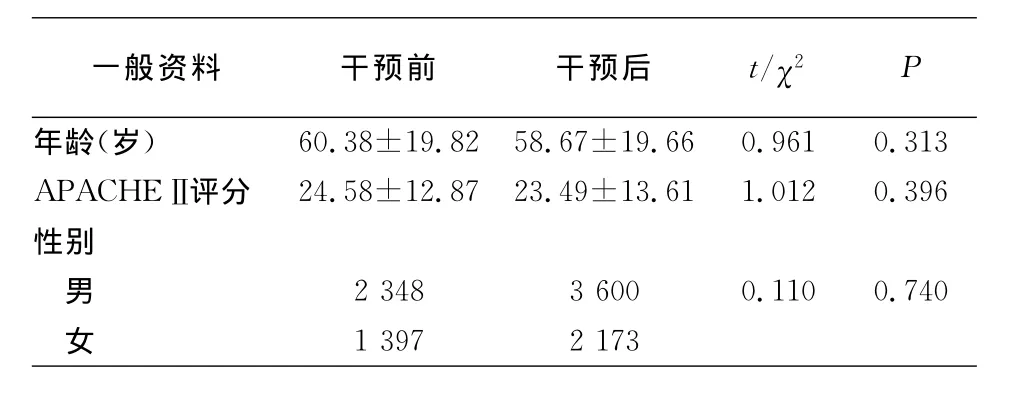
表1 干预前后患者一般资料比较Table 1 General information of patients before and after intervention
2.2 中央静脉导管使用率与CLABSI发病率 干预前后中央静脉导管使用率(44.18%VS 44.63%)比较,差异有统计学意义(χ2=5.526,P=0.019)。干预前后CLABSI发病率比较,差异无统计学意义[RR及95%CI为0.82(0.59-1.13),P=0.10]。见表2。
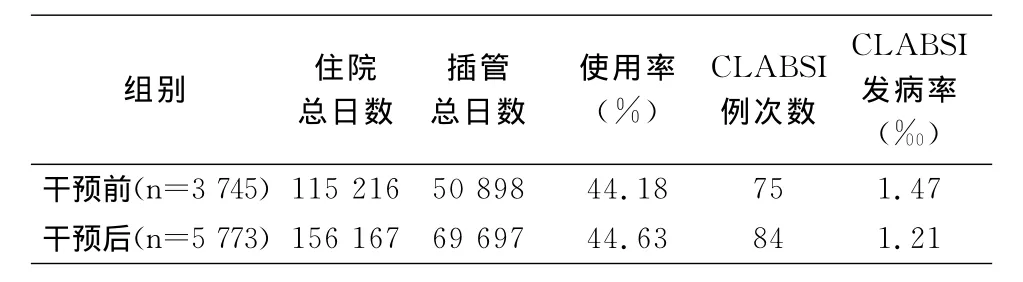
表2 干预前后中央静脉导管使用与CLABSI感染情况Table 2 Utilization of CVCs and occurrence of CLABSI before and after intervention
2.3 中央静脉导管置管及维护情况 干预前后置管部位构成比较,差异有统计学意义(χ2=76.264,P<0.001),干预后股静脉置管(17.25%VS 13.72%)、两个及以上部位置管(2.27%VS 1.44%)的置管比率有所降低,见表3。干预后,手卫生的执行率和正确率均高于干预前(均P<0.001);干预前后皮肤消毒剂构成比较,差异有统计学意义(χ2=3.861,P<0.001),其中氯己定乙醇所占比率升高(29.62%VS 50.56%)。见表4~5。除每日评估并记录外,其他防控措施的依从性干预前后比较,差异均有统计学意义(均P<0.001);使用无菌大铺巾、置管者着装合格、端口消毒合格率均有不同程度提高。见表6。
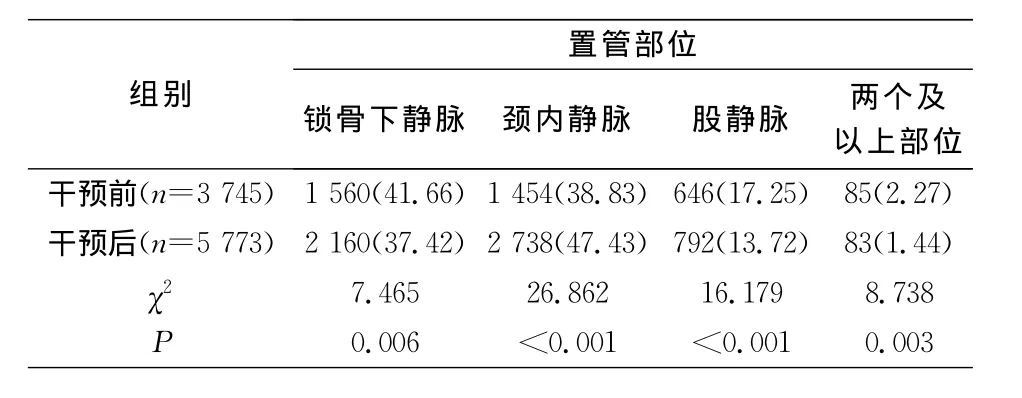
表3 干预前后置管部位比较(例,%)Table 3 Cat heter insertion sites before and after intervention(No.of cases,%)
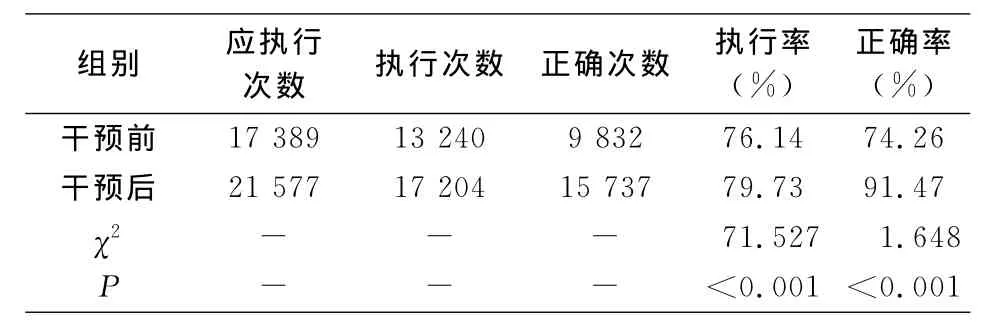
表4 干预前后手卫生情况Table 4 Hand hygiene before and after intervention
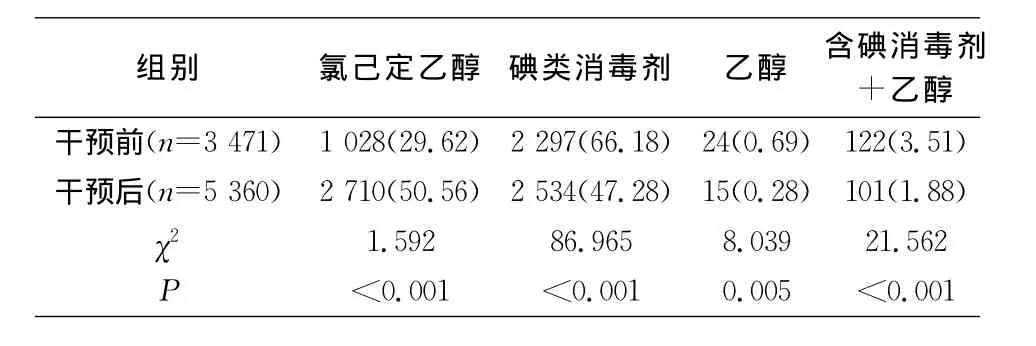
表5 干预前后消毒剂选择情况(例,%)Table 5 Choice of disinfectants before and after intervention(No.of cases,%)
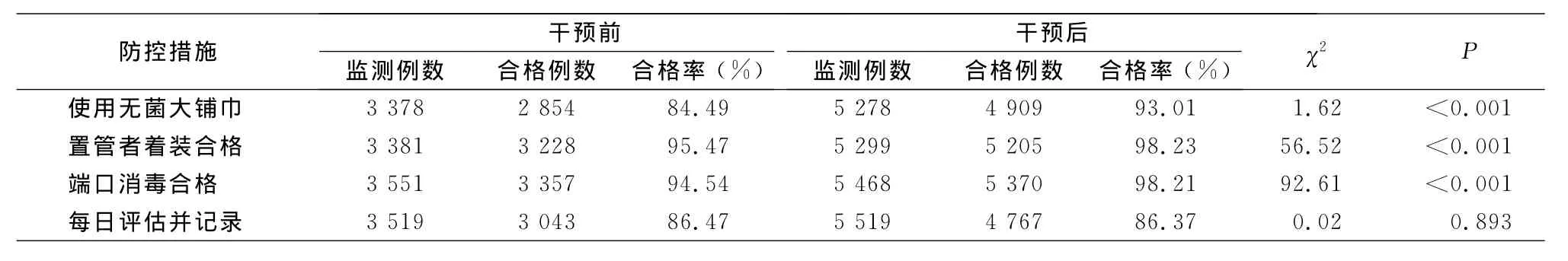
表6 干预前后各防控措施执行情况比较Table 6 Implementation of prevention and control measures before and after intervention
3 讨论
3.1 CVC使用率与CLABSI发病率 我国内地关于CLABSI发病率方面少见大规模调查报道,主要与监测依从性不高,数据收集和研究开展方面存在困难有关。尚存在的问题包括对CLABSI的诊断标准不统一、诊断水平不一、送检率不高、漏报率较高等问题,导致各文献结果之间无法相互借鉴。本研究未采用以往回顾性的调查方法,通过多中心合作、前瞻性调查对各类ICU中央静脉导管使用与CLABSI情况进行了过程监测与目标性监测。本次调查的41所医院中仅1所为专科医院,其余均为综合性医院;医院等级:34所三甲医院、2所三乙医院,4所三级未定等医院,1所二甲医院,2所二乙医院,基本可代表中国内地大型综合医院的中央静脉导管使用与CLABSI情况。由于是多中心参与的调查研究,把握调查的标准尤为重要。在调查开始前对各医院参与监测人员进行了培训,确定了监测方法,诊断标准与报告内容,以确保调查结果的完整与可信。
2007年山东省12所三级综合性医院9—12月入住ICU的患者动静脉导管使用率为50.95%,导管相关血流感染(catheter-related bloodstream infection,CRBSI)发病率为1.98%[2];而美国医疗安全网络(National Healthcare Safety Network,NHSN)公布的2012年63所长期急性病医院成人ICU监测结果中,中央静脉导管使用率为61.51%,CLABSI发病率为1.62‰[3]。本调查结果所得的中央静脉导管平均使用率较国内外数据均低,这可能与本调查仅纳入了从颈内静脉、锁骨下静脉、股静脉置入的中央静脉导管的患者作为监测对象,排除了从外周静脉置入的中心静脉导管(PICC)及上、下腔静脉等置入点置入的中央静脉导管,缩小了监测的范围有关。CLABSI发病率较国内外数据也均低,这可能与患者病情、导管选择、置管部位选择、管道维护等多方面因素有关[4],或与诊断标准的掌握存在偏差,临床对感染病例的描述及送检是否及时有关,故需加强病例的审核。
3.2 CLABSI防控措施 CLABSI往往与患者自身身体状况、置管及维护情况相关[5]。其中医源性因素即置管时的措施与维护措施更为重要。根据美国健康研究所(Instit ute for Healt hcare Improvement,I HI)基于“循证实践指南”提出的集束化干预策略[6],本研究选择了7条有循证依据的置管及维护干预措施进行集束化干预。监测结果显示,干预前中央静脉导管使用率与CLABSI发病率分别为44.18%与1.47‰,干预后则为44.63%与1.21‰,干预后中央静脉导管使用率有上升,发病率差异无统计学意义。说明干预有一定成效,也说明实施集束化干预策略有利于CLABSI的预防。除每日评估是否需要拔管并记录外,各干预措施的执行情况也较干预前有了明显的提升。
穿刺部位细菌是导管相关感染的主要感染源,人体不同解剖部位的细菌生长密度和种类各不相同。针对中央静脉导管的穿刺部位而言,腹股沟部的细菌菌落数明显高于锁骨下及颈部,股静脉插管后发生感染的比例最高。另外,临床在治疗危重患者时,常常会出现多部位同时置管的情况,大大增加了CLABSI的可能性。通过干预,股静脉与多部位同时置管的比例减少,基本达到预期目标。
手卫生作为医院感染控制中既简单又十分重要的环节,已在全世界范围内引起广泛重视。正确的手卫生能有效减少感染的发生,确保穿刺前、穿刺后、使用导管前、使用导管后都执行手卫生。本研究干预后手卫生的执行率及正确率均有了提升,说明项目干预有一定成效。干预后手卫生执行率为79.73%,未达到卫生部要求的95%,尚有较大改善空间。
选择合适的皮肤消毒剂是预防CLABSI发生的重要措施之一。含碘消毒剂为广谱高效消毒剂,目前,含碘消毒剂已成为我国临床上首选的置管皮肤消毒剂[7]。氯己定又称洗必泰,局部应用时,以细菌细胞膜上的磷脂分子作为靶标,破坏其完整性,使细菌死亡。由于氯己定与皮肤有良好亲和性,从而持续抗菌作用较强,因此,美国选用2%氯己定作为皮肤消毒的首选。大量研究[8-9]证明,用2%洗必泰做皮肤消毒准备较0.5%的碘伏或75%乙醇更能有效防止中央静脉导管细菌的定植。本次调查中氯己定使用率在干预后有了明显的提升,差异有统计学意义。但其与CLABSI发病率关系尚有待进一步研究证实。
最大化无菌屏障指进行导管穿刺时,要求操作者必须洗手、戴口罩(遮住口鼻)、戴帽子(头发不能露出)、戴无菌手套、穿无菌隔离衣,患者除了穿刺部位外露外,从头到脚覆盖无菌单。
中央静脉导管末端的接头部位均为螺旋设计,其表面凹凸不平,凹槽内常常留有血渍、药渍,病原菌易定植在其中,不规范的清洁消毒难以达到杀灭导管端口致病菌的目的。输液时致病菌可通过输液装置随输入液体进入导管内,很容易引发感染。在本次调查中,端口消毒合格率干预后达到98.23%,高于预期,说明端口消毒是可以通过积极推进落实的防控措施。
中央静脉导管无明确留置期限,导管留置愈久,发生CLABSI的风险愈大[10]。因此,医护人员应准确记录中央静脉置管时间,密切观察穿刺点局部情况和患者的全身症状,根据疾病治疗的需要尽早拔除感染风险高的导管。每日评估是否可以拔管是本项目推行的所有干预措施中执行率最低的,在干预前后也无明显的变化,说明此项措施的可执行度不强,也可能与评估主要由医生主观评定,大部分医院并无评估拔管指征的表格或记录,而干预措施执行度的记录人员为临床护士,因此数据可能低于真实情况。
3.3 小结 在推进集束化干预措施的过程中,明确规定ICU医务人员、微生物室工作人员,以及医院感染监控专职人员的职责与任务;同时,对监测科室所有医护人员进行中央导管置管适应证、置管操作流程、导管维护、中央导管相关感染预防与控制,以及导管相关感染的诊断标准的教育,发放CLABSI标准操作流程海报、预防与控制手册等进行广泛宣传教育;配备速干手消毒剂,以提高医护人员医院感染控制意识。通过开展这些推进工作,提高了医疗质量,促进科室的建设和规范化管理。
致谢:对项目组专家、各省项目负责人、数据审核人员、项目医院的医务人员在项目设计和数据收集中的贡献表示衷心的感谢!
[1] Centers for Disease Control/National Healthcare Safety Network,Guidelines for t he prevention of intravascular cat heterrelated infections[S].CDC,2013,1.
[2] 李卫光,秦成勇,王一兵,等.山东省12所综合性医院ICU目标性监测分析[J].中华医院感染学杂志,2009,19(4):384-386.
[3] Dudeck MA,Weiner L M,Allen-Bridson K,et al.National Healt hcare Safety Network(NHSN)report,data summary for 2012,Device-associated module[J].Am J Infect Control,2013,41(12):1148-1166.
[4] 葛学顺,陈维开,蒋福云,等.集束化干预策略在预防ICU中心静脉导管相关血流感染中的应用[J].中国感染控制杂志,2012,11(6):422-424.
[5] Tan CC,Zanariah Y,Lim KI,et al.Central venous cat heterrelated blood strea m infections:incidence and an analysis of risk factors[J].Med J Malaysia,2007,62(5):370-374.
[6] Cinel I,Dellinger RP.Guidelines for severe infections:are they useful?[J].Curr Opin Crit Care,2006,12(5):483-488.
[7] 汪素萍,邓兵,潘年妙,等.碘伏在中心静脉置管术后创口护理中的效果观察[J].现代护理,2005,11(1):38.
[8] Mimoz O,Villeminey S,Ragot S,et al.Chlor hexidine-based antiseptic solution vs alcohol-based povidoneiodine for centrol venous cat heter care[J].Arch Inter n Med,2007,167(19):2066-2072.
[9] Shar pe EL.Tiny patiens,tiny dressings:a guide to t he neonatal PICC dressing change[J].Adv Neonatal Care,2008,8(3):150-162.
[10]Hagau N,Studnicska D,Gavrus RL,et al.Central venous catheter colonization and catheter-related bloodstream infections in critically ill patients:a comparison bet ween standard and silver-integrated cat heters[J].Eur J Anaest hesiol,2009,26(9):752-758.
