饲料虫草培养基水平对人工感染灿烂弧菌后刺参非特异性免疫指标及肠道菌群数量的影响
2015-01-21廖明玲刘晨敏孙爱杰任同军
■廖明玲 刘晨敏 孙爱杰 任同军
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连 116013;2.济南大学泉城学院,山东蓬莱 265600)
近年来,刺参病害报道逐渐增多,由灿烂弧菌(Vibrio splendidus)引起的细菌性传染病具有较大的危害性[1-2]。一种称为“腐皮综合症”的疾病已见报道,稚参、幼参及成参阶段均见发病,其症状为:患病刺参体壁失去弹性、皮肤溃烂、骨片散落。相关研究指出刺参“腐皮综合症”的致病菌可能是弧菌(Vibm)与假单胞菌(Pseudomonas)[2-4]。虫草培养基(CMC)是指用大米、小麦等进行蛹虫草人工培植,子实体采收后,长满菌丝体的培养基残基。蛹虫草多糖主要存在于蛹虫草菌丝中,人工培植CMC含虫草素、虫草多糖、虫草酸及多种氨基酸、微量元素及维生素等营养成分[5],作为饲料添加剂能提高肉鸡增重率,并显著增强其免疫力[6]。目前,蛹虫草的工厂化大规模生产多以大米为培养基质,采用自控发酵罐,人工培植技术已经相当成熟。然而其蛹虫草被采收后,仍残留大量蛹虫草菌丝的培养基残基多被丢弃,对其的研究利用鲜见报道,仅现于功能性酱油的酿造[7]、大鼠生长及繁育的影响[8]等少数领域,在水产养殖方面的研究利用相对匮乏。本试验研究了饲料中添加CMC对人工感染灿烂弧菌后刺参非特异性免疫指标及肠道菌群数量的影响,以期为CMC在刺参养殖方面的应用提供试验依据。
1 材料与方法
1.1 试验材料
从1 000只刺参幼参(大连金州养殖场)中随机选取大小相等、体色鲜亮、体质健壮的刺参共360只[初始体重为(1.06±0.37)g]进行试验。
CMC由辽宁省农业科学院大连生物技术研究所提供,由营口市产品质量监督检验所测定虫草素及腺苷含量。
灿烂弧菌(Vibrio splendidus)由辽宁省农业科学院大连生物技术研究所提供。将2次活化的灿烂弧菌接种在2216 E培养基上,于37℃下培养48 h,用3 ml无菌生理盐水将菌落冲下制成弧菌悬液,取1 ml梯度稀释后用血球计数板计数,调整至浓度为107cells/ml。
1.2 试验饲料
以马尾藻、鱼粉、酵母粉和纤维素为主要原料,分别添加0%、5%、10%及15%的CMC干粉,制成4种试验饲料(试验饲料配方及营养成分实测值见表1),即试验分为D1、D2、D3、D4组。饲料原料经超微粉碎机粉碎至180目(粒径为80 μm)以上,逐级混合均匀后,加入30%~40%水,再次混合均匀,后用制粒机挤压制成颗粒饲料(直径为1.8 mm),置于60℃烘箱烘干至恒重,装袋置于-20℃冰箱中备用。
1.3 饲养管理
试验刺参到达实验室后先置于2个200 L水槽中暂养7 d,待刺参适应实验室环境并能正常摄食配合饲料后开始养殖试验。试验共设置4个处理组,每处理组3个平行,共12个水槽(40 L),每槽30只刺参。养殖期间,每天换水1次,换水量为1/2~1/3,同时清理粪便和收集残饵;每天16:00投饵1次(起始投饵量3%),根据摄食情况,相应调节投饵量,以刺参完全摄食并略有剩余为适。试验于大连海洋大学农业部北方海水增养殖重点实验室进行,养殖试验持续28 d。养殖期间,海水pH值7.9~8.4,盐度30‰~31‰,通过空调控温,使水温保持在15~17℃,全天气泵充氧,全天进行避光处理。
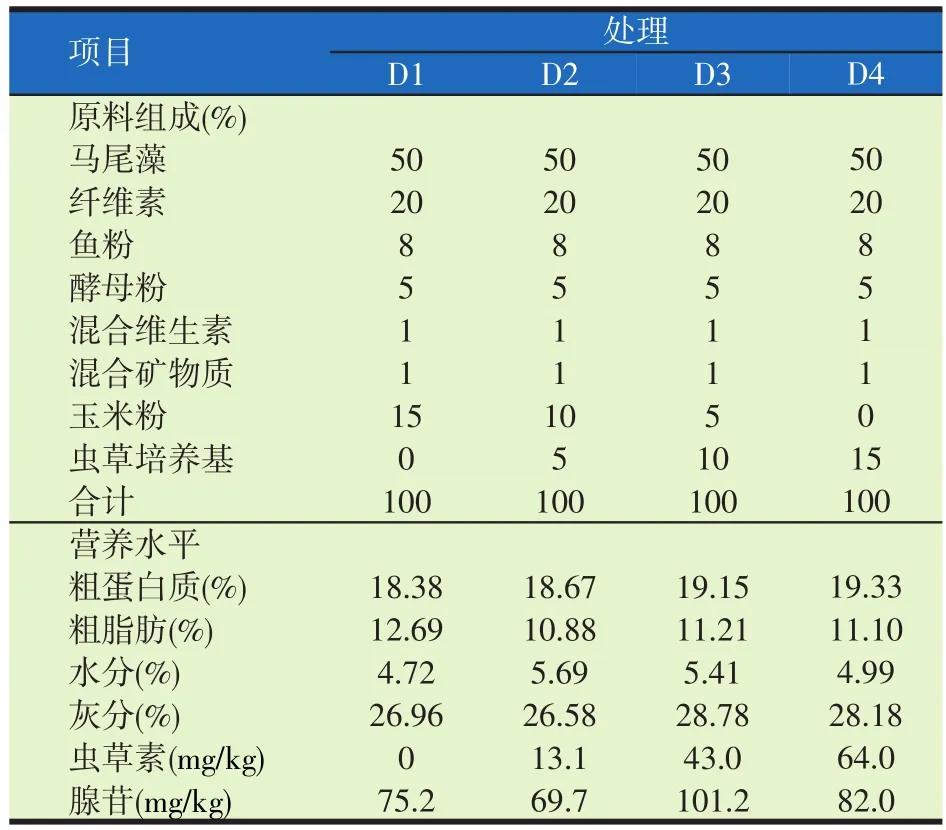
表1 试验饲料配方及营养水平(干物质基础)
1.4 刺参人工感染灿烂弧菌
28 d养殖试验结束后,从每个水槽中随机取出10只刺参用作免疫指标及肠道菌群数量的分析,其余刺参用作人工感染灿烂弧菌试验,通过体腔注射浓度为107cells/ml的灿烂弧菌0.5 ml。人工感染灿烂弧菌后,将各处理组三个平行的刺参合并在一个水槽中进行养殖,即共4个水槽,并继续投喂相应处理组饲料。
1.5 样品收集及指标测定
人工感染灿烂弧菌前(第0 d),测定刺参肠道菌群数量(肠道总菌数,TBC;肠道弧菌数,VBC)。第0 d及感染后的第1、3、5及7 d,分别对刺参体腔细胞吞噬率(PC),体腔液酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)及溶菌酶(LZM)活性进行测定;并在第7 d再次对肠道菌群数量进行测定。
养殖试验结束后,从每个处理组中随机取出6只刺参进行免疫指标的测定。取出的刺参置于冰盘上进行体腔液的采集,于4℃、3 000×g低温冷冻离心机中离心10 min,取上清液分装于1.5 ml Eppendorf离心管中,置于-80℃冰箱中备用,用作体腔液免疫指标的测定。
PC的测定参照Chen等及Long等(2005)[9-10]所述中性红方法,并稍作修改。刺参体腔液离心后,取下层沉淀用生理盐水稀释,用细胞计数板计数,直至稀释至106cells/ml。取0.2 ml稀释液与2 ml无菌生理盐水混匀,加入12孔细胞板中,在25℃下培养50 min,去除上清液,再加入2 ml 0.001 M中性红溶液染色,继续培养30 min,后用生理盐水小心冲洗3次,再加入2 ml乙醇/醋酸混合液,静置20 min,于540 nm下测定吸光度值。
ACP、AKP、LZM及SOD活性均使用南京建成生物工程研究所生产的试剂盒进行测定。ACP和AKP活性单位定义为:每克样品蛋白在37℃与基质反应30 min产生1 mg酚为1个酶活性单位(U);LZM活性单位定义为:以其透光率在每分钟内的下降速率定义为1个酶活性单位(U);SOD活性单位定义为:每毫克样品蛋白在1 ml反应液中SOD抑制率达到50%时所对应的SOD量为1个酶活性单位(U)。
刺参肠道菌群的分析参照Li等[11]所述方法。各处理组分别取三只刺参,用消毒的手术刀解剖获得其肠道,用匀浆器进行匀浆,并用无菌生理盐水对匀浆液稀释(通过预试验确定稀释倍数)。取0.1 ml稀释液在两种培养基上涂布。其中,2216E培养基用来测定肠道TBC[12],TCBS培养基用来测定肠道VBC[13]。在28℃下培养24 h后,对培养基上长出的菌落进行计数,细菌的总数用菌落形成单位(CFU)表示。
1.6 数据分析
所有数据均以“平均值+标准差(Mean±SD)”表示,利用SPSS 19.0软件对试验数据进行处理,单因素方差分析进行组间显著性检验,若差异显著(P<0.05),则做Duncan's法多重比较分析。
2 结果
2.1 细胞吞噬率(见图1)
由图1可知,投喂添加CMC饲料28 d后,即人工感染灿烂弧菌前,试验刺参PC随着饲料CMC水平的升高,呈现先升高后降低的变化趋势,但各处理组间差异不显著(P>0.05)。刺参人工感染灿烂弧菌后,第1 d,各处理组PC均有所降低,D3与D4处理组显著高于D1与D2处理组(P<0.05);第3~5 d,各处理组PC较第1 d有不同程度地升高,但其处理组间差异不显著(P>0.05);第7 d,D3处理组PC显著高于D4处理组(P<0.05),其余各处理组间差异不显著(P>0.05)。
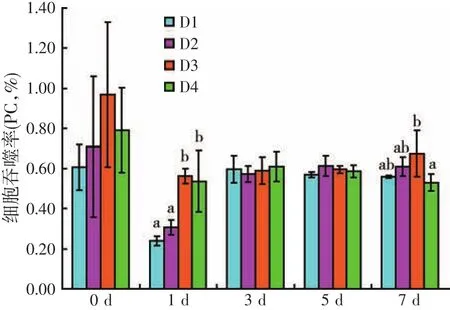
图1 饲料虫草培养基水平对人工感染灿烂弧菌后刺参细胞吞噬率的影响
2.2 酸性磷酸酶活性(见图2)
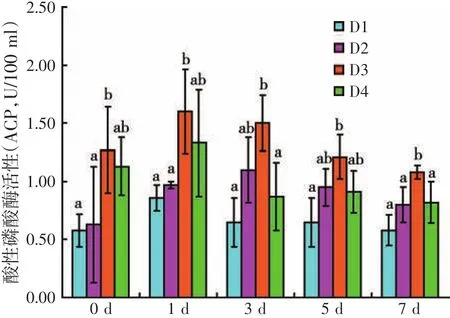
图2 饲料虫草培养基水平对人工感染灿烂弧菌后刺参体腔液酸性磷酸酶活性的影响
由图2可知,人工感染灿烂弧菌前后,D3处理组刺参体腔液ACP活性均高于其它处理组,各处理组间ACP活性变化较大。人工感染灿烂弧菌前(第0 d),D3处理组ACP活性显著高于D1与D2处理组(P<0.05);人工感染灿烂弧菌后,第1 d,D3处理组ACP活性显著高于D1与D2处理组(P<0.05);第3 d,D3处理组ACP活性显著高于D1与D4处理组(P<0.05),其余各处理组间无显著性差异(P>0.05);第5 d,只有D1处理组ACP活性显著低于D3处理组(P<0.05),其余各处理组间差异不显著(P>0.05);第7 d时,D3处理组ACP活性显著高于其它三个处理组(P<0.05)。
2.3 碱性磷酸酶活性(见图3)
由图3可知,人工感染灿烂弧菌前(第0 d),D4处理组刺参体腔液AKP活性最高,D3处理组次之,且显著高于其它两个处理组(P<0.05)。人工感染灿烂弧菌后,第1 d,D4处理组AKP活性明显降低,D2与D3处理组AKP活性显著高于D1与D4处理组(P<0.05);第3~5 d,各处理组刺参AKP活性差异均不显著(P>0.05);第7 d,D3处理组AKP活性最高,但与其它三个处理组相比并无显著性差异(P>0.05)。
2.4 溶菌酶活性(见图4)
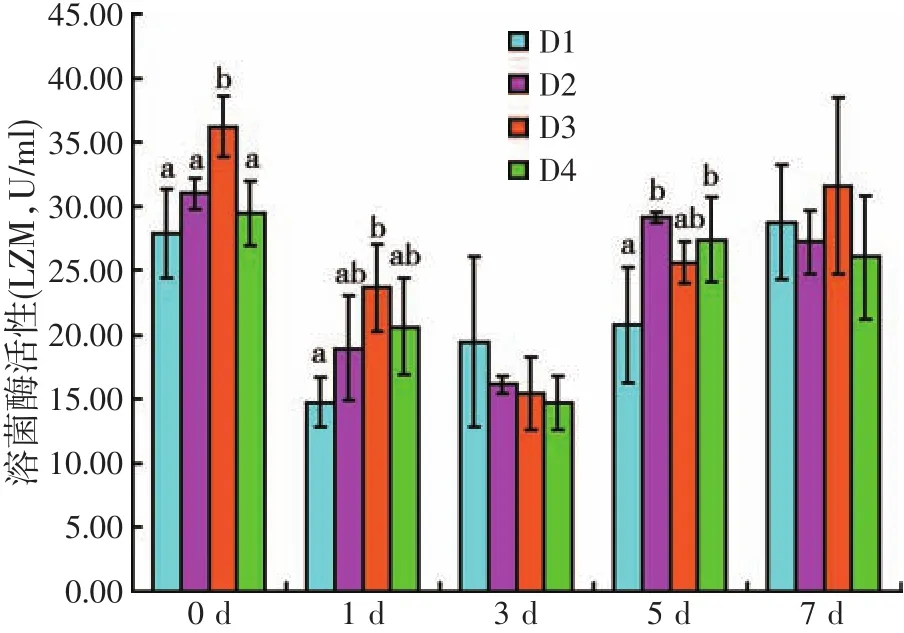
图4 饲料虫草培养基水平对人工感染灿烂弧菌后刺参体腔液溶菌酶活性的影响
由图4可知,人工感染灿烂弧菌前(第0 d),D3处理组刺参体腔液LZM活性最高,显著高于其它三个处理组(P<0.05);人工感染灿烂弧菌后,第1 d,各处理组间LZM活性变化趋势不变,D3处理组LZM活性显著高于D1处理组(P<0.05),其余各处理组间无显著性差异(P>0.05);第5 d,D2与D4处理组LZM活性显著高于D1处理组(P<0.05);LZM活性在第3 d与第7 d时各处理组间无显著差异(P>0.05),但总体而言,第7 d时LZM活性高于第1~5 d。
2.5 超氧化物歧化酶活性(见图5)
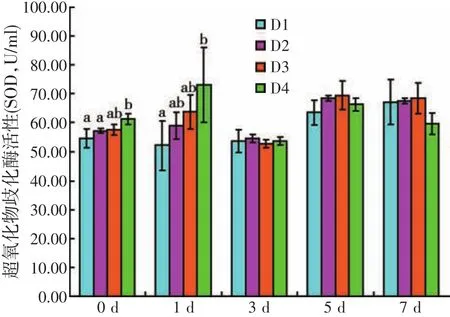
图5 饲料虫草培养基水平对人工感染灿烂弧菌后刺参体腔液超氧化物歧化酶活性的影响
由图5可知,随着饲料CMC水平的升高,刺参体腔液SOD活性变化趋势并不明显。人工感染灿烂弧菌前(第0 d),D4处理组SOD活性最高,显著高于D1与D2处理组(P<0.05),其余各处理组间无显著性差异(P>0.05);人工感染灿烂弧菌后,第1 d,D4处理组SOD活性仍然最高,显著高于D1处理组(P<0.05),随着饲料CMC水平的升高,SOD活性呈上升趋势;第3~7 d,各处理组间的SOD活性无明显变化。
2.6 肠道微生物菌落(见图6)
由图6可知,人工感染灿烂弧菌前,D3处理组刺参肠道TBC最低,显著低于其它三个处理组(P<0.05);人工感染灿烂弧菌后,各处理组TBC均有所升高,但各处理组间差异不显著(P>0.05)。人工感染灿烂弧菌前,D4处理组刺参肠道VBC最高,显著高于D2与D3处理组(P<0.05);人工感染灿烂弧菌后,各处理组VBC均有所升高,但其处理组间并无显著差异(P>0.05)。
3 讨论
3.1 免疫指标影响
多糖免疫增强剂在水产养殖中已得到较为广泛的应用,很多研究也报道了不同种类多糖饲料添加剂对水产动物呼吸爆发活力、PC、LZM活性、酚氧化酶活性(PO)等免疫因子的影响作用。向枭等[14]研究指出,饲料中添加黄芪多糖可提高齐口裂腹鱼血清中ACP、AKP、LZM及SOD活性。孙虎山等[15]对栉孔扇贝的研究同样表明,饲料中添加脂多糖能提高栉孔扇贝血清和血细胞中LZM、ACP、AKP、SOD、PO、髓过氧化物酶(MPO)及过氧化氢酶(CAT)的活性。此外,云芝多糖[16]、茯苓多糖[17]、浒苔多糖[18]也能不同程度提高水产动物血清中LZM活性。刺参特异性免疫机制不完善,主要依靠非特异性免疫来提高对疾病的抵抗力,其体腔细胞PC,体腔液LZM、SOD、AKP及ACP活性是反映机体免疫能力的重要非特异性免疫指标,在机体防御反应中发挥着重要作用。刘云等[19]和孙永欣[20]研究指出,饲料中添加黄芪多糖、海藻硫酸多糖及壳聚糖,能显著提高刺参体腔细胞PC,体腔液LZM、SOD、AKP及ACP活性。
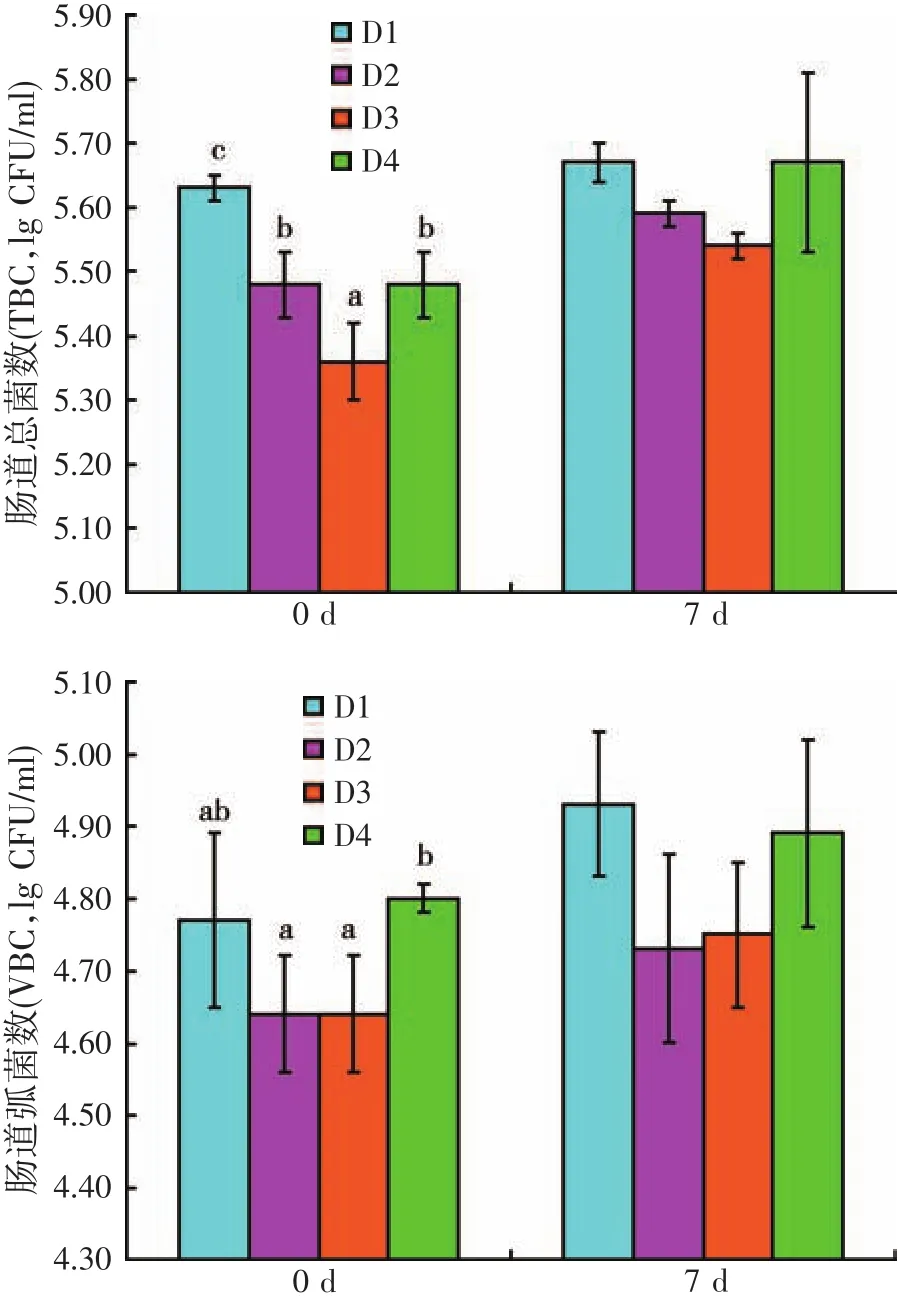
图6 饲料虫草培养基水平对人工感染灿烂弧菌后刺参肠道菌群的影响
本试验中,刺参人工感染灿烂弧菌前,当饲料虫草培养基水平为10%~15%时,各项免疫指标均达到最高水平,这与孙永欣等[21]研究结果相符。刺参投喂添加CMC饲料28 d后,刺参体腔细胞PC,体腔液LZM、SOD、AKP及ACP活性均有不同程度提高。这与Wang等[22]和孙永欣[20]在刺参饲料中添加黄芪多糖的研究结果相似。人工感染灿烂弧菌后,各项免疫指标随时间的推移而发生变化,不同指标开始下降的时间略有不同,其中PC与LZM、SOD活性均是从第1 d开始下降,而ACP与AKP活性则是从第3 d才开始下降,并且在第7 d开始恢复或已恢复至感染前水平。Wiens等[23]对虹鳟进行鲁氏耶尔森氏菌(Yersinia ruckeri)感染,感染后第1、3、5 d和7 d,分别测定虹鳟体内免疫相关基因的变化,结果表明,耶尔森氏菌能够促使虹鳟体内免疫相关基因的转录合成,感染后第1 d,TNFα1和IL1-β1的转录显著提高,于第3、5 d和7 d达到最高值。据此可以推断,本试验中刺参免疫指标的变化亦可能是由于灿烂弧菌促使刺参体内免疫相关基因的转录合成所致。人工感染灿烂弧菌后第7 d,投喂添加10%CMC饲料的刺参处理组各项非特异性免疫指标基本高于其它处理组,因此,以非特异性免疫的改善为评价指标时,刺参饲料CMC适宜添加比例为10%。
3.2 虫草培养基对肠道菌群的影响
刺参肠道中含有约43种细菌,优势菌群为弧菌属和假单胞菌属,其次是杆菌和放线菌等革兰氏阳性菌。某些弧菌种(Vibrio harveyi,Vibrio alginolyticus,Vibrio splendidus)是海水养殖业公认的重要病原菌,曾引起刺参养殖的巨大损失[2]。孙奕[24]对新鲜刺参及人工条件下饥饿培养的刺参的消化道、体腔液及表皮所分离到的359株细菌进行分离、鉴定,结果表明其分别属于弧菌属、假单胞菌属等11个主要菌属,此外,刺参栖居地泥沙中还包含芽孢杆菌属(Bacillus)和无色杆菌属(Achromobacter)。肠道菌群易受外界因素,如压力、抗生素、饲料等的影响。从黄芪、香菇、银耳、灵芝、人参等植物体中提取的多糖已被作为免疫增强剂应用于动物养殖[25]。多糖进入肠道后,同肠道菌群接触,从而影响肠道菌群的状态。张红梅等[26]研究发现,随着饲料甘露寡聚糖水平的升高,生长期鲤鱼肠道大肠杆菌数量随之减少,乳酸杆菌和双歧杆菌数量随之增加。肠道菌群中包含多种化合物,可以激活动物的免疫反应,从肠道菌群获得的长时间的免疫激活作用可以引发炎症反应、免疫应答等作用[27],肠道菌群的稳定对抵御肠道病原菌的感染具有重要意义[25]。
本试验中,人工感染灿烂弧菌后,各处理组刺参肠道TBC有所提高,肠道TBC的升高,可能是由于CMC能够使刺参肠道内某些益生菌的增殖。这与张红梅等[26]研究结果一致,多糖代谢产物可以被有益菌利用,从而促进肠道有益菌的增殖,抑制有害微生物的生长,实现肠道微生物区系的优化。另一方面,随着饲料CMC水平的升高,刺参肠道VBC不同程度降低。Zhang等[28]研究同样表明,低聚果糖能显著减少刺参肠道中弧菌数量,增强其抗病能力。多糖免疫增强剂的添加不仅可以有效地促进有益菌,如乳酸杆菌[29]与双歧杆菌[30]的生长,还能影响蛋白质消化率[31]和肠道形态学[32]。对于哺乳动物而言,弧菌感染的发病机制起源于肠道感染,据此推断,刺参的发病也可能是肠道菌群失调所致[33],仍需进行深入试验探讨验证。
4 结论
饲料中添加CMC能改善刺参体腔液非特异性免疫指标,增强其对灿烂弧菌的抵抗力,刺参饲料CMC适宜添加水平为10%。
