CALR基因突变在骨髓增殖性肿瘤中的临床研究
2015-01-19王彦丽戚光祖郭洪娜接贵涛范美英
王彦丽 戚光祖 郭洪娜 接贵涛 范美英
山东省临沂市沂水中心医院血液科,山东临沂 276400
BCR/ABL1 融合基因阴性的骨髓增殖性肿瘤(myeloproliferative meoplasm,MPN)是一组起源于多能造血干细胞的恶性肿瘤,表现为骨髓细胞一系或多系过度增殖, 包括真性红细胞增多症(polycythemia,PV)、原发性血小板增多症(essential thrombocthemia,ET)、原发性骨髓纤维化(primary myelofibrosis,PMF),临床上有发生动静脉血栓、髓外造血、骨髓纤维化、甚至向白血病转化[1-2]。 JAK2V617F 突变见于97%的PV,50%~60%的ET 及PMF 患者[3]。MPL515 基因突变可见于3%~5%的JAK2V617F 突变阴性的ET 及PMF 患者[4]。 自2005 年JAK2V617F 和MPL515 突变相继被发现并纳入WHO 诊断标准,该突变的发现改变了MPN 的诊断和分类,从分子的角度诠释了MPN的发病机制。但仍有40%的ET 及PMF 患者未检测到JAK2V617F 基因突变, 最近研究发现CALR 见于JAK2V617F 阴性的ET 及PMF 患者, 本研究对临床初诊MPN 患者进行了JAK2V617F、CALR 及MPL515基因突变分析,现报道如下:
1 资料与方法
1.1 一般资料
选择2012 年1 月~2015 年3 月在临沂市沂水中心医院就诊的72 例初诊MPN 患者。其中PV23例,男11 例,女12 例,年龄38~72 岁;ET26 例,男12例,女14 例,年龄25~80 岁;PMF23 例,男16 例,女7例,年龄39~76 岁。所有患者均经医院伦理委员会批准并签署知情同意书。
1.2 检验指标
对患者临床资料、骨髓和外周血涂片、骨髓活检进行分析,按照WHO 造血和淋巴组织肿瘤分类标准(2008)进行诊断。
1.3 方法
CALR 基因突变分析:用血液基因组DNA 提取试剂盒(QIAamp DNA Mini Kit,生产商:Qiagen 公司)提取骨髓细胞基因组DNA,CALR9 号外显子PCR 扩增引物(生产商:Invitrogen 公司;使用浓度:5.0 pmol/μL;贮存条件:干粉于-20℃保存,工作液于4℃保存;有效期:-20℃为1 年,4℃为半年),设计序列:引物名称:CALR-X9-Fwd, 引物序列:FAM-CTGGTCCTGGTCCTGATGT; 引物名称:CALR-X9-Rev, 引物序列:TCTCACAGAGACATTATTTGGC。 PCR 体 系 包 括DNA 50~100 ng,2×Taq PCR Master Mix(TIANGEN 公司产品)15 μL,正反向引物各0.5 μL,加去水离子补足体系至30 μL。 反应条件:98°C 预变性3 min,98°C变性10 s,63°C 退火30 s,72°C 延伸30 s,共29 个循环,72°C 延伸5 min。PCR 扩增产物经回收、纯化后实验数据采用片段分析软件Genemapperid V4.1 进行分析,分析示例见图1。
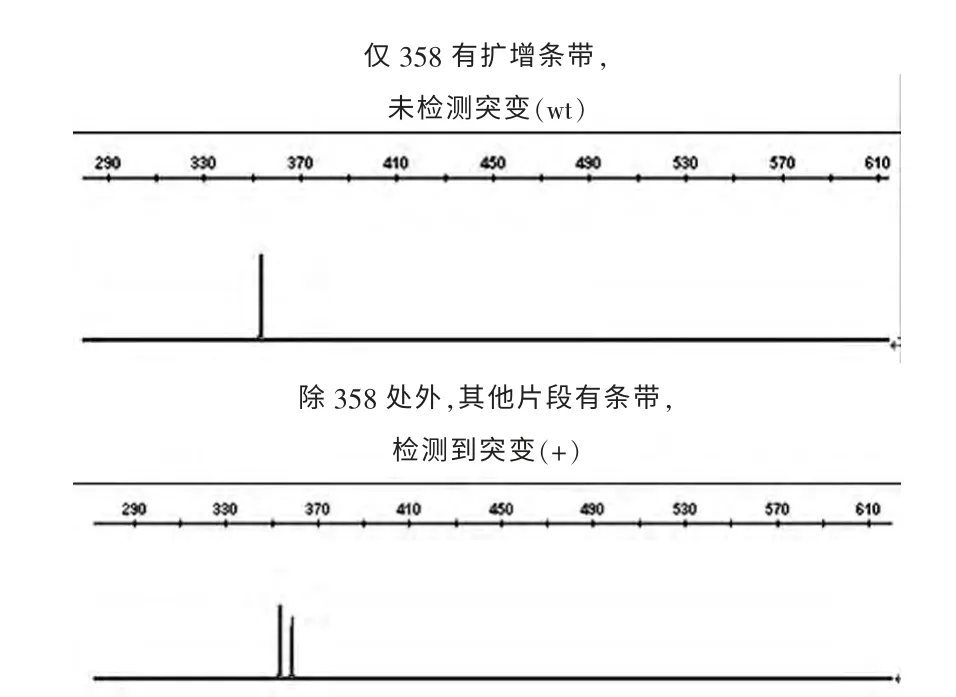
图1 Genemapperid V4.1 软加分析示例
2 结果
2.1 72 例MPN 患者临床及实验室检查特点
根据2008 年WHO 分型诊断标准,PV 22 例、ET 26 例、PMF 23 例、MPN-u 1 例。所有患者均接受常规治疗至随访结束,患者均存活。在8 例CALR 突变的ET患者血小板计数高于JAK2 突变阳性患者(表1);8例CALR 突变的PMF 患者中7 例为男性,发病年龄较小,且呈现出较低的白细胞计数、血红蛋白水平(表2)。

表1 8 例CALR 突变ET 患者初诊时临床、实验室特征
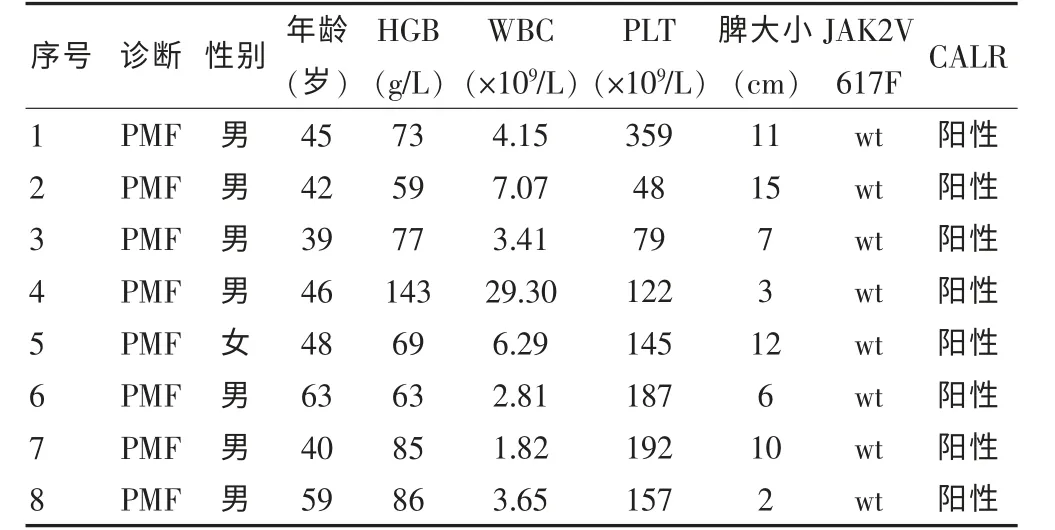
表2 8 例CALR 突变PMF 患者初诊时临床、实验室特征
2.2 JAK2V617F、CALR 及MPL515 基因突变检测结果
22 例PV 患者中16 例携带有JAK2V617F 突变(突变率为68%),未检测出CALR 基因突变;26 例ET患者中12 例携带有JAK2V617F 突变(突变率为46%),8 例检测出CALR 基因突变(突变率为31%),JAK2V617F突变阴性患者中CALR 基因突变率为57%(8/14);23例PMF 患者中11 例携带有JAK2V617F 突变(突变率为49%),8 例检测出CALR 基因突变(突变率为35%),JAK2V617 突变阴性患者中CALR 基因突变为为67%(8/12)。 在72 例患者中均未检测到MPL515 突变。
3 讨论
CALR 为Ca2+结合蛋白复合体, 主要定位于内质网(edoplasmic reticulum,ER)腔内。CALR 基因定位于染色体19p13.2~p13.3,包含9 个外显子,大小为4.2 kb,其编码的CALR 由高度保守近似球形结构的N 端(1~180 氨基酸残基)、 参与ER 内Ca2+储存的酸性c端(291~400 氨基酸残基)及中间富含脯氨酸而形成的具伸出式结构的P 端(181~290 氨基酸残基)。 3 个结构域均具有各自特殊的功能,N 端及P 端主要发挥分子伴侣的作用,C 端的作用主要为调节ER 中的Ca2+浓度, 保持细胞内Ca2+稳态,CALR 基因缺失将减少ER 内Ca2+的储存量。CALR C 端的终点为ER 滞留信号(KDEI) 肽,KDEL 可使CALR 从高尔基体回到ER,阻止其分泌至ER 外,具有靶向定位作用。多项研究发现CALR 突变呈阳性MPN 患者骨髓细胞中突变型CALR 大部分定位于ER 内[6]。 同时,CALR 介导的Ca2+稳态的调节可影响多种细胞功能, 包括巨核细胞分化成熟及血小板的形成、 整合素介导的信号转导、免疫应答、细胞凋亡、增殖及吞噬作用、介导伤口愈合及纤维化。 早期研究证实BCR/ABL1 阴性MPN 患者存在JAK2V617 突变。Kampfl 等[6]和Nangalia 等[7]采用外显子测序的方法在JAK2/MPL 阴性的大部分标本中检测到CALR 第9 个外显子突变。并对大样本健康人群进行CALR 目标基因检测,结果发现在健康个体对照组、淋巴系肿瘤、急性白血病及实体肿瘤中均未见CALR 基因突变。 结果提示CALR 基因突变为JAK2 及MPL 基因突变阴性的ET 及PMF 的特异性分子标志物。 因CALR 基因突变均位于第9 个外显子, 本研究采用直接检测第9 个外显子的方法在JAK2 基因突变阴性的ET 患者中检测到CALR 突变率为57%;23 例PMF 患者中8 例检测出CALR 基因突变(突变率35%);研究表明,CALR 基因突变不会发生在PV 患者中, 本组22 例患者中均未检测到CALR 基因突变也证实了这一观点。 2014 年,Tefferi等[8]检测了576 例ET 患者中,CALR 的突变率为15%;Rumi 等[9]检测了745 例患者,CALR 的突变率为24%;Chi 等[10]检测了289 例患者,CALR 的突变率为9%;Kim 等[11]检测CALR 突变率为12.6%。 本实验中ET 患者CALR 的突变率为31%,在JAK2/MPL 阴性的ET患者中突变率57%,而国内学者报道436 例亚洲人CALR基因突变情况,CALR 基因的突变率为22.7%,在JAK2/MPL 阴性的ET 患者中, 其突变率为52.7%,本实验与国内报道相符。 Rumi 等[12]对CALR 突变呈阳性ET 患者研究发现, 极少数患者的CALR 突变的等位基因负荷>75%,该结果推测ET 的发生可能为杂合子克隆逐步积累,最终在骨髓中占据数量优势,特异性刺激巨核细胞导致。本研究显示CALR 突变患者均为杂合子。 本研究中PMF 患者CALR 基因突变(突变率35%),与Langabeer 等[13]报道的25%~35%的突变率相似。研究发现CALR 突变与其临床表现和预后有重要的相关性。 在ET 和PMF 患者中,CALR 基因突变PMF 患者较JAK2 突变者血小板计数更高、年龄更小、血红蛋白更低,白细胞计数更低,PMF 患者具有更好的生存率[14],本研究中患者也具有以上临床特点。有文献报道发生CALR 和JAK2 突变者发生心血管事件的概率是13.4%和30.1%,10 年血栓症累计发生率分别为5.1%和14.5%。 在PMF 患者中,Tefferi 等[8]在254 例标本中筛查了一些与MPN 相关的基因突变,发现他们与CALR 突变没有显著的分子或遗传学关联。 Tefferi 等[15]也报道在PMF 患者中,发生1 型CALR 突变者比2 型突变者有更好的预后。 由本组实验可以看出,CALR 是MPN 中较易发生突变的基因,可将CALR 突变检测纳入MPN 诊断的常规指标。 在临床上可以遵循以下思路考虑对MPN 的诊断[16-20]:①由于CALR 突变不发生在PV 的患者,所以它不能用来筛查PV 或PV 后骨髓纤维化的疑似患者;②CALR、JAK2 和MPL 突变是互相排斥的, 对已知发生了JAK2 或MPL 突变的患者无需筛查CALR 突变;③由于MPL 突变率在三者中最低, 对ET 或PMF 的疑似病例,应先行JAK2V617 突变筛查,若阴性再行CALR突变筛查,CALR 阴性则行MPL 突变筛查。 尽管CALR 基因突变等为疾病的诊断提供了较为特异的分子指标,但仍有10%的ET 和PMF 患者需要结合骨髓病理检查结果加以诊断。
综上所述,CALR 基因突变是JAK2V617F 突变阴性的MPN 特异性分子标志物。 将CALR 基因突变检测纳入MPN 诊断标准可以提高诊断的准确性减少漏诊率。 CALR 基因突变的检测有助于JAK2V617F 突变阴性的MPN 的鉴别诊断, 对CALR 基因突变功能的进一步研究可望找到JAK2V617 突变阴性MPN 的分子治疗靶标。
[1] Campbell PJ,Green AR.The myeloproliferative disorders[J].N Eng J Med,2006,355(24):2452-2466.
[2] Levine RL,Gilliland DC. Myeloproliferative disorders [J].Blood,2008,112(6):2190-2198
[3] 刘樱子.CALR 基因突变在骨髓增殖性肿瘤中的进展[J].国际输血及血液学杂志,2014,37(6):556-560
[4] Pikman Y,Lee BH,Mercher T, et al. MPLW515L is a novel somatic activating mutation in myelofibrosis with myeloid metaplasia [J]. PLoS Med,2006,3(7):e270.
[5] 王婕妤,艾晓菲,徐俊卿,等.Ph 染色体阴性骨髓增殖性肿瘤患者JAK2 基因第12 外显子突变研究[J].中华血液学杂志,2012,33(9):705-709.
[6] Klampfl T,Gisslinger H,Harutyunyan AS,et al. Somatic mutations of calreticulin in myeloproliferative neoplasms[J].Engl J Med,2013,369(25):2379-2390.
[7] Nangalia J,Massie CE,Baxter EJ,et al. Somatic CALR mutations in myeloproliferative neoplasms with nonmutated JAK2 [J]. N Engl J Med,2013,369(25):2391-2405.
[8] Tefferi A,Lasho TL,et al.CALR vs JAK2 vs MPL-mutated or triple-negative myelofibrosis:clinical,cytogenetic and molecular comparisons [J]. Leukemia,2014,28(7):1472-1477.
[9] Rumi E,Pietra D,ferretti V,et al. JAK2 orCALR mutation status defines of essential thromboeythemia with substantially Different clinical course and outcomes[J].Blood,2014,123(10):1544-1551.
[10] Chi J,Nicolaidou V,Nicolaidou V,et al. Calreticulin exon 9 frameshift mutations in patients with thrombocytosis [J].Leukemia,2013,28(5):1152-1154.
[11] KimSY,ImK,ParkSN,etal.CALR,JAK2,and MPL mutation profiles in patients with four different subtypes of myeloproliferative neoplasms:primary myelofibrosis,essential thrombocythemia,polycythemiavera,andmyeloproliferative neoplasm,unclassifiable [J]. Am J Clin Pathol. 2015,143(5):635-644.
[12] Rumi E,Pietra D,Ferretti V,et al.JAK2 or CALR mutation status defines subtypes of essential thrombocythemia with substantially different clinical course and outcomes [J].Blood,2014,123(10):1544-1551.
[13] Langabe er SE,Andrikovics H, Asp J,et al. Molecular diagnostics of myeloproliferative neoplasms [J]. Eur J Haematol EUR,2015.doi:10.1111/ejh.12578. [Epub ahead of print]
[14] Jones AV,Ward D,Lyon M,et al. Evaluation of methods to detect CALRmutationsinmyeloproliferativeneoplasms[J].Leuk Res,2015,39(5):530-535.
[15] Tefferi A,Lasho TL,Finke C,et al.Type 1 vs 2 calretieulin mutations in primary myelofibrosis:differences in phenotype and prognostic impact [J]. Leukemia,2014,28(7):1568-1570.
[16] 谭栩,杨泽松,彭曦,等.原发性骨髓纤维化的治疗进展[J].疑难病杂志,2014,13(5):542-545.
[17] 邢莉民,邵宗鸿.BCR/ABL 阴性骨髓增殖性肿瘤血管新生的研究现状[J].中华医学杂志,2015,95(18):1432-1434.
[18] 张群峰,刘维薇,关明,等.骨髓增殖性肿瘤的新分子标志物钙网蛋白基因突变[J].中华检验医学杂志,2014,(9):649-652.
[19] 欧阳苑,乔纯,王菊娟,等.BCR-ABL 阴性MPN 患者CALR、JAK2 及MPL 基因突变分析[J].中华医学杂志,2015,95(18):1369-1373.
[20] Tefferi A,Pardanani A. CALR mutations and a new diagnostic algorithm for MPN [J]. Nat Rev Clin Oncol,2014,11(3):125-126.
