血清补体C1q肿瘤坏死因子相关蛋白3、补体C1q肿瘤坏死因子相关蛋白9水平对糖尿病视网膜病变患者的影响及相关性研究
2015-10-16王欣荣吕伯昌李海燕
王欣荣++吕伯昌++李海燕

[摘要] 目的 探讨血清补体C1q肿瘤坏死因子相关蛋白(CTRP)3、CTRP9水平对糖尿病视网膜病变(DR)患者的影响及相关性。 方法 选取2014年3月~2015年3月在西安市第四医院眼科及内分泌科住院的DR患者60例为DR组,同时选取50例无DR的2型糖尿病患者为单纯糖尿病组和50例健康体检者为正常对照组。采集基本资料,抽空腹血行CTRP3、CTRP9、空腹血糖(FBG)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)及糖化血红蛋白(HbA1c)等检查,并进行组间比较。采用Pearson相关分析进行DR患者CTRP3、CTRP9的相关性检验,采用Logistic回归分析探讨DR的影响因素。 结果 单纯糖尿病组和DR组的FBG、HbA1c、TG、TC、LDL-C水平均高于正常对照组,HLD-C、CTRP3、CTRP9水平均低于正常对照组,差异有统计学意义(P < 0.05);DR组的病程长于单纯糖尿病组,FBG、HbA1c、TC、LDL-C水平均高于单纯糖尿病组,CTRP3、CTRP9水平均低于单纯糖尿病组,差异有统计学意义(P < 0.05)。Pearson相关分析显示,DR患者CTRP3与CTRP9水平呈正相关关系(r = 0.743,P < 0.05)。多因素Logistic回归分析显示,CTRP3和CTRP9与DR相关,随着CTRP3和CTEP9水平降低,DR的患病风险显著增加(P < 0.05)。 结论 CTRP3和CTRP9与DR发生、发展相关,其水平降低可能导致DR的发生。
[关键词] 糖尿病视网膜病变;补体C1q肿瘤坏死因子相关蛋白3;补体C1q肿瘤坏死因子相关蛋白9
[中图分类号] R587.2 [文献标识码] A [文章编号] 1673-7210(2015)09(b)-0008-04
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病的特异性慢性并发症,在2型糖尿病患者中的发病率为20%~40%,其中8%的患者致盲,其发病率之高,已成为成人致盲的最主要原因[1]。随着糖尿病患病率的不断升高以及糖尿病全身治疗的进步带来患者寿命的延长,DR的发病率在逐渐增高,预计到2030年美国将有2500万例,全世界有3亿例DR患者,给社会和家庭带来沉重的负担[2]。
DR的基本特征包括周细胞选择性丧失,毛细血管基底膜增厚、通透性增高和新生血管形成。DR的具体发病机制尚不明确,炎性反应在其中发挥着重要的作用[3-5]。研究发现,一些脂肪因子如脂联素、瘦素等水平的变化,与DR的发生、发展相关,其中脂联素被认为可延缓DR的发生、发展[6-7]。补体C1q肿瘤坏死因子相关蛋白(C1q tumor necrosis factor related protein,CTRP)家族作为一类多功能的脂肪因子,已被人们发现[8]。国内外研究表明,CTRP家族与脂联素具有同源性,在多个方面具有类似作用,目前尚无CTRP家族成员与DR关系的研究,因此本研究选取CTRP家族中的2个成员:CTRP3和CTRP9作为研究对象,检测其在2型糖尿病合并及未合并DR患者中的表达,旨在探讨CTRP3和CTRP9与DR的关系,为其防治提供理论依据。
1 资料与方法
1.1 一般资料
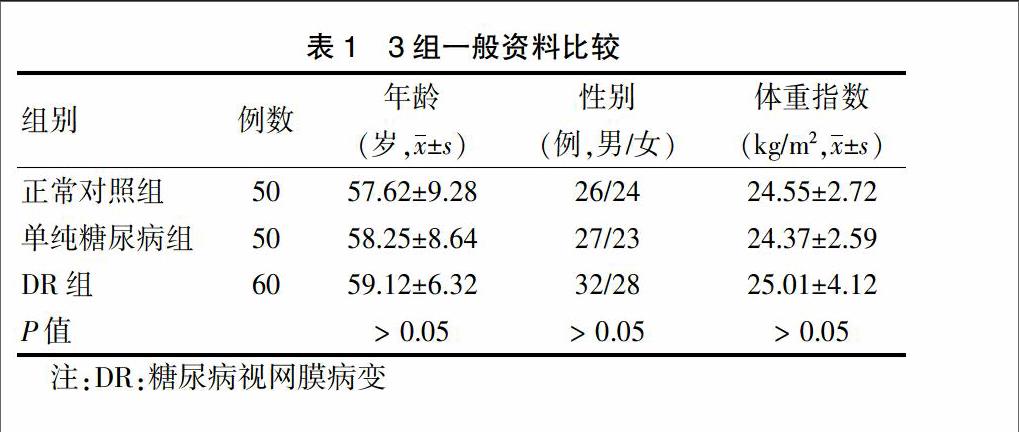
选取2014年3月~2015年3月在西安市第四医院内分泌科及眼科住院的无DR的2型糖尿病患者50例为单纯糖尿病组,DR患者60例为DR组。选取与DR组性别、年龄、体型相匹配的健康体检者50例为正常对照组。3组一般情况比较,差异无统计学意义(P > 0.05),具有可比性,见表1。2型糖尿病患者均符合1999年WHO诊断标准。对所有诊断为2型糖尿病的患者均散瞳后检查眼底,根据2014年我国糖尿病视网膜病变临床诊疗指南标准判定是否合并DR。以上3组患者中,均排除既往有高血压病、冠状动脉粥样硬化性心脏病及脑血管病者。
1.2 方法
所有受检者均进行常规体格检查(身高、体重、血压等)。计算体重指数(kg/m2)=体重/身高2。研究对象均隔夜空腹12 h,次日清晨抽取肘静脉血15 mL。空腹血糖(FBG)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)测定均在PUZS-300系列全自动生化分析仪上完成。糖化血红蛋白(HbA1c)采用高效液相层析法(HPLC)测定,由日本全自动糖化血红蛋白分析仪(ADAMSTMA1c HA-8160)完成。ELISA测定血清CTRP3、CTRP9,试剂盒购自武汉华美生物工程有限公司,采用双抗夹心酶联免疫吸附法测定。所有受试者均检查视力、眼压及眼底。
1.3 统计学方法
采用SPSS 13.0统计软件对数据进行分析和处理,计量资料以均数±标准差(x±s)表示,采用方差分析,组间两两比较采用LSD-t检验,计数资料采用χ2检验,相关性采用Pearson相关分析,多因素采用Logistic回归分析,以P < 0.05为差异有统计学意义。
2 结果
2.1 3组相关观察指标比较
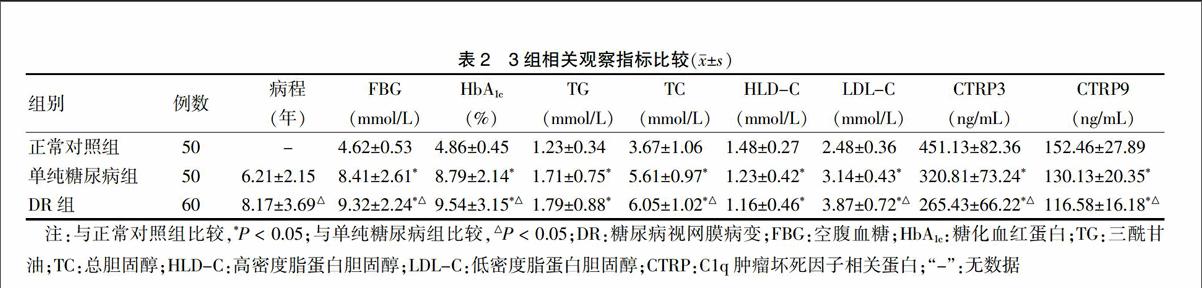
单纯糖尿病组和DR组的FBG、HbA1c、TG、TC、LDL-C水平均高于正常对照组,HLD-C、CTRP3、CTRP9水平均低于正常对照组,差异有统计学意义(P < 0.05);DR组的病程长于单纯糖尿病组,FBG、HbA1c、TC、LDL-C水平均高于单纯糖尿病组,CTRP3、CTRP9水平均低于单纯糖尿病组,差异有统计学意义(P < 0.05)。见表2。
2.2 DR患者CTRP3与CTRP9水平的相关性分析
Pearson相关分析显示,DR患者CTRP3与CTRP9水平呈正相关关系(r = 0.743,P < 0.05)。
2.3 DR影响因素的Logistic回归分析
Logistic回归分析显示,CTRP3和CTRP9与DR相关,随着CTRP3和CTEP9水平降低,DR的患病风险显著增加(P < 0.05)。见表3。
3 讨论
DR是糖尿病特异性的慢性并发症。由于糖尿病健康教育的不足、患者对慢性并发症知识的匮乏及DR早期症状不明显等原因,大多数糖尿病患者未能定期检查眼底,导致很多患者就诊时已发展至DR中晚期,治疗效果不理想,致盲率高。
目前关于DR的机制尚不明确,有多种因子参与该过程的发生、发展,CTRP家族在此过程中的作用也开始被人们所关注。CTRP家族由结构高度保守,与脂联素结构类似的一组蛋白组成[8]。目前认为除脂联素外,CTRP家族至少包括15个成员,即CTRP1~CTRP15,其蛋白结构具有相似性[9]。CTRP3及CTRP9为其中的标志性蛋白,近期被人们关注。作为一种主要的脂肪因子,CTRP家族与脂联素具有同源性,并在内分泌代谢、心血管、免疫等方面发挥着重要作用。CTRP3及CTRP9均具有降低血糖以及动脉粥样硬化保护作用,但对于糖尿病伴动脉粥样硬化患者体内的CTRP3及CTRP9水平的相关研究并不多见。
本研究结果表明,与正常对照组比较,2型糖尿病患者血清CTRP3和CTRP9水平均降低,表明两者水平下降与糖尿病发生存在相关性。Petrson等[10]认为,CTRP3可以降低血浆葡萄糖,且这种作用不依赖于胰岛素,而是通过改善糖异生、减少葡萄糖合成而起到降糖的作用,其在肝细胞葡萄糖糖异生过程中主要作用靶点是抑制重要部位蛋白酶的表达,并通过激活蛋白酶B/蛋白磷酸化(Akt)来抑制肝脏糖异生,以进行葡萄糖消耗,从而降低血糖。然而,CTRP3在2型糖尿病患者体内降低,故其改善糖异生降低葡萄糖作用减弱,可能作为一种新的生物学指标来解释2型糖尿病患者血糖升高的机制。Ma等[11]研究发现,腺病毒为中介的基因转移,可扩增肥胖小鼠血液循环中的CTRP9,在不影响体重及食物摄取量的情况下,大约可上升40%,在此基础上可检测到小鼠体内血糖及胰岛素水平显著降低,其可能直接通过增加肌肉的葡萄糖摄取,从而起到降低血糖的作用,因此CTRP9在糖尿病患者体内减少,可能导致糖尿病持续高血糖状态。
本研究结果发现,DR组与单纯糖尿病组相比,血清CTRP3及CTRP9水平均显著降低,且在校正病程、血脂等因素后,两者与DR之间仍有相关性,提示CTRP3和CTRP9可能与2型糖尿病患者DR相关,随着CTRP3和CTEP9水平降低,DR的患病风险显著增加,机制可能有以下几个方面:
①CTRP3和CTRP9与空腹胰岛素的浓度呈负相关,而与胰岛素敏感性呈正相关[10-12],因此推测CTRP水平降低,引起胰岛素抵抗,从而导致胰岛素敏感性下降,进而引发毛细血管内皮细胞功能失调,致DR发生。
②肿瘤坏死因子-α(TNF-α)在DR患者体内过度活化是DR发生的重要因素,TNF-α通过活化核因子-κB,增加血管内皮生长因子及细胞间黏附分子的表达,参与DR的发生、发展[13]。CTRP3在体内可减少炎症因子,如TNF-α及白细胞介素-6的分泌,抑制核因子-κB等炎症介质,从而部分抑制糖尿病促炎性状态[14-15]。此外,核因子-κB的活化可促进凋亡小体的表达,引起视网膜血管周细胞凋亡和无细胞的毛细血管增加,导致视网膜局部循环障碍[16],抑制核因子-κB活化就可以改善循环障碍,延缓DR发生。
③高血糖状态下糖尿病患者内皮细胞源性血管生成活性物质减弱,导致微血管异常调节和损伤,进而引起DR进展。CTRP9能够通过脂联素受体激活腺苷酸活化蛋白激酶,进而激活内皮细胞中的丝氨酸/苏氨酸蛋白激酶/一氧化氮合酶,增加NO的生成[17]。NO是影响微循环血流的重要因子,可调节微血管的通透性,抑制血小板凝集[18]。当NO产生减少,其扩张血管、调节血压、抑制平滑肌细胞增殖、抗血小板凝聚等作用减弱,使NO对糖尿病视网膜微血管并发症的保护作用减弱,加速DR的发生。
④CTRP可通过抑制细胞因子的作用,使视网膜病理性新生血管减少,减少视网膜内周细胞因缺氧导致退性行变,避免DR发生及发展[19]。体外研究指出,CTRP9通过激活磷酸腺苷激酶A通路来阻断血小板源性生长因子所诱导的平滑肌细胞的增殖与迁移。CTRP3被证实可以减弱血管平滑肌细胞增殖而起到延缓DR进程的作用[20]。
综上所述,血清CTRP3和CTRP9与2型糖尿病及DR的发生、发展具有一定的相关性,且独立于血糖、血脂等因素之外。补充或调节体内合成分泌,增加两者表达水平,有望成为防治2型糖尿病及微血管并发症的新干预措施。
[参考文献]
[1] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[J].中华糖尿病杂志,2014,6(7):447-498.
[2] Yau JW,Rogers SL,Kawasaki R,et al. Global prevalence and major risk factors of diabetic retinopathy [J]. Diabetes Care,2012,35(3):556-564.
[3] Joanna M,Kirti Kaul T,Chopra M,et al. Pathophysiology of diabetic retinopathy [J]. ISRN Ophthalmol,2013,2013:343560.
[4] Tang J,Kern TS. Inflammation in diabetic retinopathy [J]. Prog Retin Eye Res,2011,30(5):343-358.
[5] 王小玲,胡咏梅.糖尿病患者视网膜病变患病率及影响因素分析[J].中国现代医生,2015,53(2):14-16,23.
[6] Gariano RF,Nath AK,D′Amico DJ,et al. Elevation of vitreous leptin in diabetic retinopathy and retinal detachment [J]. Invest Ophthalmol Vis Sci,2000,41(11):3576-3581.
[7] Zietz B,Buechler C,Kobouch K,et al. Serum levels of adiponectin are associated with diabetic retinopathy and with adiponectin gene mutations in Caucasian patients with diabetes mellitus type 2 [J]. Exp Clin Endocrinol Diabetes,2008,116(9):532-536.
[8] Wong GW,Wang J,Hug C,et al. A family of Acrp30/adip-onectin structural and functional paralogs [J]. Proc Natl Acad Sci USA,2004,101(28):10302-10307.
[9] Ahima RS,Qi Y,Singhal NS,et al. Brain adipocytokine action and metabolic regulation [J]. Diabetes,2006,55(Suppl 2):S145-S154.
[10] Petrson M,Wei Z,Wong GW. C1q/TNF-related protein-3(CTRP3),a novel adipokine that regulates hepeatic glucose output [J]. Biol Chem,2010,285(51):39691-39701.
[11] Ma K,Cabrero A,Saha PK,et al. Increased beta-oxidation but no insulin resistance or glucose intolerance in mice lacking adiponectin [J].J Biol Chem,2002,277(38):34658-34661.
[12] Zhikui W,Xia L,Pia S,et al. Targeted deletion of C1q/TNF-related protein 9 increases food intake,decreases insulin sensitivity,and promotes hepatic steatosis in mice [J]. Am J Physiol Endocrinol Metab,2014,306(7):E779-E790.
[13] Joussen AM,Doehmen S,Le ML,et al. TNF-α mediated apoptosis plays an important role in the development of early diabetic retinopathy and long-term histopathological alterations [J]. Mol Vis,2009,15:1418-1428.
[14] Weigert J,Neumeier M,Sch■ffler A,et al. The adiponectin paralog CORS-26 has anti-inflammatory properties and is produced by human monocytic cells [J]. FEBS Lett,2005,579(25):5565-5570.
[15] Weisberg SP,McCann D,Desai M,et al. Obesity is associated with macrophage accumulation in adipose tissue [J]. J Clin Invest,2003,112(12):1796.
[16] Zheng L,Howell SJ,Hatala DA,et al. Salicylate-based anti-inflammatory drugs inhibit the early lesion of diabetic retinopathy [J]. Diabetes,2007,56(2):337-345.
[17] Zheng Q,Yuan Y,Yi W,et al. C1q/TNF-related proteins,a family of novel adipokines,induce vascular relaxation through the adiponectin receptor-1/AMPK/eNOS/nitric oxide signaling pathway [J]. Arterioscler Thromb Vasc Biol,2011,31(11):2616-2623.
[18] Ali TK,Matragoon S,Pillai BA,et al. Peroxynitrite mediates retinal neurodegeneration by inhibiting nerve growth factor survival signaling in experimental and human diabetes [J]. Diabetes,2008,57(4):889-898.
[19] Uemura Y,Shibata R,Ohashi K,et al. Adipose-derived factor CTRP9 atenuates vascular smooth muscle cell proliferation and neointimal formation [J]. FASEB J,2013,27(1):25-33.
[20] Maeda T,Wakisaka S. CTRP3/cartducin is induced by transforming growth factor-beta1 and promotes vascular smooth muscle cell proliferation [J]. Cell Biol Int,2010,34(3):261-266.
(收稿日期:2015-06-15 本文编辑:李亚聪)
