叔丁基过氧化氢诱导小梁网细胞氧化应激模型的建立
2015-01-16杨玉霞黄晶晶钟毅敏
杨玉霞 刘 杏 黄晶晶 钟毅敏 肖 辉
氧化应激的概念源自人类对衰老的研究。1956年,Harman[1]将衰老和氧化联系起来,提出了衰老的自由基学说。他认为自由基(free radical)包括O2-及其衍生物通过攻击生物高分子对组织细胞造成的损伤是导致衰老的原因,也是导致多种疾病的重要因素。1990 年,Sohal 等[2]提出的氧化应激概念,补充和发展了自由基学说,认为机体细胞存在着氧化系统和抗氧化系统的平衡,年轻的细胞维持着氧化和抗氧化的平衡,但是如果氧化应激过多,细胞则需要更多的能量来清除自由基,而细胞可利用的能量是有限的,当自由基超出了细胞抗氧化的能力时,氧化应激导致的损伤便发生了。Bunin[3]研究发现青光眼患者眼内抗氧化屏障功能减退,包括房水中抗坏血酸浓度降低,POAG 小梁组织内GST 含量降低,其幅度与病程相关。青光眼患者房水内总抗氧化还原电位(TRAP)较白内障患者减少64%,且与SOD 和GST过氧化物酶活性增加相关[3,4]。Izzotti 等[5]认为,氧化损伤正是原发性开角型青光眼发病机制中“青光眼链”的开始。为了进一步研究小梁细胞氧化应激损伤的机制,笔者建立小梁细胞(immortalized human trabecular meshwork cells,iHTM)的叔丁基过氧化氢(tert-butyl hydroperoxide,tBHP)氧化刺激模型,并观察氧化应激后小梁细胞活性、细胞活性氧、蛋白酶体复合物活性以及细胞凋亡的变化情况。
材料与方法
1.试剂:正常人小梁细胞系iHTM 为加拿大魁北克Laboratory of Ocular Genetics and Genomics 的Vincent Raymond 教授所赠。DMEM/F12 培养基,胎牛血清(fetal calf serum,FCS)均购自Gibco 公司。噻唑蓝(3,24,5 dimethyliazol 22,5 diphenyl tetrazolium bromide,MTT)、Hochest33258、tBHP 购自美国Sigma-Aldrich 公司,多聚甲醛购自北京化工厂,活性氧检测试剂盒购自中国碧云天生物技术研究所,蛋白酶体复合物检测试剂盒购自美国Promega 公司,Annexin-Ⅴ/PI 凋亡检测试剂盒购自美国BioVision 公司。酶联免疫检测仪为美国BioTek 公司,激光共聚焦荧光显微镜为德国Zeiss 公司(LSM 510 Meta 型)。美国BD 公司FACSAria 型流式细胞仪和BD FACSiva software 数据分析软件。
2.实验分组:阴性对照组(control)为正常培养的细胞,不用tBHP 进行处理。tBHP 处理1h 组(tBHP1h):为含200μmol/L tBHP 的DMEM 工作液培养1h。tBHP 处理2h 组(tBHP2h):为含200μmol/L tBHP 的DMEM 工作液培养2h。
3.MTT 法检测tBHP 刺激后小梁细胞的活性:将细胞按上述方法分别处理后,调节细胞浓度为1 ×105/ml,取80μl 加入96 孔板中,加入培养液至180μl,再加入MTT 液20μl,,每一处理条件设6 个重复孔,同时设置调零孔(只加培养基、MTT、二甲基亚砜)。继续培养4h 后弃去上清液,每孔加入二甲基亚砜(DMSO)200μl,充分混匀,在酶联免疫检测仪上测定每孔的吸光度(A 值),波长为490nm,以反映活细胞的数目。
4.流式细胞术检测tBHP 刺激后小梁细胞活性氧水平:将iHTM 细胞接种于6 孔板中,待细胞长至80%融合,去除细胞培养液,每孔加入1ml 终浓度为10μmol/L 的DCFH-DA。将细胞置于37℃细胞培养箱内孵育20min。用无血清细胞培养液洗涤细胞3 次,充分去除未进入细胞内的DCFH -DA。按前面所述,加入tBHP 工作液,待培养1h 和2h 后,收集细胞进行流式细胞仪检测。
5.Suc-LLVY-GloTM substrate 检测tBHP 刺激后小梁细胞糜蛋白酶样蛋白酶体复合物的活性:将iHTM 细胞以5 ×104/ml 的密度接种在96 孔的白板中,每孔200μl。待细胞生长至80%融合,使用tBHP 对细胞进行刺激,如前所述。使用美国Promega 公司的Chymotrypsin-like Cell-Based Assays 检测糜蛋白酶样蛋白酶体复合物的活性。操作步骤依试剂盒说明进行,使用酶标仪检测荧光强度(RLU),RLU 的高低反映了糜蛋白酶样蛋白酶体活性的强弱。
6.Hoechst33258 检测tBHP 刺激后小梁细胞的凋亡:将细胞按上述方法分别处理后,收集细胞,PBS 洗涤,吹散,用微量加样枪滴片,风干,甲醇固定。水洗3min,用Hoechst 33258 染色5min,晾干,甘油封片。共聚焦显微镜下观察。
7.流式细胞术检测tBHP 刺激后小梁细胞的凋亡:将细胞按上述方法分别处理后,收集细胞(细胞数量≥1 ×109个/升)。取1ml 细胞悬液按Annexin-Ⅴ/PI 双染试剂盒操作说明进行检测。1h 内使用流式细胞检测仪进行定量检测,并进行数据分析。
8.统计学方法:本研究所涉及的组间之间的比较均采用SPSS 16.0 统计分析软件进行分析,数据结果以均数±标准差(±s)表示,采用方差分析(one - way ANOVA)进行组间比较。以P <0.05 为差异有统计学意义。
结 果
1.tBHP 刺激后小梁细胞形态学的改变:正常培养的小梁细胞呈梭形,折光性好,贴壁良好;tBHP 处理1h 后,部分细胞变圆、脱落、皱缩;tBHP 处理2h后,大部分细胞变圆、皱缩、悬浮于培养液中(图1)。
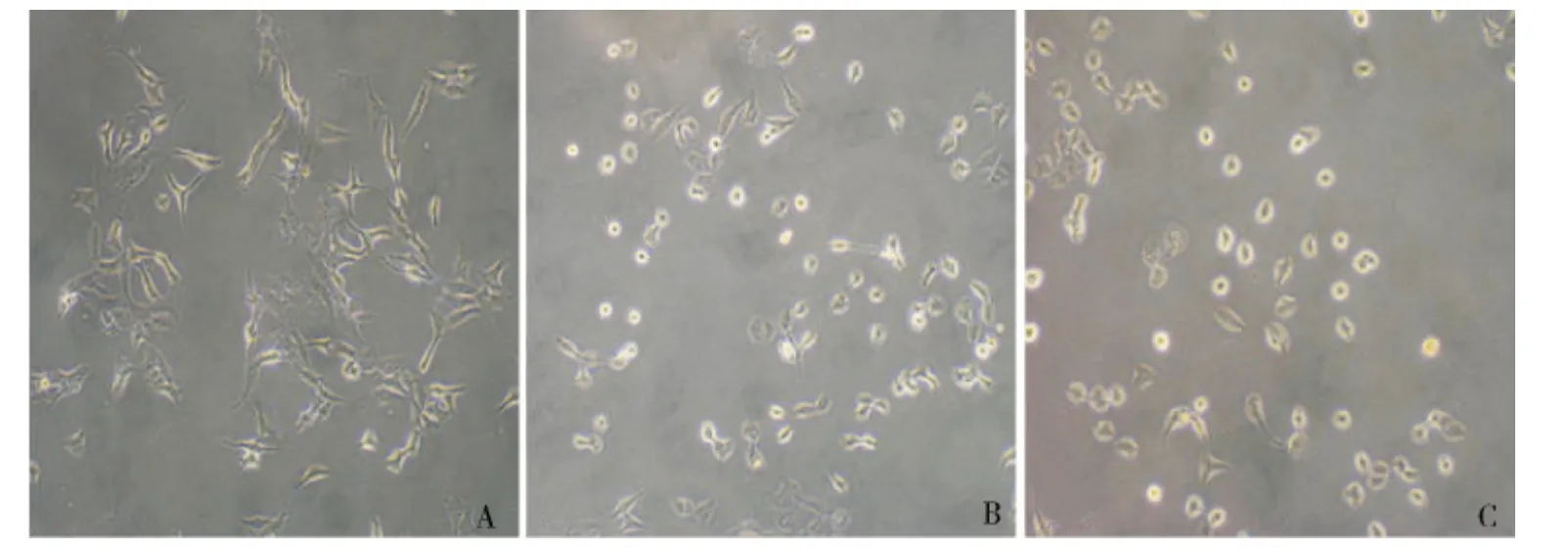
图1 经tBHP 处理后小梁细胞形态学改变(×100)
2.tBHP 刺激后小梁细胞活性的改变:设对照组细胞活性为100%,则tBHP1h 组细胞活性为69.3% ±1.5%;tBHP2h 组细胞活性为57.9% ±2.2%(表1)。经one-way ANOVA 分析,3 组间细胞活性差异有统计学意义(F=602.327,P =0.000)。进一步对各组间的细胞活性进行两两比较,结果为对照组与tBHP1h 组和tBHP2h 组比较、tBHP1h 组与tBHP2h 组比较,各组间差异均有统计学意义(P 均=0.000)。
表1 tBHP 刺激后小梁细胞的改变(±s)

表1 tBHP 刺激后小梁细胞的改变(±s)
组别 细胞活性(%) 活性氧水平 凋亡率(%)蛋白酶体活性(%)100 1 3.0% ±1.8 100 tBHP1h 69.3 ±1.5 53.5 ±1.8 28.23 ±3.2 70.6 ±0.9 tBHP2h 57.9 ±2.2 121.8 ±4.2 39.2 ±5.9 74.9 ±0.5 F对照组602.3 528.4 67.8 783.5 P 0.000 0.000 0.000 0.000
3.tBHP 刺激后小梁细胞活性氧的改变:将对照组ROS 水平设为1,则tBHP1h 组ROS 水平为对照组的53.5 ±1. 8 倍;tBHP2h 组ROS 水平为对照组的121.8 ±4.2 倍(表1)。将对照组ROS 水平设为1,则tBHP1h 组ROS 水平为对照组的53.47 ±1.75 倍;tBHP2h 组ROS 水平为对照组的121. 81 ±4. 2 倍;经one-way ANOVA 分析,3 组间细胞ROS 水平差异有统计学意义(F =528.366,P =0.000)。进一步对各组间的ROS 水平进行两两比较,结果为对照组与tBHP1h 组和tBHP2h 组比较、tBHP1h 组与tBHP2h 组比较,P 均=0.000,各组间差异均有统计学意义。
4.tBHP 刺激后小梁细胞糜蛋白酶样蛋白酶体复合物活性的改变:将对照组小梁细胞糜蛋白酶样蛋白酶体复合物活性的荧光强度设为100%,则tBHP1h组小梁细胞糜蛋白酶样蛋白酶体复合物活性较对照组下降70.6% ±0.9%;tBHP2h 组小梁细胞糜蛋白酶样蛋白酶体复合物活性较对照组下降74. 9% ±0.5%(表1)。将对照组小梁细胞糜蛋白酶样蛋白酶体复合物活性的荧光强度设为100%,则tBHP1h 组小梁细胞糜蛋白酶样蛋白酶体复合物活性较对照组下降70.59% ±0.88%;tBHP2h 组小梁细胞糜蛋白酶样蛋白酶体复合物活性较对照组下降74. 93% ±0.54%,对3 组间的小梁细胞糜蛋白酶样蛋白酶体复合物活性进行one -way ANOVA 分析,差异有统计学意义(F=783.469,P =0.000)。进一步对各组的小梁细胞糜蛋白酶样蛋白酶体复合物活性进行两两比较,结果为对照组与tBHP1h 组和tBHP2h 组比较,P均=0.000;tBHP1h 组与tBHP2h 比较,差异均有统计学意义(P=0.043)。
5.Hoechst33258 染色观察tBHP 刺激后小梁细胞凋亡:激光共聚焦荧光显微镜观察正常培养的小梁细胞,细胞核Hoechst33258 染色呈较均匀的蓝色,凋亡细胞少见。经过tBHP 处理1h,部分小梁细胞发生凋亡,细胞核变小,Hoechst33258 染色呈亮白色;经tBHP 处理2h,凋亡细胞数量明显增加(图2)。
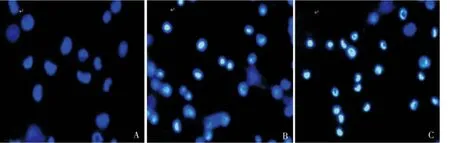
图2 激光共聚焦荧光显微镜检测tBHP 刺激前后小梁细胞的凋亡
6. 流式细胞术定量检测tBHP 刺激后小梁细胞的凋亡比例:经流式细胞术定量检测,在正常对照组iHTM 细胞中,凋亡细胞比例为3.0% ±1.8%。tBHP 1h 组凋亡细胞比例为28.23% ±3.20%,凋亡以晚期凋亡为主;tBHP 处理2h 组凋亡细胞比例为39.2% ±5.9%,且凋亡细胞以晚期凋亡和细胞坏死为主;凋亡细胞比例比对照组和tBHP1h 组明显增加(图3、表1)。将3 组间细胞凋亡比例进行one - way ANOVA分析,差异有统计学意义(F =67.784,P =0.000)。进一步将各组间的细胞凋亡比例进行两两分析,结果分别是对照组与tBHP1h 组和tBHP2h 比较,P 均=0.000;tBHP1h 组与tBHP2h 组比较,差异均有统计学意义(P=0.015)。
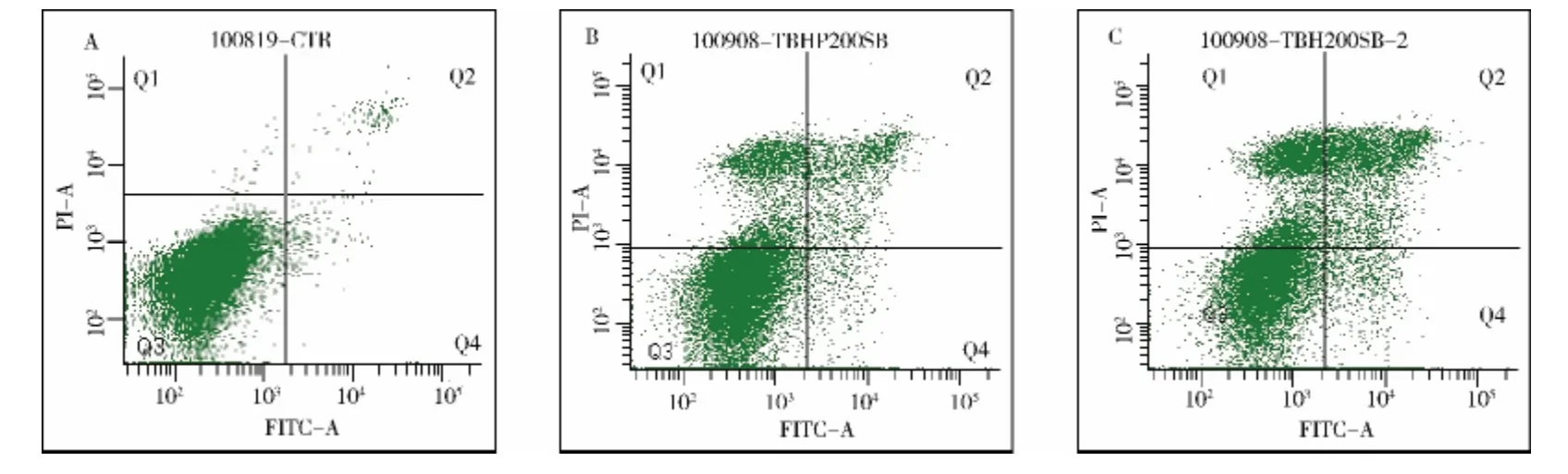
图3 tBHP 刺激后小梁细胞凋亡的变化
讨 论
1.氧化损伤对小梁细胞形态改变的影响:已有研究发现氧化应激是POAG 疾病发生、发展的一个重要因素。Sacca 等[6]报道氧化应激可能通过损伤小梁网,而导致眼压升高和青光眼视神经损害的进展。在Izzotti 等[7]的一项病例对照研究中,他们检测了包括了79 名POAG 患者和156 名正常对照者的线粒体DNA 损伤情况,发现氧化损伤在青光眼患者线粒体损伤以及启动细胞凋亡和细胞丢失方面起了重要作用。Liu 等[8]报道在小鼠的急性高眼压模型中,眼压升高后数小时内视网膜神经节细胞即发生氧化损伤,说明氧化损伤在青光眼视神经病变早期即产生了影响。周琦等[9]报道氧化损伤可以使猪小梁细胞黏附因子ICAM-1 下降以及Luna 等[10]发现氧化应激可以使小梁细胞细胞外基质增加,基质蛋白酶含量下降。笔者发现培养的人小梁细胞经tBHP 刺激后,细胞变圆、收缩,由贴壁状态变为悬浮状态,并且随着刺激时间的延长,细胞活性变的越来越差。
2.氧化损伤对小梁细胞活性的影响:体外诱导小梁网细胞氧化应激可使其发生类似POAG 的改变,如细胞外基质堆积、细胞溶解死亡、细胞骨架结构紊乱、脂褐素增加等,如果用抗氧化剂和降眼压药物预处理则可减轻这种改变[5]。持续的ROS 可破坏线粒体膜电位,最终导致小梁网损伤,房水流出受阻。对POAG 患者的研究发现,ROS 引起的小梁细胞DNA 的损伤与眼压的升高和视野的丧失显著相关。在小梁网氧化应激过程中,持续的活性氧刺激使负调控细胞外基质(extracellular cell matrix,ECM)相关基因表达降低,从而促进了小梁网处ECM 沉积,房水流出受阻。笔者用tBHP 作为氧化应激的刺激源,对培养的小梁细胞进行刺激,作用1h 后细胞活性下降30.70% ±1.50%,刺激2h 后,细胞活性进一步下降(42.12% ±2.20%),说明氧化应激损伤具有时间依赖性,随着刺激时间的延长,tBHP 对细胞造成的损伤加重。活性氧(ROS)是指化学性质活跃的含氧原子或原子团,超氧自由基(O-2)、过氧化氢(H2O2)、羟自由基(·OH)等。活性氧是细胞信号转导必需的物质,但是过量的活性氧也会损伤线粒体、蛋白质以及核酸,对细胞造成损伤。笔者发现tBHP 刺激小梁细胞后可使细胞的活性氧增加,刺激1h 后增加53.47 ±1.75 倍,刺激2h 后增加121.81 ±4.20 倍,同样随着刺激时间的延长,细胞活性氧水平增加。如前所述,小梁细胞经tBHP 处理后可发生细胞变圆、收缩、由贴壁状态变为悬浮状态,细胞活性也显著下降,这些可能都与ROS 的增加有关。
3.氧化损伤对小梁细胞蛋白酶体复合物活性的影响:蛋白酶体是相对分子质量为700kDa 的复合体,包含糜蛋白酶样、胰蛋白酶样、天冬氨酸特异性蛋白水解酶样3 种蛋白酶活性。蛋白酶体是细胞内蛋白质降解的重要途径,也是清除细胞内变性受损蛋白质的主要工具,它的活性反映了细胞对抗损伤的能力。泛素蛋白酶体系统功能的降低可影响眼科的多种疾病如视网膜色素病变,黄斑变性,青光眼,糖尿病视网膜病变等[11]。Guo 等[12]发现在晶状体上皮细胞的增殖和分化过程均需要蛋白酶体的参与。张铁英等[13]研究发现与透明晶状体相比,白内障晶状体上皮内蛋白酶体的糜蛋白酶样、胰蛋白酶样酶活性明显降低,并认为蛋白酶体活性降低可能在老年性白内障的形成中起重要的调节作用。Zhang 等[14]报道40 ~50mmol/L 的H2O2可引起体外培养的人视网膜色素上皮细胞中蛋白酶体活性的明显下降。Caballero等[15]报道将人小梁细胞培养于40%O2环境中,可以引起小梁细胞蛋白酶体活性的降低。笔者使用能被糜蛋白酶样水解酶的底物Suc -Leu -Leu -Val-Tyr-AMC (LLVY)来检测糜蛋白酶样蛋白酶的活性,结果表明培养的人小梁细胞经tBHP 刺激后1h 后,细胞糜蛋白酶样蛋白酶体的活性下降70. 59% ±0.88%,刺激2h 后进一步下降(74.93% ±0.54%)。在氧化应激后,蛋白酶体复合物活性下降,一方面可能是因为蛋白酶体复合物结合了大量受氧化损伤的蛋白质,造成的蛋白酶体的转运饱和;另一方面可能是由于tBHP 直接造成了蛋白酶体复合物的氧化损害,导致了蛋白酶体复合物功能的下降。蛋白酶体复合物功能下降,细胞内受损蛋白无法及时被降解,可以加剧氧化应激对小梁网的损伤。
4.氧化损伤对小梁细胞凋亡的影响:凋亡不同于坏死,坏死是由损伤因子引起的被动死亡,因为坏死的细胞常常要释放出内含物,所以一般会引起炎症。而凋亡是细胞的程序化死亡过程,是能量依赖的主动的死亡过程,由凋亡通路引起,不产生炎性反应。在青光眼患者,不论视网膜还是眼前段小梁网组织都存在较高的氧化应激水平[16]。POAG 患者的小梁网组织存在着诸多形态学和生物学的异常,如细胞丢失较多,细胞骨架的改变,细胞老化现象以及亚临床炎症的表现。目前认为持续的氧化应激导致了这些改变[17]。笔者通过tBHP 氧化刺激体外培养的小梁细胞,发现tBHP 刺激1h 后,凋亡细胞比例为28.23% ±3.23%,刺激2h 后,凋亡细胞比例为39. 20% ±5.91%,随着刺激时间的延长,凋亡细胞增加明显;说明小梁细胞的氧化应激加剧了细胞的凋亡,从而造成小梁网功能损伤。
笔者的研究表明,小梁细胞经tBHP 刺激后,细胞ROS 水平增加,细胞凋亡比例增加,细胞蛋白酶体复合物的活性降低,小梁细胞活性降低,上述改变与刺激时间相关,随着刺激时间延长,上述改变更加显著。同时笔者发现tBHP 直接造成的细胞坏死并不多,说明tBHP 可用于小梁细胞氧化应激损伤的模型建立,并且是一种易于诱导小梁细胞凋亡的氧化剂。
1 Harman D. Aging:a theory based on free radical and radiation chemistry[J]. J Gerontol,1956,11(3):298 -300
2 Sohal RS,Allen RG. Oxidative stress as a causal factor in differentiation and aging:a unifying hypothesis[J]. Exp Gerontol,1990,25(6):499 -522
3 Bunin AI. Pathogenetic factors of destructive process in trabecular tissues in primary open-angle glaucoma[J]. Vestn Oftalmol,2000,116(5):24 -27
4 Ferreira SM,Lerner SF,Brunzini R,et al. Oxidative stress markers in aqueous humor of glaucoma patients[J]. Am J Ophthalmol,2004;137(1):62 -69
5 Izzotti A,Bagnis A,Saccà SC.The role of oxidative stress in glaucoma[J]. Mutat Res,2006,612(2):105 -114
6 Sacca SC,Pascotto A,Camicione P,et al. Oxidative DNA damage in the human trabecular meshwork -clinical correlation in patients with primary open-angle glaucoma[J].Arch Ophthalmol 2005,123:458-463
7 Izzotti A,Sacca SC,Longobardi M,et al. Mitochondrial damage in the trabecular meshwork of patients with glaucoma[J]. Arch Ophthalmol,2010,128(6):724 -730
8 Liu Q,Ju WK,Crowston JG,et al. Oxidative stress is an early event in hydrostatic pressure induced retinal ganglion cell damage[J].Invest Ophthalmol Vis Sci,2007,48 (10):4580 -4589
9 周崎,刘玉琴,赵家良,等. 氧化应激对猪眼小梁细胞内皮细胞白细胞黏附分子-1 表达的影响[J]. 中国医学科学院学报,2007,29(3):394 -397
10 Luna C,Li G,Qiu J,et al. Role of miR -29b on the regulation of the extracellular matrix in human trabecular meshwork cells under chronic oxidative stress[J]. Mol Vis,2009,28(15):2488 -2497
11 Campello L,Esteve-Rudd J,Cuenca N,et al. The ubiquitin-proteasome system in retinal health and disease[J]. Mol Neurobiol,2013,47(2):790 -810
12 Guo W,Shang F,Liu Q,et al. Ubiquitin-proteasome pathway function is required for lens cell proliferation and differentiation[J].Invest Ophthalmol Vis Sci,2006,47(6):2569 -2575
13 张铁英,刘奕志,吴明星,等. 老年性白内障与透明晶状体上皮内蛋白酶体活性的比较[J].眼科学报,2006,22:89 -92
14 Zhang X,Zhou J,Fernandes AF,et al. The proteasome:a target of oxidative damage in cultured human retina pigment epithelial cells[J].Invest Ophthalmol Vis Sci,2008,49(8):3622 -3630
15 Caballero M,Liton PB,Epstein DL,et al. Proteasome inhibition by chronic oxidative stress in human trabecular meshwork cells[J]. Biochem Biophys Res Commun,2003,22;308(2):346 -352
16 Erb C,Heinke M. Oxidative stress in primary open -angle glaucoma[J]. Front Biosci (Elite Ed),2011,3:1524 -1533
17 Babizhayev MA,Yegorov YE. Senescent phenotype of trabecular meshwork cells displays biomarkers in primary open-angle glaucoma[J]. Curr Mol Med,2011,11(7):528 -552
