表面活性蛋白A 不同亚型在脂多糖诱导肾小管上皮细胞IL-8 表达中的作用
2015-01-16胡凤琪
胡凤琪 崔 龙 明 静 袁 海
SP-A 是一种首先发现在肺泡Ⅱ型上皮细胞表达的凝集素,在调节肺天然免疫中发挥着重要作用,可识别和清除多种病原体,增强巨噬细胞及中性粒细胞的吞噬作用,还可通过作用于不同细胞表面受体调节多种炎症因子的表达[1]。SP -A 蛋白包括两个亚型:SP-A1 及SP -A2,本研究组先前的研究已经证实,SP-A 除在肺表达外,在肾脏中也有表达,主要分布于肾小管上皮细胞,且脂多糖(lipopolysaccharide,LPS)可诱导肾小管上皮细胞SP-A1 及SP-A2 的表达升高[2]。笔者进一步研究发现,SP -A/D 双基因敲除小鼠在发生泌尿系感染时其白细胞介素-8(IL-8)分泌较野生型小鼠减少,但其作用机制尚不明确[3]。本研究探讨SP - A 不同亚型对LPS 诱导的HK-2 细胞IL -8 表达的影响,进一步探讨SP -A及其亚型在肾脏炎性反应调节中的作用。
材料与方法
1.材料:人近曲肾小管上皮细胞株HK -2 购自ATCC,DMEM/F12 培养液、胎牛血清购自美国Gibco 公司。LPS O111:B4 购自美国Sigma 公司。Trizol 试剂购自美国Invitrogen 公司;反转录试剂盒及SYBR Green 实时定量PCR 试剂盒购自日本TOYOBO 公司。人IL -8 ELISA 试剂盒购自美国RD 公司。
2.细胞培养与处理:HK-2 细胞培养于含10%胎牛血清的DMEM/F12 培养基中,待细胞达70%融合时,改用无血清培养基培养24h,使细胞同步化。采用1μg/ml 的LPS 刺激转染及对照组HK-2 细胞8h 后检测SP -A1、SP -A2 及IL -8表达水平变化。
3.siRNA 转染HK-2 细胞:转染所用SP -A1 及SP -A2特异性siRNA 购自德国QIAGEN 公司(SP -A1,SI04353202;SP-A2,SI00716590)。按照3 ×105个/孔的密度将细胞种植于6 孔板内,然后将含有150ng 的siRNA 或者用作阴性对照的negative siRNA(Cat. No. SI02693285)分别与15μl HiPerfect转染试剂的混合液加入培养基内,37℃培养箱内转染24h 用于后续实验。
4.实时定量PCR 检测SP -A1、SP -A2 表达:Trizol 法提取细胞RNA,2μgRNA 行反转录,产物即为cDNA。采用25μl反应体系行PCR 扩增,PCR 反应条件:(1)SP-A1:SP-A1 引物上游:5' - AAGCAGCTGGAGGCTCTGT - 3',下游:5' -TGCTCTCACTGACTCACACCA-3',退火温度59.3℃。(2)SP-A2:SP-A2 引物上游:5' -GAGCCTGAAAAGAAGGAGCA-3',下游:5' - TCCAACACAAACGTCCTTCA - 3',退火温度57℃。(3)β - actin:β - actin 引物上游:5' - GTCCACCGCAAATGCTTCTA -3',下游:5' - TGCTGTCACCTTCACCGTTC-3'。
5.ELISA 法检测IL-8 蛋白表达:取细胞上清液,离心去细胞碎片,按ELISA 试剂盒说明书操作,分别检测各组中IL-8 蛋白浓度。
6.统计学方法:采用SPSS 13.0 软件进行统计学分析,各数值用均数±标准差(±s)表示,组间比较采用t 检验,P <0.05 差异有统计学意义。
结 果
1.LPS 刺激对HK -2 细胞SP -A1、SP -A2 表达的影响:实时定量PCR 示,1μg/ml LPS 作用HK -2 细胞8h 可显著增加其SP -A1、SP -A2 mRNA 的表达(P <0.05)。
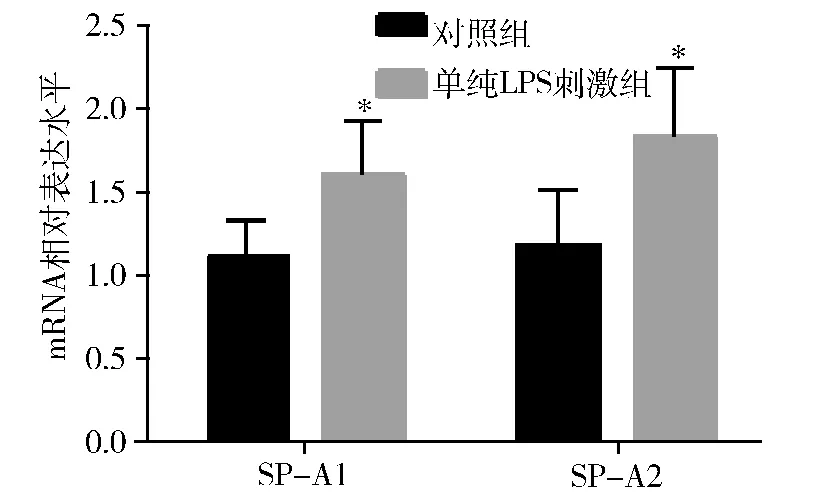
图1 LPS 对HK-2 细胞SP-A1、SP-A2 表达的影响
2.转染siRNA 后各组HK-2 细胞SP-A1、SPA2 mRNA 表达:实时定量PCR 示,HK -2 细胞转染SP-A1 siRNA 后,SP-A1 mRNA 表达水平较未转染组及转染阴性对照siRNA 组显著降低(P <0.05),SP-A2 mRNA 表达水平未见明显变化。转染SP -A2 siRNA 后,SP -A2 表达水平较未转染组及转染阴性对照组显著降低(P <0.05),SP -A1 mRNA 表达水平未见明显变化,转染阴性对照siRNA 不影响SP -A1、SP-A2 mRNA 表达水平(P >0.05,图2)。
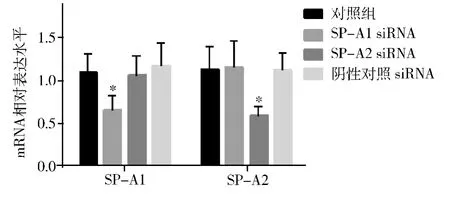
图2 转染不同siRNA 后HK-2 细胞SP-A1、SP-A2 mRNA 表达
3.HK-2 细胞转染不同siRNA 后对LPS 诱导的IL-8 表达的影响:ELISA 示,1μg/ml LPS 作用8h 可显著增加HK-2 细胞IL -8 的分泌(P <0.05)。转染阴性对照siRNA 及SP -A1 siRNA 对LPS 诱导的IL-8 的表达未见明显改变(与单纯LPS 刺激组相比,P 均>0.05),而转染SP -A2 siRNA 则可显著抑制LPS 诱导的IL-8 的表达(P <0.05,图3)。

图3 转染不同siRNA 后对LPS 诱导HK-2 细胞IL-8 表达的影响
讨 论
SP-A 是选择素蛋白家族的成员之一,最早在肺泡Ⅱ型上皮细胞中发现,可降低肺泡表面张力,对于维持肺泡扩张状态有重要作用。同时,SP-A 在天然免疫中也发挥着重要作用,其在炎症状态下可促进NF-κB 的活化,进而促进多种炎性因子的产生[4]。本研究组先前的研究表明,SP-A 在肾脏内主要分布于肾小管上皮细胞,其在动物及人类的泌尿系感染时表达均增加,且SP-A 的基因多态性与泌尿系感染的易感性有关[5,6]。进一步的研究发现,SP -A/D 双基因敲除小鼠对泌尿系感染的易感性增加,其在发生泌尿系感染时IL -8 分泌较野生型小鼠减少[3]。但其具体作用机制及SP-A 亚型在其中的作用目前尚不明确。SP-A 有两个亚型,SP -A1 及SP -A2,关于SP-A 亚型在肾脏炎症中所起的作用,目前研究的较少,值得进一步研究。
既往的研究表明,SP -A1 及SP -A2 在功能上有所不同,其主要区别在于调节炎性因子分泌及增强巨噬细胞吞噬中作用的差异,既往研究发现SP -A2在调节单核细胞IL -8 及TNF -α 分泌中的作用较SP-A1 强[7]。但目前尚无分别特异性针对SP -A1及SP-A2 的抗体,其针对SP-A1 及SP-A2 的mRNA 表达水平变化就显得尤为重要[7]。LPS 可激活肾小管上皮细胞NF-κB,进而诱导IL -8 等多种炎性细胞因子产生。IL -8 是参与机体炎症与免疫的重要细胞因子,与肾脏感染的关系密切,其在泌尿系感染起募集中性粒细胞浸润的作用。本研究发现,LPS可诱导SP -A1、SP -A2 及IL -8 表达上调,这与既往笔者的研究结果相符[2]。本研究中进一步发现,采用特异性siRNA 下调SP -A2 表达可抑制LPS 诱导的肾小管上皮细胞IL -8 的上调,而改变SP -A1表达则未见对LPS 诱导的IL-8 表达有所影响,说明在SP-A 亚型中的SP -A2 可能在LPS 诱导肾小管上皮细胞的炎性因子表达中发挥重要作用,这可能是SP-A/D 双基因敲除小鼠在泌尿系感染时IL -8 分泌不足的机制之一,因LPS 是革兰阴性菌细胞壁的主要成分之一,而SP -A/D 双基因敲除小鼠缺乏了SP-A2 在LPS 诱导IL -8 中的促进调节作用,因此其在感染时IL-8 分泌不足,从而对泌尿系感染的易感性增加。
综上所述,LPS 可诱导HK -2 细胞SP - A1 及SP-A2 表达增加,下调SP -A2 可部分抑制LPS 诱导的肾小管上皮细胞IL -8 的表达,SP -A2 在肾脏炎性反应中发挥重要作用。
1 Seaton BA,Crouch EC,McCormack FX,et al. Structural determinants of pattern recognition by lung collectins[J]. Innate Immun,2010,16(3):143 -150
2 Jiao L,Fengqi H,Guirong W,et al. Lipopolysaccharide-induced expression of surfactant proteins A1 and A2 in human renal tubular epithelial cells[J]. J Inflamm (Lond),2013,10(1):2
3 胡凤琪,袁海,王桂荣,等. 表面活性蛋白A 及D 在小鼠尿路感染中的作用及机制[J].中华肾脏病杂志,2013,29(6):439 -443
4 Gardai SJ,Xiao YQ,Dickinson M,et al. By binding SIRPα or calreticulin/CD91,lung collectins act as dual function surveillance molecules to suppress or enhance inflammation[J]. Cell,2003,115(1):13 -23
5 胡凤琪,丁国华,梁伟,等.全反式维甲酸对肾盂肾炎大鼠表面活性蛋白-A 表达的影响[J].武汉大学学报:医学版,2010,31(1):51-53
6 Jiao L,Fengqi H,Wei L,et al. Polymorphisms in the surfactant protein a gene are associated with the susceptibility to recurrent urinary tract infection in chinese women[J]. Tohoku J Exp Med,2010,221(1):35 -42
7 Floros J,Wang G,Mikerov AN. Genetic complexity of the human innate host defense molecules,surfactant protein A1 (SP -A1)and SP-A2 - -impact on function[J]. Crit Rev Eukaryot Gene Expr,2009,19(2):125 -137
