Ⅱ型ZTC1+1天然澄清剂纯化土茯苓多糖的工艺研究
2015-01-16陈文良陈文龙
陈文良, 陈文龙, 王 敏, 朱 伟*
(1.广州中医药大学第二临床医学院,广东广州510006;2.广东省中医院,广东广州510006)
Ⅱ型ZTC1+1天然澄清剂纯化土茯苓多糖的工艺研究
陈文良1,2, 陈文龙1, 王 敏1, 朱 伟1,2*
(1.广州中医药大学第二临床医学院,广东广州510006;2.广东省中医院,广东广州510006)
目的考察Ⅱ型ZTC1+1天然澄清剂在土茯苓总多糖中的纯化效果。方法采用正交试验设计,以多糖保留率和蛋白清除率为指标,考察天然澄清剂加入量、料液比、纯化时间和温度四个因素的最佳工艺条件。结果Ⅱ型ZTC1+1天然澄清剂纯化土茯苓总多糖的最佳提取工艺为天然澄清剂b组分加入量为2%,a组分为1%,料液比为1∶15,纯化时间120 min,温度为80℃,多糖保留率为94.07%,蛋白清除率为55.59%。结论Ⅱ型ZTC1+1天然澄清剂纯化土茯苓总多糖的工艺简单可靠,合理可行,为土茯苓多糖的纯化和开发利用提供了科学依据。
土茯苓;多糖;正交试验;天然澄清剂;纯化
土茯苓为百合科植物光叶菝葜Smilax glabra Roxb.的干燥根茎,气微,味微甘,涩。具有除湿、解毒、通利关节等功效。可用于治疗梅毒及汞中毒所致的肢体拘挛,筋骨疼痛;湿热淋浊,带下,痈肿,瘰疬,疥癣等[1]。近年来药理与临床研究表明土茯苓在抗动脉硬化,抗癌及治疗心脑血管疾病等方面有良好效果[2],文献表明土茯苓多糖具有增强机体免疫机能及抗癌等多方面的作用[3],其主要成分是己糖和淀粉等,具有很好的开发利用前景。
Ⅱ型ZTC1+1天然澄清剂是新型食品添加剂,由两部分组成。其原理是第一组分加入后,在不同的可溶性大分子间 “架桥”连接,使分子迅速增大,第二组分在第一组分所形成的复合物基础上再 “架桥”,使絮状物尽快形成[4]。第一组分的加入量是第二组分的2倍。Ⅱ型ZTC1+ 1天然澄清剂主要用于除去药液中的蛋白质、鞣质、树脂等胶体不稳定成分,而保留药液中的多糖、高分子物质和可溶性固体物等,且效果优于传统的水提醇沉法,具有简便、有效、价廉、稳定等优点[5]。因此,本实验通过单因素和正交试验设计,对Ⅱ型ZTC1+1天然澄清剂纯化土茯苓多糖的工艺进行了研究,为土茯苓多糖的深入研究奠定基础。
1 仪器与材料
Rotavapor R-215减压旋转蒸发仪(瑞士Buchi公司);VICTOR X5酶标仪(美国PerkinElmer公司);BS224S万分之一电子天平(德国Sartorius公司);XMTD-8222电热恒温水浴锅 (上海精宏实验设备有限公司);B600A医用离心机 (安新县白洋离心机厂);RT-04四两装高速中药粉碎机 (武义县屹立工具有限公司)。
Ⅱ型ZTC1+1天然澄清剂 (天津振天成科技有限公司,批号120726);D-无水葡萄糖对照品 (中国药品生物制品检定所,批号110833-200503);牛血清白蛋白 (国药集团化学试剂有限公司,批号20130121);考马斯亮蓝G-250(上海博谷生物科技有限公司,批号20120307);重蒸苯酚 (北京普博新生物科技有限责任公司,批号PBZ0501);浓硫酸 (优级纯,天津市进丰化工有限公司,批号20110205);磷酸、醋酸、三氯甲烷、正丁醇皆为分析纯。
土茯苓药材(康美药业股份有限公司,批号130800051),经广州中医药大学第二临床医学院陈燕芬主任中药师鉴定为百合科植物土茯苓Smilax glabra Roxb的干燥根茎,符合 《中国药典》2010年版中关于土茯苓药材的要求。
2 方法与结果
2.1 澄清剂的配置 Ⅱ型ZTC1+1天然澄清剂由a,b两组分组成。a组分:精密量取1.0 g a组分,加入少量蒸馏水,搅拌成糊状,再加入蒸馏水配制至100 mL的黏胶液,溶胀24 h后用双层纱布过滤即得。b组分:精密量取1.0 g b组分,加入少量1%醋酸溶液,搅拌成糊状,再加1%醋酸溶液配制成100 mL的黏胶液,溶胀24 h,用双层纱布过滤,即得,保存备用[6]。
2.2 药材的提取 称取土茯苓药材400 g,粉碎,按1∶10比例加入蒸馏水,置于90℃恒温水浴中提取2 h,共提取3次,用纱布滤过,离心,上清液合并,减压浓缩到料液比为1∶2(g/m L),即得土茯苓多糖粗提液,备用。
2.3 澄清剂优化土茯苓多糖粗提液工艺步骤 量取相应料液比的多糖溶液20 mL,于50 mL锥形瓶中,水浴加热到试验温度之后,首先加入b组分,搅匀,每30 min搅动1次,按试验时间加入a组分,搅匀,每30min后搅动1次。按试验时间后取出,定容,离心10min(4 000 r/min),倾出上清液。测定溶液中多糖与蛋白质含有量,并算出其多糖保留率及蛋白去除率[7]。
2.4 多糖的测定
2.4.1 葡萄糖标准曲线的绘制[8]精密称量100.0 mg干燥至恒定质量的D-无水葡萄糖对照品,加适量水溶解,转移至100 mL量瓶中,加水至刻度,摇匀,配成质量浓度为1mg/mL的葡萄糖标准溶液。由1 mg/mL的葡萄糖标准溶液配制质量浓度梯度为500、250、125、62.5、31.25μg/ mL的葡萄糖溶液,分别精密吸取上述配制的500、250、125、62.5、31.25μg/m L的葡萄糖溶液2.0 mL于10 mL玻璃瓶中,然后加入6%苯酚溶液1.0 m L,摇匀,立即加浓硫酸5.0 mL,充分摇匀,室温放置20 min,冷却后于490 nm处测定吸光度,以水作为空白组,以葡萄糖质量浓度 (C)为坐横标,吸光度 (A)为纵坐标,绘制标准曲线,得标准曲线方程:A=0.004 3C+0.041 3,r=0.995 2,表明葡萄糖在31.25~500 mg/L范围内呈良好的线性关系。
2.4.2 样品多糖测定 取经脱蛋白处理后的溶液和未处理的粗提液各1.0 mL,按照上述多糖测定方法,测定样品中多糖的含有量并计算提取率。
2.5 蛋白质的测定[9]
2.5.1 显色剂配置 称取考马斯亮蓝G-250 100.0 mg溶于50.0 mL 95%乙醇中,加入100.0 mL 85%磷酸,摇匀,加水稀释至1 L,避光保存。
2.5.2 蛋白质标准曲线的绘制 精密取牛血清白蛋白25.0 mg,置100mL量瓶中,加水溶解并稀释至刻度,摇匀,制成牛血清白蛋白贮备液 (250 mg/L),吸取贮备液40.0 mL,置100 mL量瓶中,加蒸馏水稀释至刻度,摇匀,即得100mg/L蛋白标准溶液。精密量取蛋白标准溶液0.2、0.4、0.6、0.8、1.0mL,分置10 mL试管中,各加水稀释至1.0 mL,向各管中加入显色剂 (考马斯亮蓝G-250溶液)5.0mL,混匀后,在30℃水浴中保温5 min,用蒸馏水为空白,在波长595 nm处测定吸光度Y,以牛血清白蛋白质量浓度(X)作为横坐标,吸光度(Y)为纵坐标,绘制标准曲线,求出回归方程。得标准曲线方程:Y=0.003 5X+ 0.022 4,r=0.994 9,表明牛血清白蛋白在6.25~200 mg/L范围内呈良好的线性关系。
2.5.3 样品蛋白测定 取经脱蛋白处理之后的溶液和未经处理的粗提液,按照上述蛋白质的测定方法,测定样品中蛋白质的含有量并计算出清除率。
2.6 影响因素和水平的确定[10-11]本实验分别考察澄清剂加入量,料液比,温度,时间对Ⅱ型ZTC1+1天然澄清剂优化土茯苓多糖工艺的影响。a、b组分体积比 (V/V)固定为1∶2,以澄清剂加入量 (mL),料液比 (g/mL),温度 (℃),时间 (min)作为考察因素,每个因素分别设立5个水平 (n=6)。单因素试验影响因素和水平,见表1。
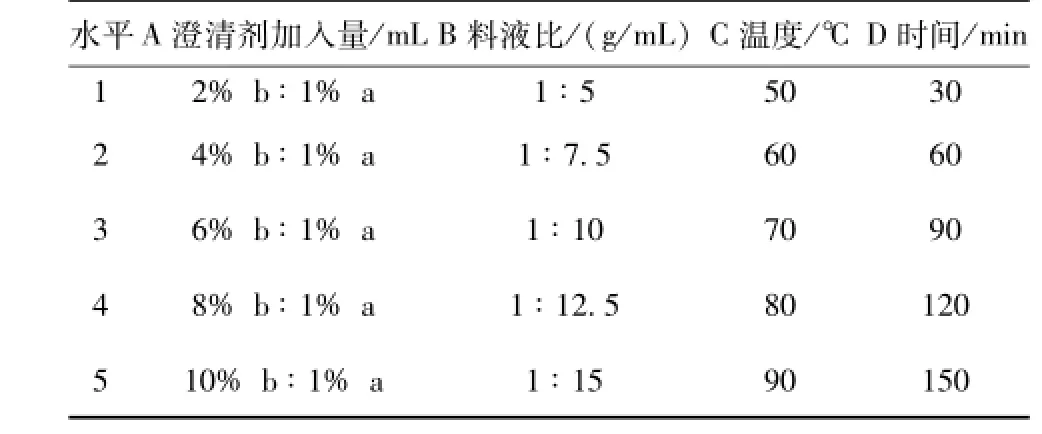
表1 单因素试验影响因素和水平
2.7 单因素试验
2.7.1 澄清剂加入量对Ⅱ型ZTC1+1澄清剂优化土茯苓多糖工艺的影响 量取料液比为1∶10的多糖溶液5份,以温度为70℃,时间为60 min,分别选取澄清剂b组分加入量为多糖溶液体积的2%、4%、6%、8%、10%,按照“2.4”项的方法,求出其多糖保留率及蛋白清除率,见图1。
2.7.2 料液比对Ⅱ型ZTC1+1澄清剂优化土茯苓多糖工艺的影响 分别量取料液比为1∶5、1∶7.5、1∶10、1∶12.5、1∶15的多糖溶液各1份,以温度为70℃,时间为60 min,澄清剂b组分加入量为多糖溶液体积的6%。按照“2.4”项的方法,求出其多糖保留率及蛋白清除率,见图2。
2.7.3 温度对Ⅱ型ZTC1+1澄清剂优化土茯苓多糖工艺的影响 量取料液比为1∶10的多糖溶液5份,以澄清剂b组分加入量为多糖溶液体积的6%,时间为60 min,分别在温度为50、60、70、80、90℃的条件下水浴加热。按照“2.4”项的方法,求出其多糖保留率及蛋白清除率,见图3。
2.7.4 反应时间对Ⅱ型ZTC1+1澄清剂优化土茯苓多糖工艺的影响 量取料液比为1∶10的多糖溶液5份,以澄清剂b组分加入量为多糖溶液体积的6%,温度为70℃,a、b组分反应时间分别为30、60、90、120、150 min。按照“2.4”项的方法,求出其多糖保留率及蛋白清除率,见图4。

图1 澄清剂加入量对Ⅱ型ZTC1+1澄清剂优化土茯苓多糖工艺的影响
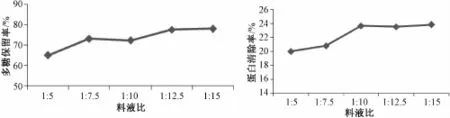
图2 料液比对Ⅱ型ZTC1+1澄清剂优化土茯苓多糖工艺的影响

图3 温度对Ⅱ型ZTC1+1澄清剂优化土茯苓多糖工艺的影响
单因素试验结果显示,各因素对Ⅱ型ZTC1+1澄清剂优化土茯苓多糖工艺均有影响。随着澄清剂加入量逐渐增加,多糖保留率先上升后缓慢下降,在b成分为4%,a成分为2%时达到最高点;蛋白清除率具有一定波动性升降,b成分在2%、4%、8%时清除率较高。随着料液比的逐渐增加,药液浓度逐渐降低,多糖保留率先基本保持不变,等到药液浓度低到一定值后,即在料液比为1∶10之后,多糖保留率明显上升;而蛋白清除率随着料液比的逐渐增加先缓慢上升,在料液比为1∶10后没有明显变化。随着温度的逐渐升高,多糖保留率先上升后下降,在80℃时达到最高点;蛋白清除率也是先上升后下降,在80℃时达到最高点。随着时间的逐渐增加,多糖保留率增加先缓慢上升,在90min达到最高点,而后随时间的增加,多糖保留率没有明显变化;蛋白清除率随着时间的增加先下降,在60 min后没有明显的变化。
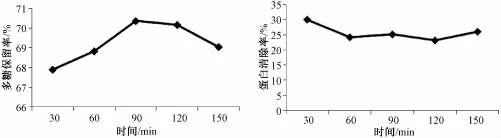
图4 反应时间对Ⅱ型ZTC1+1澄清剂优化土茯苓多糖工艺的影响
2.8 正交试验 根据单因素试验结果,以澄清剂加入量、料液比、温度、时间为考察因素,各选取最佳的3水平,以L9(34)正交表进行试验 (n=6),具体见表2。按照“2.4”项的方法,求出其多糖保留率及蛋白清除率,并进行方差分析。

表2 L9(34)正交试验因素水平
2.8.1 正交试验结果 见表3、表4、表5。

表3 L9(34)正交试验设计与结果

表4 多糖保留率方差分析

表5 蛋白清除率方差分析
由L9(34)正交试验结果 (见表3)的极差R可以看出,四因素对多糖保留率的影响顺序为:澄清剂>时间>温度>料液比;四因素对蛋白清除率的影响顺序为:澄清剂>料液比>时间>温度。
从多糖保留率方差分析 (见表4)可以看出,澄清剂和时间两因素对多糖保留率具有显著性影响,其中澄清剂的影响最大,而料液比和温度几乎没有影响。由蛋白清除率方差分析 (见表5)可以看出澄清剂对蛋白清除率具有显著性的影响,而其他因素对其没有显著性的影响。
综上所述,澄清剂和时间对多糖保留率具有显著性影响,而澄清剂又对蛋白清除率有显著影响。试验中发现,澄清剂b成分为2%时的多糖溶液澄清度好于为4%时,结合单因素结果和从节约成本方面,确定Ⅱ型ZTC1+1天然澄清剂纯化土茯苓多糖的最佳工艺条件为澄清剂加入量b组分为2%,a组分为1%,料液比为1∶15,温度为80℃,反应时间120 min。
2.8.2 验证试验 由正交试验结果得出的提取最佳工艺条件,按照 “2.4”项的方法,平行3次,求出其多糖保留率及蛋白清除率,结果见表6。
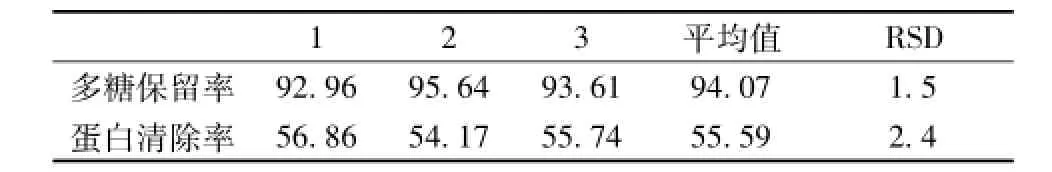
表6 验证试验结果(%)
由表6可以看出,所得的多糖保留率最高,平均值为94.07%,大于正交试验结果,RSD为1.5%;同时蛋白清除率平均值为55.59%,RSD为2.4%,表明该优化条件稳定可行。与正交试验序列号1条件比较,1条件虽蛋白清除率高,达到61.71%的蛋白清除率,但多糖也损失了高达25.47%;验证试验条件的多糖保留率在高达94.07%的同时,蛋白清除率达到了55.59%,只比正交试验1条件少6.12%,相比之下,验证试验条件简单合理,稳定可行。
2.9 对照试验
2.9.1 醇沉法除蛋白 量取料液比为1∶15的多糖溶液50.0mL于500 mL锥形瓶中,缓慢加入4倍量的无水乙醇,并不断混匀,密封,放入4℃冷库静置24 h,倾出上清液,过滤,沉淀用50.0 mL热水溶解后,过滤不溶物,定容至50 mL,即为醇沉后的多糖溶液。按照 “2.4”项的方法,求出其多糖保留率及蛋白清除率。结果显示,醇沉法醇沉一次的多糖保留率平均为64.53%,蛋白清除率平均为63.27%。
2.9.2 Sevag法除蛋白[11]Sevag法试剂的配制:按4∶1的比例分别量取三氯甲烷80.0 mL和正丁醇20.0 mL,充分混匀,密闭保存。量取料液比为1∶15的多糖溶液50.0 mL,按5∶1的比例,加入Sevag试剂10.0 mL,进行脱蛋白处理,充分振荡30~40 min后,离心10 min(4 000 r/min),使分层,分别取上层水相,共脱蛋白6次,取水相定容至50 mL,即为Sevag法除蛋白后的多糖溶液。按照“2.4”项的方法,求出其多糖保留率及蛋白清除率。结果显示,Sevag法萃取6次的多糖保留率平均为65.98%,蛋白清除率平均为62.8%。
由此可见,天然澄清剂最佳纯化条件与醇沉法及Sevag法相比,蛋白清除率少了10%左右,但多糖保留率却相对高了近30%,醇沉法及Sevag法在蛋白清除的同时,多糖损失十分严重。由此可知,天然澄清剂在纯化多糖溶液方面比传统的醇沉法及Sevag法更有优势,效果更明显。
3 讨论
因Ⅱ型ZTC1+1天然澄清剂纯化土茯苓多糖工艺要求最大可能的保留溶液中的多糖成分,清除蛋白等杂质成分,所以本实验以多糖保留率和蛋白清除率为指标,是合理恰当的。在多糖纯化除渣方法中,传统醇沉法要消耗大量乙醇试剂,且多糖损失也多,增加了成本。Sevag法除蛋白存在有机试剂残留的毒性弊端,文献报道Sevag法除蛋白后的多糖抗氧化活性弱于未除蛋白的粗多糖,推测Sevag法除蛋白可能破坏了多糖的结构[12]。Ⅱ型ZTC1+1天然澄清剂在多糖保留方面更显著,纯化除渣效果也很明显,且用量少,工序简单,经济效益好。本实验通过单因素及正交试验研究Ⅱ型ZTC1+1天然澄清剂纯化土茯苓多糖的最佳工艺条件,验证试验结果表明该工艺稳定可行,简单合理。
在实验中发现,Ⅱ型ZTC1+1天然澄清剂对考马斯亮蓝法测定蛋白的吸光值有一定的干扰,而对多糖的吸光值测定几乎没有影响。笔者通过试验,即按照“2.5.2”项的方法,以空白组 (蒸馏水)和体积分数分别为0.1% ~10%的Ⅱ型ZTC1+1天然澄清剂溶液加入显色剂 (考马斯亮蓝G-250溶液),并测定其吸光度。结果发现,加入不同体积分数的Ⅱ型ZTC1+1天然澄清剂溶液之间的吸光度相差不大,且与其体积分数无线性关系;与空白组相比,其吸光度均比空白组要高,高出的吸光度使得纯化后的多糖溶液蛋白含有量测定吸光度偏高。这可能是Ⅱ型ZTC1+1天然澄清剂与考马斯亮蓝发生某种反应,对蛋白吸光度测定产生一定干扰,使絮凝后溶液的蛋白测量值比实际值偏高。
在四因素三水平正交试验中,采用SPSS 19.0统计软件处理相关数据,结果发现无法得出方差分析的F值及P值。因上述试验所用正交表中无空白列作对照,所以可将离差平方和中最小的项来近似作为误差的估计,用于计算各因子列的F值及P值[13]。本实验中,多糖保留率方差分析中离差平方和最小的因素是温度,为0.001,故把温度设为误差,进行方差分析,默认温度对多糖保留率的影响最小;同样,蛋白清除率方差分析中平方和最小的因素是时间,为0.05,故把时间设为误差,进行方差分析,默认时间对多糖保留率的影响最小。
综上所述,采用正交试验优化的Ⅱ型ZTC1+1天然澄清剂纯化土茯苓多糖的最佳工艺条件,能最大可能保留多糖成分的同时除去更多的蛋白等杂质,安全稳定,对土茯苓多糖的纯化及深入研究和开发利用具有十分重要的意义。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:17-18.
[2]李 强.土茯苓现代研究概述[J].中国药业,2008,17(14):76-78.
[3]秦汝兰.土茯苓抑制酪氨酸酶活性成分研究[D].长春:吉林农业大学,2007.
[4]高 静,刘培勋,龙 伟.Ⅱ型ZTC1+1天然澄清剂精制仙鹤复方总糖的研究[J].中国新药杂志,2008,17(15):1335-1338.
[5]汤 淏,唐安福,崔恩忠.ZTC1+1天然澄清剂在中药制剂工艺应用中的影响因素分析[J].医学研究生学报,2012,25(3):324-326.
[6]刘 伟,刘志刚,罗明琍,等.ZTC1+1-Ⅱ用于复方土茯苓颗粒提取液的澄清工艺[J].中国医院药学杂志,2013,33(19):1584-1588.
[7]林江博,李淑芬,杨鸿玲,等.ZTC1+1天然澄清剂在桑叶多糖提纯中的应用[J].化学工业与工程,2008,25(1):40-43.
[8]曹阳阳,郭 斌.Ⅱ型ZTC1+1天然澄清剂在萝摩多糖纯化中的应用[J].沈阳药科大学学报,2012,29(12):959-962.
[9]谢清春,符美燕.灰兜巴粗多糖提取液的脱白工艺研究[J].中成药,2013,35(7):1557-1560.
[10]孟祥海,朱骤海,张 琳,等.Ⅱ型ZTC1+1天然澄清剂在虎杖多糖纯化中的作用[J].中华中医药杂志,2010,25(12):2140-2142.
[11]戴 平,黄凤香,曾建红,等.不同醇沉浓度对广西莪术多糖含量的影响[J].时珍国医国药,2012,23(10):2436-2437.
[12]刘益红,周建军,徐顶巧.不同精制方法对天麻多糖抗氧化活性的影响[J].中成药,2013,35(4):838-841.
[13]胡志洁.SPSS11.5软件在正交试验设计中的应用[J].生物医学信息学,2007,20(5):737-740.
R284.2
:B
:1001-1528(2015)07-1605-06
10.3969/j.issn.1001-1528.2015.07.050
2014-04-12
广东省科技厅省部产学研合作专项资金 (2011A09000020、2013B090700015);广东省自然科学基金团队项目(S201303001515);广东省中医院中医药科学技术研究专项项目 (YK2013B1N02)
陈文良 (1975—),男,硕士,主管中药师,从事中药质量控制相关技术研究。Tel:13631323638,E-mail:chenwenliang2014@163.com
*通信作者:朱 伟 (1975—),男,博士,研究员,从事中药复方药效物质基础研究。Tel:(020)39318571,E-mail:zhuwei9201@ 163.com
