罗汉果甜苷含药血清干扰肝星状细胞周期、凋亡的实验研究
2015-01-16肖喜泉唐慧勤
龙 颖, 王 巍, 田 慧, 肖喜泉, 王 勤, 唐慧勤*
(1.广西中医药大学广西中药药效研究重点实验室,广西南宁530001;2.桂林市中医医院药剂科,广西桂林541002)
罗汉果甜苷含药血清干扰肝星状细胞周期、凋亡的实验研究
龙 颖1,2, 王 巍1, 田 慧1, 肖喜泉1, 王 勤1, 唐慧勤1*
(1.广西中医药大学广西中药药效研究重点实验室,广西南宁530001;2.桂林市中医医院药剂科,广西桂林541002)
目的研究罗汉果甜苷含药血清 (SCM)对大鼠肝星状细胞 (HSC-T6)合成的细胞外基质、细胞周期及凋亡的影响。方法体外培养HSC-T6细胞,并以SCM干预,然后测定细胞上清液中Hyp、透明质酸 (HA)和层黏蛋白(LN),同时检测细胞周期分布及细胞凋亡的变化。结果SCM(5%、10%和20%)细胞上清液中羟脯氨酸 (Hyp)水平显著降低;SCM(20%、10%)细胞上清液中HA和LN水平减少;SCM各质量浓度组作用48 h后,HSC-T6细胞周期产生明显变化,出现凋亡现象,且正常细胞比例呈剂量依赖性下降。结论罗汉果甜苷对HSC-T6细胞周期具有阻滞作用,能诱导其发生凋亡,并可抑制胶原生成,促进细胞外基质降解,可能是其抗肝纤维化的部分作用机制。
罗汉果甜苷;肝星状细胞;凋亡;细胞周期;细胞外基质;肝纤维化
肝纤维化的发生机制十分复杂,但主要是由于肝细胞外基质的过度增生和降解减少造成,而肝星状细胞是合成肝细胞外基质的主要细胞,在肝纤维化的发生发展过程中起着非常重要的作用[1-3]。罗汉果Siraitia grosvenorii(Swingle.)C. Jeffrey ex A.M.Lu et Z.Y.Zhang是药食两用的广西省特产中药,而罗汉果甜苷是其主要成分,对大鼠和小鼠的急慢性肝损伤均有保护作用,其机制可能是通过抑制肝星状细胞HSC-T6增殖及肝纤维化相关基因[4-8]。本实验研究了罗汉果甜苷对肝星状细胞凋亡、细胞周期和细胞外基质的影响,为进一步阐明其抗纤维化作用机制提供依据。
1 材料
1.1 药物及主要试剂 罗汉果提取物 (桂林莱茵生物科技股份有限公司,批号090201,提取工艺是以超声波提取得到粗提物,再以膜分离纯化得到,质量分数≥80%);秋水仙碱片(Colchicine,云南植物药业有限公司产品,批号100807)。DMEM培养液 (美国Gibico公司);胎牛血清(美国Hyclone公司);Hyp检测试剂盒(南京建成科技有限公司);HA、LN检测试剂盒 (北京北方生物技术研究所);细胞凋亡检测试剂盒 (南京凯基生物科技发展有限公司);细胞周期检测试剂盒 (上海碧云天生物技术有限公司)。
1.2 动物及细胞株 SPF级SD大鼠,体质量120~150 g(广西医科大学实验动物中心,动物合格证号SCXK[桂]2009-0002)。肝星状细胞系HSC-T6(为SV40转染SD大鼠HSC,其表型为活化的HSC。广西医科大学黄仁彬教授)提供。
1.3 仪器 SW-CJ-1F超净工作台(苏州净化设备有限公
司);311型二氧化碳培养箱、Thermo Forma 725超低温冰箱(美国Thermo Fisher Scientific公司);XD-101倒置显微镜(南京江南光电集团股份有限公司);SS-325高压灭菌锅(日本Tomykogo公司);5415R小型台式离心机、5810R高速冷冻离心机(德国Eppendorf公司);DFM-96型多管放射免疫计数器 (合肥众成机电技术开发有限责任公司);722可见分光光度计(上海精密科学仪器有限公司);Epics-XLⅡ型流式细胞仪(美国Beckman Coulter公司)。
2 方法
2.1 含药血清的制备 取大鼠42只,随机分为罗汉果甜苷组、秋水仙碱阳性对照组和空白对照组,每组14只。罗汉果甜苷组每日灌胃给药400 mg/kg[8],阳性对照组每日灌胃秋水仙碱0.1 mg/kg,空白对照组每日灌胃生理盐水10 mL/kg,每天给药2次,连续给药7 d。末次给药后1 h各组大鼠腹主动脉取血,4 000 r/min离心15 m in,合并同组大鼠血清,56℃下灭活30 min,0.22μm微孔滤膜滤过除菌,-20℃冰箱保存。罗汉果甜苷组血清中加入对照组血清,分别以1∶0、1∶1、1∶3比例稀释,进行预实验,结果发现1∶3稀释的含药血清对HSC-T6细胞增殖有显著抑制作用。然后,以不影响细胞生长的最大血清体积分数(20%)为罗汉果甜苷含药血清最大给药剂量,设置含药血清体积分数5%、10%、20%这3个梯度,均加入对照组血清稀释至相应体积分数。HSC-T6细胞培养体系中各组大鼠血清终体积分数为20%。
2.2 消化法和RIA法检测HSC-T6的细胞外基质 将肝星状细胞系HSC-T6接种于24孔板 (密度1×105个/mL),培养12 h后,换成含20%空白大鼠血清的培养液,分别设置罗汉果甜苷含药血清5%、10%、20%组、秋水仙碱含药血清20%组和空白对照血清20% (正常大鼠血清体积与其和培养液总体积的百分比值)组,每组设4个复孔。继续培养48 h后,收集细胞上清液,消化法检测其中羟脯氨酸(Hyp)水平,RIA法检测细胞上清液中透明质酸(HA)和层黏蛋白 (LN)水平。
2.3 流式细胞仪检测细胞周期 将HSC-T6细胞接种于5个50 mL培养瓶中 (密度1×105个/mL),培养24 h后,换成含20%空白大鼠血清的培养液,分组与给药方法同“2.2”项。继续培养48 h后胰酶消化,离心沉淀细胞,转移至1.5mL离心管内,70%乙醇在4℃下固定12 h,碘化丙啶染色,37℃下避光温浴30 min,流式细胞仪在488 nm波长处检测红色荧光和光散射情况。每份标本约测定10 000个细胞,测定速率为每秒50~60个细胞,MultiCycle AV软件进行细胞周期分析,以计算各期细胞百分率。
2.4 Annex V-FITC和PI双染法检测细胞凋亡 将HSC-T6细胞接种于5个50 mL培养瓶中 (密度1×105个/mL),培养24 h后,换成含20%空白大鼠血清的培养液,分组与给药方法同 “2.2”项。继续培养48 h后胰酶消化,离心沉淀细胞,调整细胞密度为1×105个/mL,1×Binding Buffer悬浮,加入1μL Annexin V-FITC,混匀后再加入5 μLPI,避光室温下反应5min,流式细胞仪检测(Ex=488 nm,Em=530 nm)细胞凋亡情况,绿色荧光FITC通道检测Annexin V-FITC,红色荧光通道检测PI。每份标本测定10 000个细胞,测定速率为每秒50~60个细胞。
2.5 统计学分析 用SPSS 13.0软件进行统计分析,数据均以x±s表示,组间比较采用t检验。
3 结果
3.1 罗汉果甜苷血清对HSC-T6细胞上清液中Hyp、HA和LN的影响 随着浓度增加,细胞上清液中Hyp含有量呈递减趋势,罗汉果甜苷血清各浓度组中Hyp含有量与空白对照(NS)组比较,有显著性差异 (P<0.05或P<0.01),见表1。

表1 罗汉果甜苷血清对HSC-T6细胞上清液中Hyp、HA和LN的影响(x±s,n=4)
3.2 罗汉果甜苷血清对HSC-T6细胞周期的影响 经5%、10%和20%罗汉果甜苷血清作用于肝星状细胞HSC-T6 48 h后,细胞周期分布开始有明显变化,G2/M期细胞数量减少。其中,罗汉果甜苷血清5%和10%组中的细胞主要被阻滞于G0/G1期及S期,而20%组中的细胞被大量阻滞于G0/G1期,与空白对照组比较,10%和20%组均有显著性差异 (P<0.01)。由此可见,随着药物浓度的增大,细胞被阻滞于G0/G1期的现象越明显,而在低浓度下时,可将其阻滞于G0/G1及S期,见图1和表2。

图1 罗汉果甜苷血清对HSC-T6细胞周期的影响
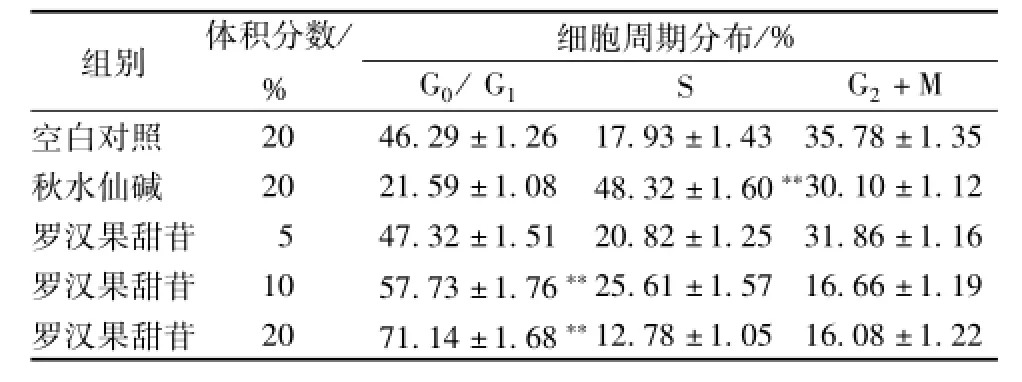
表2 罗汉果甜苷血清对HSC-T6细胞周期的影响(x±s, n=5)
3.3 罗汉果甜苷血清对HSC-T6细胞凋亡的影响 HSC-T6中空白对照组的细胞大多分布于流式图的第三象限,即为正常活细胞。随着体积分数增高,HSC-T6凋亡率呈剂量依赖性增加,与空白对照组比较,均有显著性差异 (P<0.01),表明罗汉果甜苷血清对HSC-T6有明显的促凋亡作用,见表3和图2。

表3 罗汉果甜苷血清对HSC-T6细胞周期的影响(x±s,n=5)

图2 罗汉果甜苷血清对HSC-T6细胞周期的影响
4 讨论
多数研究表明,间质细胞,尤其是肝星状细胞 (HSC)在肝纤维化的发生发展中起重要作用[9-10],因此诱导活化的HSC凋亡是抗纤维化治疗的有效手段[2]。本实验利用流式细胞仪,以磷脂酰丝氨酸外翻分析法(annexin V/PI)来检测罗汉果甜苷血清作用48 h后对HSC-T6细胞凋亡的影响。结果发现,与空白对照组相比,各药物浓度组均存在显著性差异 (P<0.01),并随着药物浓度上升,细胞凋亡数量也随之增加,显示一定的量效关系。由此证明,罗汉果甜苷可有效地促进HSC-T6凋亡,这可能是其抗肝纤维化机制之一。另外,还应用了流式细胞术对细胞周期进行分析,结果发现罗汉果甜苷血清作用48 h后对其产生影响。低剂量罗汉果甜苷血清可将细胞周期抑制在G0/G1期及S期,而随着药物浓度增大,G0/G1期细胞堆积程度越明显,与空白对照组比较,各浓度的罗汉果甜苷血清对细胞周期的影响均存在显著性差异 (P<0.01)。同时,高浓度罗汉果甜苷血清作用于HSC-T6后,G0/G1期细胞比例增加了约25%,说明它可将细胞周期抑制在G0/G1期,其阻滞机制尚有待进一步研究。
细胞外基质主要由胶原 (如Hyp)、非胶原蛋白 (如LN)、蛋白多糖 (如HA)三类成分组成,在肝纤维化过程中,三者可参与肝血窦基底膜形成,致使肝窦毛细血管化。正常情况下,肝细胞可直接与肝血窦接触,但一旦肝窦毛细血管化,可妨碍肝细胞与血窦间营养物质的交换,引起肝细胞发生缺血、缺氧、变性坏死,导致其功能障碍。各种致病因子 (如肝炎病毒、化学物质等)都能激活肝组织中多种细胞因子生成,并可刺激肝星形细胞增殖及活化,使胶原合成增加[2]。在前期研究发现,罗汉果甜苷对CCl4所致的大鼠和小鼠急性肝损伤有保护作用,说明其可减少CCl4对肝星形细胞的刺激[6-7],而本实验也证实它能降低HSC-T6细胞上清液中Hyp、HA、LN水平,对细胞外基质有显著抑制作用,体内和体外实验结果一致。另外,前期研究还发现,罗汉果甜苷血清对HSC-T6中Col-I、TGF-β1和TIMP-1 mRNA表达均有显著抑制作用[7]。由此推测,罗汉果甜苷可能是通过抑制HSC-T6中Col-I、TGF-β1和TIMP-1 mRNA表达来抑制胶原生成,促进细胞外基质降解,从而达到逆转肝纤维化的目的。
本实验结合前期研究成果表明,罗汉果甜苷在体内和体外均有抑制肝纤维化发生发展的作用,可能成为一种潜力很大的治疗肝纤维化药物。
[1]Wirkowska A,Paczek L.Liver fibrosis and cirrhosis-selected cytokines,growth factors and proteins.PartⅡ[J].Przegl Lek,2011,68(4):228-230.
[2]陈主初.病理生理学[M].北京:人民卫生出版社,2005:331.
[3]孙妩弋,魏 伟.肝星状细胞信号转导机制及可能的抗肝纤维化药物作用新靶点[J].中国药理学通报,2006,22(12):1433-1438.
[4]王 勤,李爱媛,黄荣奇,等.罗汉果保肝活性部位的研究[J].中药药理与临床,1998,14(6):31-32.
[5]王 勤,李爱媛,李献萍,等.罗汉果的药理作用研究[J].中国中药杂志,1999,24(7):425-428.
[6]王 勤,肖 刚.罗汉果甜苷对大鼠慢性肝损伤保护作用的实验研究[J].广西中医药,2007,3(5):54-56.
[7]王 勤,肖 刚.罗汉果甜苷对小鼠实验性肝损伤保护作用的研究[J].中国药房,2008,19(3):163-165.
[8]王 勤,王 巍,龙 颖,等.罗汉果甜苷对肝星状细胞HSC-T6增殖及肝纤维化相关基因的影响[J].中草药,2013,44(3):331-334.
[9]孔德松,郑仕中,陆 茵,等.肝内肌成纤维细胞的来源及其在肝纤维化中作用的研究[J].中国药理学通报,2011,27(3):297-300.
[10]Tarrats N,Moles A,Morales A,et al.Critical role of tumor necrosis factor receptor1,butnot2,in hepatic stellate cell proliferation,extracellularmatrix remodeling,and liver fibrogenesis[J].Hepatology,2011,54(1):319-327.
R966.1
:B
:1001-1528(2015)07-1576-04
10.3969/j.issn.1001-1528.2015.07.041
2014-10-12
国家自然科学基金项目 (81160518);广西自然科学基金项目 (2012GXNSFBA053088);广西教育厅科研课题项目(20120220054)
龙 颖 (1977—),女,硕士,主管中药师,从事医院药学工作。Tel:(0773)2821921,E-mail:286723679@qq.com
*通信作者:唐慧勤 (1979—),女,硕士,讲师,从事药理学和中药药理学研究。Tel:(0771)2279423,E-mail:478839447@qq.com
