维通静脉注射乳剂对大鼠实验性肠粘连的防治作用研究
2015-01-16王成蹊侯连兵
王成蹊, 周 静, 秦 飞, 王 娴, 侯连兵*
(1.广东药学院药科学院,广东广州510006;2.内蒙古医科大学,内蒙古呼和浩特010110;3.南方医科大学南方医院药学部,广东广州510515)
[科研报道]
维通静脉注射乳剂对大鼠实验性肠粘连的防治作用研究
王成蹊1, 周 静2, 秦 飞3, 王 娴3, 侯连兵3*
(1.广东药学院药科学院,广东广州510006;2.内蒙古医科大学,内蒙古呼和浩特010110;3.南方医科大学南方医院药学部,广东广州510515)
目的研究维通静脉注射乳剂对术后腹腔粘连防治作用及对组织型纤溶酶原激活物 (tPA)、纤溶酶原活化抑制因子 (PAI-1)和环氧化酶2(COX-2)的影响。方法给实验性术后肠粘连模型大鼠静脉注射不同剂量的维通静脉注射乳剂及地塞米松,模型组注射生理盐水,7 d后开腹,分别进行粘连程度分级评价。然后取血,ELISA法测定血浆中tPA及PAI-1蛋白水平,实时荧光定量PCR(QPCR)法测定腹壁损伤部位组织tPA、PAI、COX-2 mRNA表达水平。结果维通静脉注射乳剂可以显著降低大鼠术后粘连发病程度,提高血浆内tPA蛋白水平,增强损伤部位tPA mRNA表达,同时降低COX-2 mRNA表达水平。结论维通静脉注射乳可以有效地防治术后肠粘连。
维通静脉注射乳剂;术后肠粘连;组织型纤溶酶原激活物;纤溶酶原活化抑制因子;环氧化酶2
腹腔粘连常发生于手术、腹部创伤、甚至自发形成。其中,以术后腹腔粘连较为常见[1],由于它大多表现为肠道相互粘连或肠道与腹壁粘连,因此也常称为术后肠粘连[2]。维通静脉注射乳剂 (WIE)是由南方医科大学南方医院最新研制的用于防治术后肠粘连的静脉注射用亚微乳制剂,为了明确其疗效,探讨其预防术后肠粘连的作用机理,并为临床研究提供实验依据,本实验制作了大鼠实验性肠粘连模型[3],给药后观察其腹腔粘连程度,并测定血浆中组织型纤溶酶原激活物 (tPA)及抑制因子(PAI-1)的变化情况,探讨维通静脉注射乳剂对术后肠粘连的影响。
1 材料与仪器
维通静脉注射乳剂由南方医科大学南方医院药学部制备,由丹参、大黄等中药提取物组成,采用高压匀质法制成静脉注射用亚微乳制剂[4-5],总质量浓度为0.22 mg/mL,使用丹参酮ⅡA为质量控制指标,每1 m L维通静脉注射乳剂中含丹参酮IIA 0.02 mg(批号20130416);Wistar雄性大鼠50只,体质量200~250 g(南方医科大学动物实验中心,实验动物生产许可证号scxk粤2011-0015);地塞米松注射液 (成都天台山制药有限公司,批号20120507)。
tPA、PAI酶联免疫试剂盒(美国Cell Sciences公司,批号CSI11924A、CSI19919A);PrimeScriptⅡ1st Strand cDNA Synthesis Kit、SYBR©Premix Ex TaqTMⅡ(日本TAKARA公司,批号分别为D90108A、DRR081A);Agilent Stratagene 3005PTM system型PCR扩增仪(美国安捷伦公司);多功能酶标仪 (美国MDS公司)。
2 方法
2.1 大鼠实验性术后肠粘连模型制备[3]实验前12 h所有动物禁食不禁水,麻醉后将大鼠仰卧固定于手术板上,腹部脱毛,经2%碘酊和75%乙醇消毒皮肤,铺上无菌巾,取下腹部正中切口约2 cm,取出盲肠,置于无菌纱布上约5 min,使浆膜干燥,以解剖刀片轻刮整个盲肠浆膜10遍,造成轻度渗血,再滴1滴无水乙醇于创面上,然后以无齿镊夹住盲肠系膜动脉约2min,造成暂时局部缺血。盲肠回纳入腹腔原位后,以止血钳夹伤相应腹壁,分两层以1~0号丝线关闭腹腔,即得肠粘连模型。
2.2 实验分组及给药 Wistar大鼠50只按体质量随机分组,并制作腹腔粘连模型,共分5组,每组分别10只:设置模型组、阳性对照地塞米松组、维通静脉注射乳剂高、中、低剂量组。模型组每日尾静脉注射生理盐水1 mL/kg,阳性对照组每日注射地塞米松3 mg/kg,高、中、低剂量组分别注射含丹参酮ⅡA(质量控制指标)3、1.73、1 mg/kg的维通静脉注射乳剂[6]。各组大鼠分笼饲养7 d,自由进食和饮水。
2.3 粘连程度评级 各组大鼠于术后第7天给药后3 h,戊巴比妥麻醉,开腹。采用Nair[7]分级标准,对粘连程度进行分级评分。0级为无粘连;1级为内脏和腹腔壁或内脏间出现1条粘连带;2级为内脏和腹腔壁或内脏间出现两条粘连带;3级为内脏出现多于两条粘连带,或者内脏间形成团块但未与腹腔壁粘连;4级为内脏直接粘连至腹腔壁,而不论粘连带多少。
2.4 血浆tPA和PAI含有量测定 从腹主动脉采血3 mL至抗凝管,3 000 r/min离心20 min,分离血浆,参照ELISA试剂盒说明书操作,测定样本OD值,绘制标准曲线,换算tPA和PAI含有量。
2.5 QPCR检测tPA、PAI、COX-2mRNA含有量 剪取损伤部位腹壁组织(0.5 cm×0.5 cm),研碎组织,Trizol试剂提取总RNA,用PrimeScriptⅡ1st Strand cDNA Synthesis Kit将总RNA进行逆转录反应。逆转录后的cDNA用SYBR ©Premix Ex TaqTMⅡ进行PCR反应,反应体系(总体积20 μL)配制方法为SYBR©Premix Ex TaqTMⅡ(2×)10.0 μL,PCR Forward Primer(10μmol/L)0.8μL,PCR Forward Primer(10μmol/L)0.8μL,ROX Reference DyeⅡ(50×)0.4μL,cDNA模板2.0μL(总量100 ng),无RNase灭菌蒸馏水6.0μL。反应条件设置为95℃30 s预变性;95℃3 s、59℃30 s退火 (40个循环);反应使用引物由TaKaRa公司设计并合成,以β-actin为内参引物,引物序列β-actin正向5′-GGAGATTACTGCCCTGGCTCCTA-3′反向5′-GACTCATCGTACTCCTGCTTGCTG-3′;TPA正向5′-CGCTGTACCTCACAGCATCTGTTTA-3′反向5′-CATCCGCTTATCGATCATGCAC-3′;PAI-1正向5′-ACCATCTCCGTGCCCATGA-3′反向5′-GGGCAGTTCCAGGATGTCGTA-3′,COX-2正向5′-AACACGGACTTGCTCACTTTGTTG-3′反向5′-AATGGAGGCCTTTGCCACTG-3′,所得结果应用2-ΔΔCT方法[8]分析目的基因的相对表达量。
2.6 数据处理 数据采用SPSS 10.0统计软件包进行统计分析。结果用均数±标准差 (x±s)表示,大鼠各组粘连评级比较采用Kruskal-Walli Test秩和检验,完全随机设计资料的多个样本均数比较采用One-Way ANOVA检验。
3 结果
3.1 各组大鼠腹腔粘连程度分级情况 腹部手术后第7天,各组动物均存活,其肠粘连程度分级比较情况见表1。由表可知,模型组动物均发生不同程度的粘连,有的粘连带厚实难以剥离,粘连程度明显高于其他组 (P<0.05)。高剂量组与地塞米松组大鼠粘连带窄,呈薄膜状,甚至无粘连,粘连程度显著低于模型组 (P<0.05)。

表1 各组大鼠腹腔粘连程度分级情况
3.2 维通静脉注射乳剂对大鼠血浆tPA、PAI-1水平影响
测定结果表明,维通静脉注射乳剂能显著升高tPA水平,其中高剂量组明显高于其他组 (P<0.05);给药各组间PAI-1水平无显著性差异,但均显著高于模型组 (P<0.05),见表2。

表2 不同给药组对大鼠血浆tPA、PAI-1水平的影响(n=10,x±s)
3.3 QPCR检测各组tPA、PAI、COX-2 mRNA表达水平
与模型组相比,tPA mRNA相对表达量各组均显著升高(P<0.05),高剂量WIE组和地塞米松组mRNA表达水平显著高于其他组 (P<0.05),地塞米松组与中、低剂量WIE组mRNA表达水平有显著性差异(P<0.05);给药各组间PAI-1mRNA表达水平无显著性差异,但均显著高于模型组(P<0.05);COX-2mRNA相对表达量各组相对模型组均显著降低 (P<0.05),高剂量WIE组和地塞米松组mRNA表达水平显著低于他各组 (P<0.05),见表3。
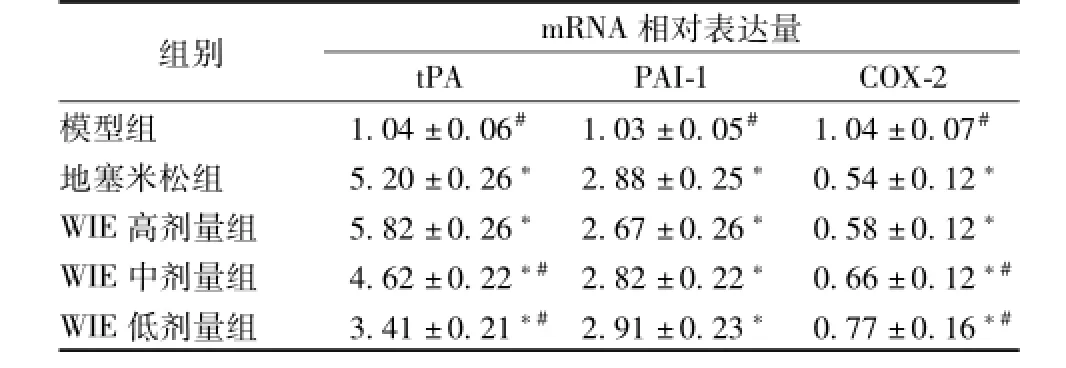
表3 不同组tPA、PA Im RNA相对表达水平(n=10, x±s)
4 讨论
粘连形成的病理学原因十分复杂,纤溶系统激活过程中纤溶酶原激活后产生纤维蛋白酶的作用是抑制其形成的主要影响因素之一[9]。在手术时,无论是创伤、磨损还是感染,都会导致纤维蛋白与纤溶系统之间失衡,从而弱化纤溶蛋白的活性,最终形成粘连。纤溶酶原是纤溶酶的前体物质,而纤溶酶能够高效地降解纤维蛋白并在组织修复中扮演多重角色。激活纤溶酶原的主要物质是tPA,由内皮细胞、间皮细胞和巨噬细胞分泌所得。在纤溶系统中,未激活的纤溶酶原在tPA的作用下转变为激活状态的纤溶酶,而这一过程可以被PAI-1所抑制[9]。临床观察发现,降低tPA活性或提高PAI-1表达数量会导致更为严重的粘连现象[10]。目前,多种药物已被证明可以通过提高tPA的活性来增强腹膜内纤溶系统活性,从而防止粘连形成,如他丁类药物、奥曲肽、亚甲蓝等[11-13]。
维通静脉注射乳剂的主要成分来自于丹参、大黄等中药的提取物,通过对有效组分的筛选和制剂学研究,进一步形成静脉乳注射剂。实验表明,地塞米松组和维通不同剂量组粘连程度同模型组比较均有显著改善 (P<0.05),维通静脉注射乳剂高剂量组与地塞米松组大鼠的粘连程度相似,无显著性差异 (P=0.853)。进一步研究它对纤溶系统的影响时发现,维通各组tPA水平均显著高于模型组,高、中剂量维通静脉注射乳剂显著高于地塞米松组,而低剂量维通静脉注射乳剂的tPA水平与地塞米松无显著差异。同时,维通静脉注射乳剂可以有效提高腹壁损伤部位组织tPA的mRNA表达水平,说明它可以增强tPA分泌,增加纤溶蛋白酶原向纤溶蛋白的转换,促进对纤维蛋白的溶解,从而有效阻止粘连条带的形成。另外,地塞米松组和维通不同剂量组之间的血浆PAI-1蛋白水平以及腹壁损伤部位PAI的mRNA表达水平均无显著差异,说明各给药组对PAI-1的影响相当,但与同模型组比较,这些组的PAI-1水平均显著升高,产生该结果的机制目前仍不清楚,有待进一步研究。
COX-2是前列腺素合成过程中一个重要的限速酶,主要存在于核膜和微粒体膜,是炎症过程中一个重要的诱导酶,同时也是治疗炎症的一个重要的靶分子[14]。一般当细胞处于静息期时,不易检测到COX-2水平,当细胞接受相应刺激后便开始合成,一般需数小时至十几小时。研究发现,使用抗炎药保泰、吲哚美辛等可以有效治疗术后粘连[15-16],Maghsoudi等[17]报道,使用选择性COX-2抗炎药吡罗昔康也可以抑制其形成,说明抗炎药物无论是选择性还是非选择性COX-2抑制剂,对术后粘连都会产生抑制作用。本实验对创伤部位的COX-2基因水平研究反向,在给予维通静脉注射乳剂后,与同模型组比较,创伤部位的COX-2mRNA水平会显著下降,说明维通静脉注射乳剂对粘连形成部位的炎症反应有抑制作用,可能是其抗粘连作用的机制之一。
综上所述,本实验证明维通静脉注射乳剂可有效防治术后腹腔粘连的形成,为将其应用于临床打下了基础。但由于术后腹腔粘连机制涉及到多个因素,而本实验对其只是进行了初步探索,因此,进一步从分子药理学角度研究维通静脉注射乳剂对粘连细胞的影响并阐明药物作用的机理是下一阶段研究的目标。
[1]Boland GM,Weigel R J.Formation and prevention of postoperative abdominal adhesions[J].J Surg Res,2006,132(1):3-12.
[2]Ozel H,Avsar FM,Topaloglu S,et al.Induction and assessment methods used in experimental adhesion studies[J]. Wound Repair Regen,2005,13(4):358-364.
[3]Akyildiz H,Akcan A,Sozuer E.The preventive effect of Met-RANTESon postoperative intraperitoneal adhesion formation in the ratmodel[J].Surgery,2008,144(3):404-409.
[4]王成蹊,秦 飞,周 静,等.维通静脉注射乳剂制备工艺研究[J].中国药业,2014,9(1):35-37.
[5]王成蹊,秦 飞,周 静,等.维通静脉注射乳安全性研究[J].中国实用医药,2013,8(36):255-256.
[6]徐淑云,卞如濂,陈 修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:204-205.
[7]Nair SK,Bhal Z K,Aurora A I,et al.Role of poteolytic enzymes in the prevention of the postoperative intraperitonealadhesions[J].Arch Surg,1974,108(6):849-853.
[8]Livak K J,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTMethod[J].Methods,2001,25(4):402-408.
[9]Ward B C,Panitch A.Abdominal adhesions:current and novel therapies[J].JSurg Res,2011,165(1):91-111.
[10]Holmdahl L,Eriksson E,Eriksson B I,et al.Depression of peritoneal fibrinolysis during operation is a local response to trauma[J].Surgery,1998,123(5):539-544.
[11]Aarons C B,Cohen PA,Gower A,et al.Statins(HMG-CoA reductase inhibitors)decrease postoperative adhesions by increasing peritoneal fibrinolytic activity[J].Ann Surg,2007,245(2):176-184.
[12]Cetin M,Ak D,Duran B,etal.Use ofmethylene blue and N,O-carboxymethylchitosan to prevent postoperative adhesions in a ratuterine hornmodel[J].Fertil Steril,2003,80(Suppl 2):698-701.
[13]Baykal A,Ozdemir A,Renda N,etal.The effectof octreotide on postoperative adhesion formation[J].Can JSurg,2000,43(1):43-47.
[14]Diamond M P,Hammady E,Wang R,et al.Regulation of expression of tissue plasminogen activator and plasminogen activator inhibitor-1 by dichloroacetic acid in human fibroblasts from normal peritoneum and adhesions[J].Am J Obstet Gynecol,2004,190(4):926-934.
[15]Larsson B,Svanberg SG,Swolin K.Oxyphenbutazone-an adjuvant to be used in prevention ofadhesion in operations for fertility[J].Fertil Steril,1977,28(8):807-808.
[16]DeSimone JM,Meguid M M,Kurzer M,et al.Indomethacin decreases carrageenan induced peritoneal adhesions[J].Surgery,1988,104(4):788-795.
[17]Maghsoudi H,Askery B.The effect of piroxicam on the formation of postoperative,intraabdominaladhesion in rats[J].Saudi JGastroenterol,2008,14(4):198-201.
R285.5
:B
:1001-1528(2015)07-1562-03
10.3969/j.issn.1001-1528.2015.07.036
2014-09-16
王成蹊 (1977—),男,博士,讲师,从事新药研究与开发。Tel:(020)39352529,E-mail:278012637@qq.com
*通信作者:侯连兵 (1957—),男,教授,主任药师,博士生导师,从事新药研究与开发。Tel:(020)61642175,E-mail:smuhlianbing@hotmail.com
