HPLC法同时测定复方必清颗粒中秋水仙碱、槲皮素及薯蓣皂苷元
2015-01-16刘桂花邢建国王云飞帕依曼亥米提何承辉
刘桂花, 邢建国, 王云飞, 帕依曼·亥米提, 何承辉
(新疆维吾尔自治区药物研究所,新疆乌鲁木齐830004)
HPLC法同时测定复方必清颗粒中秋水仙碱、槲皮素及薯蓣皂苷元
刘桂花, 邢建国, 王云飞, 帕依曼·亥米提, 何承辉*
(新疆维吾尔自治区药物研究所,新疆乌鲁木齐830004)
目的建立同时测定复方必清颗粒 (菝葜、天山堇菜、秋水仙、诃子肉、白花丹、西青果、玫瑰花)中秋水仙碱,槲皮素及薯蓣皂苷元3种成分的HPLC法。方法复方必清颗粒80%甲醇提取液的HPLC分析在Cosmosil-C18(250mm×4.6mm,5μm)色谱柱进行,流动相为乙腈 (A)-0.4%磷酸 (B),梯度洗脱,秋水仙碱和槲皮素检测波长为350 nm,薯蓣皂苷元为203 nm,体积流量1 mL/min,柱温为35℃。结果秋水仙碱在7.62~76.2μg/m L、槲皮素在11.02~77.14μg/mL、薯蓣皂苷元在23.15~231.5μg/mL范围内均呈良好线性关系;相关系数分别为0.999 7,0.999 7,0.999 8;秋水仙碱、槲皮素及薯蓣皂苷元的平均回收率分别为99.8% (RSD为1.2%),100.0% (RSD为1.1%)和99.6% (RSD为1.1%)。样品溶液在24 h内稳定。结论该方法中秋水仙碱和槲皮素的分离效果较好,峰形对称,出峰时间适中,可作为该颗粒制剂的质量控制方法。
高效液相色谱法;复方必清颗粒;秋水仙碱;槲皮素;薯蓣皂苷元
复方必清颗粒处方来源于新疆维吾尔族医院,是由菝葜、秋水仙、天山堇菜、诃子肉、地锦草、白花丹、西青果和玫瑰花八味药材组成的复方制剂,为维药经典方,具有清血、消炎止痛的功效。用于子宫内膜炎,宫颈糜烂,附件炎等妇科疾病。菝葜是方中君药,近年来,以菝葜为主药研制了多种复方治疗妇科病,临床常用于治疗各种妇科炎症,疗效显著。现代药理学研究表明:菝葜的总皂苷部位,具有明显的抗炎效果,并且对细菌生长具有明显的抑制作用。菝葜乙醇提取物具有抑菌作用,具有拮抗大鼠蛋白清性及角叉菜胶性动物足趾肿胀,以及对二甲苯所致大鼠耳肿胀有明显的抑制镇痛作用。菝葜中含有多种皂苷,其中薯蓣皂苷元(diosgenin)为其主要有效成分。秋水仙主要有效成分为秋水仙碱(colchicine),具有解毒散结、抗炎、消肿止痛的功效,是抗炎镇痛抗风湿的主要活性成分。地锦草具有清热解毒、利湿退黄、凉血止血的功效,药理研究证实其化学成分中的槲皮素(quercetin)、山柰素等黄酮类化合物是地锦草抗菌、止血、抗氧化的主要有效成分。本实验研究建立了高效液相色谱法同时测定复方必清颗粒中秋水仙碱、槲皮素和薯蓣皂苷元的量,旨在为及时检测并全面跟踪有效成分在复方必清颗粒制备过程中各工序的转移率提供一种高效方法,同时也为该制剂的质量评价提供科学的理论依据[1-9]。
1 仪器与材料
LC-20A型高效液相色谱仪 (日本岛津制造):SPD-20A紫外检测器、LC-20AB溶剂输送泵、SIL-20A自动进样器、CTO-20A柱温箱、LC-Solution数据工作站,AB135-S梅特勒-托利多电子天平 (瑞士),BS110S型Sartorius电子天平(北京赛多利斯天平有限公司);JM-B2003电子天平 (余姚市纪铭称重校验设备有限公司);WP-UP-IV-10型Water Purifier实验室专用超纯水机(四川沃特尔科技发展有限公司);KQ-100DE型数控超声波清洗器(昆山市超声仪器有限公司);KDM型调温电热套(山东省郓城永兴仪器厂)。
对照品槲皮素 (批号100081-200907)、薯蓣皂苷元 (批号111539-200001)购自中国食品药品检定研究院,秋水仙碱对照品 (批号086K1576)购自美国Sigma-Aldrich(西格玛)公司。复方必清颗粒由新疆医科大学药学院自制 (批号:130809、130813、130818)。乙腈购自美国霍尼韦尔(Honeywell B&J)公司,色谱纯;甲醇购自天津市福晨化学试剂厂,分析纯,水为超纯水。
2 方法
2.1 色谱条件 Cosmosil-C18色谱柱(250 mm× 4.6 mm,5μm),流动相为乙腈(A)-0.4%磷酸(B),按表1进行梯度洗脱;双波长检测,350 nm检测秋水仙碱和槲皮素,203 nm检测薯蓣皂苷元;体积流量1 mL/min;柱温为35℃;进样量10μL。运行时间为80 min。

表1 梯度洗脱程序Tab.1 Gradient elution program
2.2 溶液的制备
2.2.1 混合对照品溶液 取秋水仙碱对照品7.62 mg置25 m L量瓶中,槲皮素对照品5.71 mg、薯蓣皂苷元对照品4.63 mg分别置10 mL量瓶中,加甲醇至刻度,制成每1 mL分别含秋水仙碱304.8 μg、槲皮素551μg和薯蓣皂苷元463μg的贮备液。分别精密吸取上述贮备液1.5、1.0、2.5 mL置10 mL棕色量瓶中,加甲醇稀释至刻度,摇匀,配成质量浓度为45.72、55.1、115.75μg/mL的混合对照品溶液。将上述对照品贮备液、混合对照品溶液于4℃保存,备用。
2.2.2 供试品溶液 取复方必清颗粒样品适量研细,约1.5 g,精密称定,置25 mL量瓶中,加入80%甲醇适量,超声 (功率100 W,频率40 kHz)处理45 min,取出,放冷,用80%甲醇定容至刻度,摇匀,滤过,取续滤液,即得。
2.2.3 阴性样品溶液 按复方必清颗粒的处方,分别称取不含秋水仙、不含菝葜、不含地锦草的复方药材,按 “2.2.2”项下的方法制成相应的阴性样品溶液,4℃冷藏备用。
3 结果
3.1 专属性试验 分别精密吸取供试品溶液、混合对照品溶液及阴性样品溶液各10μL,按 “2.1”项下色谱条件进样,结果,秋水仙碱、槲皮素和薯蓣皂苷元的保留时间分别为22、32、71 min左右,阴性样品对测定没有干扰,分离度良好,对照品、供试品及阴性样品色谱图见图1。

图1 HPLC色谱图Fig.1 HPLC chrom atogram s
3.2 线性关系的考察 精密吸取秋水仙碱贮备液0.25、0.5、1.0、1.5、2.0、2.5 mL分别置10 mL量瓶中,加甲醇稀释至刻度,摇匀,得系列对照品溶液。精密吸取对照品溶液10μL,注入色谱仪中,按 “2.1”项下色谱条件进行测定,以对照品质量浓度X与其峰面积Y进行线性回归,得秋水仙碱标准曲线,结果表明秋水仙碱在相应的线性范围内线性关系良好,见表2。
精密吸取槲皮素贮备液5mL至25mL量瓶内,加甲醇至刻度,制成质量浓度为110.2μg/m L的稀释液。再精密吸取稀释液0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL分别置5 mL量瓶中,加甲醇稀释至刻度,摇匀,得系列对照品溶液。精密吸取对照品溶液10μL,注入色谱仪中,按 “2.1”项下色谱条件进行测定,以对照品质量浓度与其峰面积Y进行线性回归,得槲皮素标准曲线,结果表明槲皮素在相应的线性范围内线性关系良好,见表2。
精密吸取薯蓣皂苷元贮备液0.5、1.0、2.0、3.0、4.0、5.0 mL置10 m L棕色量瓶中,加甲醇稀释至刻度,摇匀,得系列对照品溶液。精密吸取各对照品溶液10μL,注入色谱仪中,按 “2.1”项下色谱条件进行测定,以对照品质量浓度X与其峰面积Y进行线性回归,得薯蓣皂苷元标准曲线,结果表明薯蓣皂苷元在相应的线性范围内线性关系良好,见表2。

表2 回归方程及线性范围Tab.2 Regression equations and linear range of reference substances
3.3 精密度试验 取混合对照品溶液,按上述“2.1”项下色谱条件测定,连续进样6次,测定峰面积,秋水仙碱、槲皮素和薯蓣皂苷元峰面积的RSD(n=6)分别为1.2%、0.9%、1.5%。结果表明仪器精密度良好。
3.4 稳定性试验 取同一批号 (批号130809)样品,按 “2.2.2”项下方法制备一份供试品溶液,室温放置,按 “2.1”项下色谱条件分别在0、2、6、12、24 h进行测定,测得供试品溶液中秋水仙碱、槲皮素及薯蓣皂苷元峰面积的RSD(n=6)分别为1.0%、1.2%、1.4%。结果表明,供试品溶液在24 h内基本稳定。
3.5 重复性试验 取批号130801的样品,按“2.2.2”项下方法制备供试品溶液6份,按上述色谱条件测定。计算求得秋水仙碱、槲皮素及薯蓣皂苷元的平均含有量 (n=6)分别为0.273 8、0.592 8、0.983 9 mg/g,RSD分别为1.5%、1.9%、1.6%,表明该方法重复性良好。
3.6 加样回收率试验 精密称取0.75 g已知含有量的复方必清颗粒样品 (批号130809),共9份,平均分为3组,分别按样品中各成分含有量与相应对照品加入量的比例约为1∶0.8、1∶1、1∶1.2,精密加入秋水仙碱对照品溶液(0.304 8 mg/mL)0.5、0.7、0.9mL,槲皮素对照品溶液 (0.181 2 mg/mL)2.0、2.5、3.0 mL,薯蓣皂苷元对照品溶液(0.297 6 mg/mL)2.0、2.5、3.0 mL,按“2.2.2”项下方法制备溶液,按 “2.1”项下色谱条件测定,并计算加样回收率。结果见表3。

表3 加样回收率试验的结果Tab.3 Results of recovery tests
3.7 样品测定 取3个批号的复方必清颗粒样品(批号分别为130809、130813、130818),各3份,按 “2.2.2”项下的方法制备供试品溶液,在“2.1”项色谱条件下,分别精密吸取混合对照品溶液与供试品溶液各10μL,注入液相色谱仪,测定3批样品中秋水仙碱、槲皮素及薯蓣皂苷元的量,结果见表4。
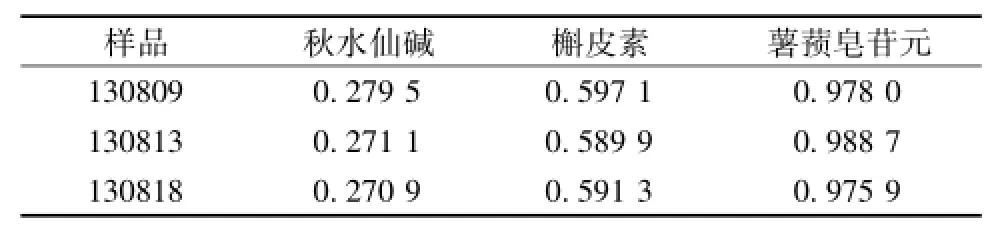
表4 样品测定结果(mg·g-1,n=3)Tab.4 Test results of sam p les(mg·g-1,n=3)
4 讨论
4.1 检测波长的选择 据文献报道,槲皮素的检测波长为360 nm[10]、368 nm[11]、254 nm[12]。本实验于200~400 nm波长范围内进行紫外扫描,发现秋水仙碱在350 nm和245 nm处有最大吸收,当选择254 nm时,样品中秋水仙碱峰的前面有个小峰的干扰,因样品中秋水仙碱的峰面积比槲皮素的峰面积小,为减少干扰,提高方法的准确度,故考虑采用秋水仙碱的紫外最大吸收波长350 nm作为检测波长。且在此波长下,秋水仙碱和槲皮素的分离效果都很好。查阅文献可知[13],薯蓣皂苷元的最大吸收波长为203 nm。此条件也符合 《中国药典》2005年版菝葜项下测定薯蓣皂苷元的条件。
4.2 梯度洗脱依据 根据文献报道[13-15],秋水仙碱和槲皮素多采用甲醇-0.4%磷酸 (50∶50)为流动相,出峰时间均小于30 min,但薯蓣皂苷元在此条件下出峰很晚,在90 min时还未出峰,《中国药典》2005年版菝葜项下测定薯蓣皂苷元的条件为乙腈-水 (90∶10),因此,选择梯度洗脱。本实验尝试了乙腈-水、乙腈-0.4%磷酸系统,结果发现,乙腈-水为流动相时,秋水仙碱和槲皮素峰的拖尾都较严重,分离效果差。采用乙腈-0.4%磷酸系统,在梯度的前段,当采用乙腈-0.4%磷酸(25∶75)时,秋水仙碱和槲皮素的分离效果较好,峰形对称,出峰时间适中。在梯度的后段,当选择乙腈-0.4%磷酸 (90∶10)时,薯蓣皂苷元的出峰时间为71 min,分离效果较好。
[1]国家药典委员会.中华人民共和国药典:2005年版一部[S].北京:化学工业出版社,2005:216.
[2]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:118.
[3]邹 健,阮金兰,孙传勇.菝葜的化学成分、药理作用与临床应用[J].中药材,2001,24(6):450-452.
[4]吕永宁,陈东生,付 磊,等.菝葜三种提取物活血化瘀药理作用研究[J].中国药科大学学报,2001,32(6):448-450.
[5]陈东生,吕永宁,吕 翼.菝葜总甾体皂苷元的含量测定[J].中药材,2001,24(2):111-112
[6]尹 潍,程志强,高志红,等.秋水仙碱贴膜治疗急性痛风性关节炎[J].中国新药与临床杂志,2001,20(5):373-374.
[7]毛小明,马开宇.秋水仙碱的新用途[J].基层中药杂志,2001,15(5):54-55.
[8]谢 奇,李治建,斯拉普·艾白,等.地锦草化学成分及其抗真菌作用的研究进展[J].医药导报,2011,30(7):880-883.
[9]李治建,古力娜·达吾提,肖 威,等.地锦草提取物抗真菌作用及对皮肤真菌超微结构的影响[J].中草药,2009,40(5):758-763
[10]潘 馨.HPLC测定满山红中杜鹃素、槲皮素的含量[J].中国药学杂志,2002,37(11):862-864
[11]杨龙辉,伍丕娥,王天志.HPLC测定沙棘膏中槲皮素和异鼠李素的含量[J].华西药学杂志,2002,17(2):130-131.
[12]卢文彪,曾元儿.HPLC法测定紫花杜鹃胶囊中槲皮素的含量[J].湖南中医药导报,2002,8(3):133-134.
[13]李惠芬,平 渊,陈 刚,等.高效液相色谱法和薄层色谱法测定重楼中薯蓣皂苷元的含量[J].中草药,2003,34(2):127-129.
[14]王晓英,原红霞,赵云丽,等.RP-HPLC法同时测定地锦草片中3种黄酮苷元的含量[J].沈阳药科大学学报,2007,24(9)564-567.
[15]卞晓岚,翟 青,张芳华,等.高效液相色谱法测定复方秋水仙碱胶囊中秋水仙碱的含量[J].广东微量元素科学,2004,11(6):41-44.
Simultaneous determ ination of colchicine,quercetin and diosgenin in Com pound Biqing Granules by HPLC
LIU Gui-hua, XING Jian-guo, WANG Yun-fei, Payiman-Haimiti, HE Cheng-hui*
(Xinjiang Instituteof Meteria Medica,Urumchi830004,China)
AIMTo establish an HPLC method for simultaneously determining the contents of colchicine,quercetin and diosgenin in Compound Biqing Granules(Smilax,Viola tianshanica Maxim,Colchicum autumnale,Fuphorbia humifusa,Terminalia chebula,etc.).METHODSHPLC analysis of 80%methanolic extract from Compound Biqing Granules was performed on Cosmosil column(250 mm×4.6 mm,5μm).The mobile phase consisted of acetonitrile(A)-0.4%ortho-phosphoric acid(B)solution in a gradientelutionmode,the detection wavelength was set at 350 nm for colchicine and quercetin as well as 203 nm for diosgenin and flow rate was 1 mL/min.The column temperature wasmaintained at35℃.RESULTSThemethod had good linear relationship within the range of 7.62-76.2μg/mL for colchicine(r=0.999 7),11.02-77.14μg/mL for quercetin(r= 0.999 7),and 23.15-231.5μg/mL for diosgenin(r=0.999 8),respectively.The average recoveries were 99.8%(RSD=1.2%)for colchicine,100.0%(RSD=1.1%)for quercetin,99.6%(RSD=1.1%)for diosgenin,respectively.The sample solution was stable within 24 h.CONCLUSIONThemethod has a good separation effects,symmetrical peak forms,and peak flowing out available,and is recommended as control standard for Compound Biqing Granules.
HPLC;Compound Biqing Granules;colchicine;quercetin;diosgenin
R927.2
:A
:1001-1528(2015)07-1487-05
10.3969/j.issn.1001-1528.2015.07.020
2014-10-09
新疆维吾尔自治区重大科技专项 (201130105-3)
刘桂花 (1984—),女,助理研究员,硕士,从事药物新制剂与新剂型研究。Tel:(0991)2318172,E-mail:lisena_lgh@ 163.com
*通信作者:何承辉 (1974—),女,副研究员,硕士,从事药物新制剂与新剂型研究。Tel:(0991)2318172,E-mail:hch301@sohu.com
