碳源对出芽短梗霉发酵生产普鲁兰多糖的影响
2015-01-14周文红刘慧霞
刘 鑫,周文红,韦 海,刘慧霞
(广西大学轻工与食品工程学院,广西南宁530004)
0 前言
普鲁兰多糖(Pullulan)是由多形态的真菌出芽短梗霉(Aureobasidium pullulans)利用蔗糖等作为碳源物质发酵产生的一种线性胞外多糖[1],它是由麦芽三糖通过α-1,6糖苷键连接而成的高分子多聚糖[2]。普鲁兰多糖无色无味,无毒无害,对人体无任何副作用,呈粉末状,溶于水时散发出微微的甜味[3]。它含有丰富的羟基,极易溶于水,不溶于油脂、醇类、丙酮、醚和氯仿等有机溶剂[4],并具有极佳的成膜性、氧气不渗透性、耐热性、耐酸碱性、成纤维性、粘结性、可塑性和易自然降解性等许多独特的物理化学和生物化学特性[5],可以广泛地应用于医药制造行业、食品工业、烟草工业、化妆品工业、农业和污水处理等多种领域[6],是一种具有极大经济利用价值和巨大开发潜力的多功能新型生物产品[7]。
广西是中国的产糖大省,拥有丰富的用于微生物发酵的碳源,其中作为加工精糖的原料原糖,是石灰法糖厂的特有产品[8]。目前,国内外利用原糖进行普鲁兰多糖的发酵还未见相关报道。本实验主要初步探讨原糖、白砂糖、葡萄糖、淀粉等不同碳源作为底物对出芽短梗霉As.40239进行发酵合成并提取普鲁兰多糖,并进行了原糖发酵培养基的优化。
1 实验材料
1.1 菌种和原料
出芽短梗霉(Aureobasidium pullulans 40329):工业微生物湖北省重点实验室保藏菌株;实验所用的原糖采自广西某精炼糖厂,白砂糖采自某亚硫酸法糖厂。
1.2 培养基和培养条件
1.2.1 培养基
斜面培养基(g/L):蔗糖30,磷酸氢二钾5,氯化钠1,硫酸镁0.2,硫酸铵0.6,酵母膏2.5,琼脂20,氯霉素1,pH自然条件;种子培养基(g/L):磷酸氢二钾6,磷酸二氢钾2,硝酸钠1.54,氯化钠2,七水硫酸镁0.04,四水氯化锰0.006,六水氯化铁0.002,盐酸硫胺素0.004,葡萄糖30,酵母膏1,pH自然条件;发酵培养基(g/L):磷酸氢二钾6.5,硫酸铵0.4,氯化钠1,硫酸镁 0.1,酵母膏2.5,蔗糖50,摇瓶条件下初始pH为5.8。
1.2.2 培养条件
斜面培养:将保藏的斜面菌种接种至斜面培养基上,28℃条件下培养48 h,用于菌种活化;种子液培养:将活化的斜面菌种接入到装有40 mL发酵液的250 mL三角瓶中,28℃、200 r/min摇瓶培养48 h;发酵培养:采用摇瓶发酵培养方式,将种子培养液按照2%(v/v)的接种量接入到装有50 mL发酵液的250 mL三角瓶中,28℃、200 r/min摇瓶发酵培养96 h。
2 实验方法
2.1 出芽短梗霉发酵
根据广西制糖产业特色,选取精炼糖厂生产的原糖和亚硫酸法糖厂生产的白砂糖作为发酵底物碳源,另选择葡萄糖和淀粉作为对比发酵的碳源,底物碳源采用5%反应量。将保存的出芽短梗霉菌种斜面活化,28℃下培养48 h,此时菌种处于对数生长期;随后按照2%的接种量接入250 mL(装液量40 mL)的液体种子培养基中,28℃,200 r/min,摇瓶发酵96 h。
2.2 普鲁兰多糖的提取
首先将摇瓶发酵96 h的发酵液4000 r/min下离心15 min,取离心后的上清液20 mL,加入2倍体积酒精,放置冰箱中 4℃过夜,使普鲁兰多糖尽可能全部析出于酒精中[9];然后用玻璃棒将充分析出的普鲁兰多糖挑出,残留的普鲁兰多糖在4000 r/min下离心15 min后一并移出;最后将普鲁兰多糖置于真空干燥箱中低温干燥,防止普鲁兰多糖高温干燥过程中氧化变色,干燥后的普鲁兰多糖进行称量。
2.3 普鲁兰多糖的纯化
上述方法提取的为普鲁兰粗多糖,其中普鲁兰多糖的含量大约95%以上。粗普鲁兰多糖中存在一些杂质,例如蛋白质、菌体等[10],因此要进一步提纯。
普鲁兰多糖提纯[11]过程:首先进行热处理,将发酵液4000 r/min离心15 min,取上清液,用碳酸氢钠溶液调节pH值到中性,80℃下水浴20 min后再次离心;然后向热处理后的上清液中加入0.6%的活性炭脱色,200 r/min振荡20 min,脱色后4000 r/min离心15 min,除去活性炭;接着用 2倍体积的有机溶剂丙酮沉淀多糖,放置冰箱中 4℃过夜,使普鲁兰多糖尽可能全部析出;析出后的多糖再用95%乙醇洗涤多糖2次后离心;最后将普鲁兰多糖置于真空干燥箱中低温干燥,干燥后的普鲁兰多糖粉碎即可获得较纯的普鲁兰多糖粉末。
2.4 发酵后期各糖分的测定
2.4.1 总糖的测定
硫酸-苯酚法[12]测定总糖含量:在浓硫酸的作用下,多糖能够水解成单糖,并通过脱水反应生成糖醛衍生物,其与苯酚反应生成颜色稳定的橙黄色化合物,在分光光度计波长490 nm处,一定浓度范围内,吸光度和糖的含量呈线性关系,利用葡萄糖标准曲线及其测定的吸光度值,即可计算出总糖的含量;
葡萄糖标准曲线的绘制需要配制100 μg/mL的葡萄糖标准溶液、6%苯酚溶液。
按照表1加入相应的葡萄糖溶液、蒸馏水,以及6%苯酚1 mL、浓硫酸1 mL,摇匀振荡充分后静置20 min,490 nm处测定吸光度,绘制葡萄糖标准曲线如图1所示。

表1 标准曲线制定

图1 葡萄糖标准曲线
取发酵液1 mL,加入蒸馏水稀释100倍。取稀释液1 mL于试管中,加入蒸馏水1 mL,6%苯酚溶液1 mL,浓硫酸5 mL,摇匀振荡充分后静置20 min,490 nm处测定吸光度,根据葡萄糖标准曲线换算出总糖量。
总糖含量:

其中:X为发酵液总糖含量(g/L);A为标准曲线计算出样品总糖含量(g/L);C为发酵液总体积(mL);N为稀释倍数;V为测定时发酵液体积(mL)。本实验中:N=1000,V=1 mL,C=1 mL,A=x/1000。
2.4.2 残糖的测定[13]
发酵后培养基中残糖量=总糖量-多糖量
2.4.3 菌体消耗糖的量[13]
菌体发酵过程中,糖分参与代谢并提供发酵所需的能量。
菌体消耗糖的量=碳源量-总糖量
2.4.4 多糖转化率[13]
3 结果与分析
3.1 不同底物碳源对普鲁兰多糖产量的影响
采用原糖、白砂糖、葡萄糖、淀粉作为发酵底物碳源,经过发酵提取多糖后称取多糖产量(每升发酵液产普鲁兰多糖的克数)和产物照片如图2所示。
由图2分析可知,在4种碳源添加量相同的情况下,原糖发酵生产的普鲁兰多糖产量要比蔗糖、葡萄糖和淀粉高出16%~53%,且原糖发酵合成普鲁兰多糖的过程中黑色素产生最少,多糖颜色较浅。分析原因应该从糖代谢角度进行,普鲁兰前体起源于尿苷二磷酸葡萄糖,而且在其生物合成的过程中,有3种关键性的代谢酶:α-磷酸葡萄糖变位酶、尿苷二磷酸葡萄糖焦磷酸化酶、葡萄糖基转移酶[14],有些二价金属元素又可以作为这几种关键酶的激活剂,原糖中含有少量多酚类物质、还原糖、糖蜜、金属元素形成的胶体物质等[8],原糖中含有的杂质以及二价金属元素可能对菌种细胞中糖代谢关键酶的调控具有激活剂的作用,对菌种发酵后期黑色素产生也具有抑制作用。
淀粉发酵生产普鲁兰多糖产量最低,仅5.38 g/L,在发酵后期,摇瓶底部还残留大量未参与反应的淀粉。分析原因可能是由于淀粉在参与出芽短梗霉代谢过程中,要先水解成小分子糖类,然后才能进入糖代谢过程,致使发酵过程缓慢,从而使得普鲁兰产量偏低。在发酵结束后,由于发酵液中残留的淀粉,使得普鲁兰多糖分离困难,提纯难度大。

图2 不同碳源对普鲁兰多糖产量的影响
3.2 发酵培养基的优化
影响普鲁兰多糖的产量的主要培养基成分有 3种,分别是磷酸氢二钾、硫酸铵、酵母膏。现采用原糖作为碳源,通过正交试验进行优化,确定最优发酵培养基配方。正交试验因素水平如表2所示,正交试验结果如表3和表4所示。
采用IBM SPSS Statistics软件对表3和表4的正交试验结果进行方差分析,结果如表5所示。可以看出,如果P<0.05,则为差异显著。
再通过F检验分析判断,给定显著水平α=2.5%,查得F0.025(2,8)=6.06。对比F值,可以看出A不显著,B、C极显著。总之,通过方差分析得出,硫酸铵和酵母膏对多糖产量的影响极为显著。说明氮源在提高多糖产量中具有重要的作用。
3.3 发酵液中各糖分的测定及分析
采用硫酸-苯酚法测定上述正交试验中总糖含量,进一步计算出残糖含量以及菌体发酵过程中参与代谢和维持能力所消耗的糖含量。最终计算结果见表6。

表2 正交试验因素水平表

表3 正交试验结果

表4 试验分析表
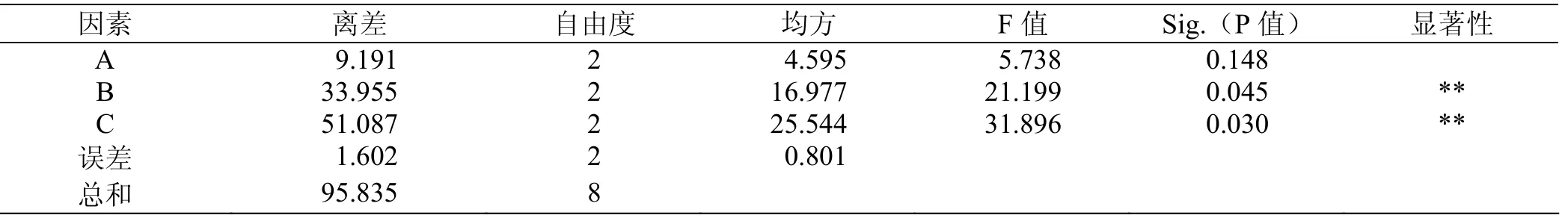
表5 各因素对多糖产量影响的方差分析表
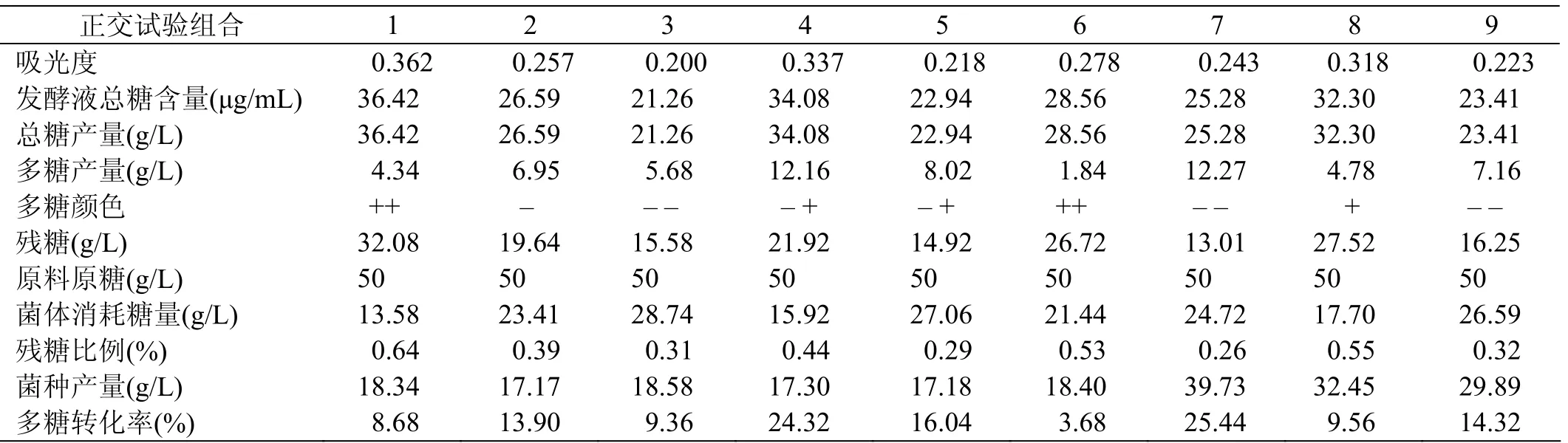
表6 普鲁兰多糖各项数据值
从表6以及正交实验表3和表4可以看到,9组正交试验的不同发酵条件的组合,除了第4组和第7组外,其他各组当菌种产量增加的同时,菌种消耗量也增加了。不仅抑制了多糖的转化,同时菌种的代谢也会消耗多糖。只有第4组和第7组多糖产量相比其它各组要高一些,分别为12.16 g/L和12.27 g/L。通过第4组和第7组培养基对比可知,第7组残糖量最低,为13.01 g/L,印证了第7组菌体代谢消耗糖的量较高,且菌种产量远高于第4组。比较2组可知,第7组培养基的组合更利于菌体生长,说明磷酸二氢钾和酵母膏含量高不仅有利于多糖生长,同时有利于菌体生长。在第4组和第7组产多糖差不多的条件下,优选第4组培养基配方。
根据各实验组多糖颜色的比较,可以认为有机氮源酵母膏的含量对多糖颜色深浅影响较大。有机氮源添加量少,出芽短梗霉发酵后期产生色素多;反之,发酵后期产生色素少。尤其是第1、6、7组的结果更加印证了此结论。总之,酵母膏添加量不能太少也不宜过高,过高时有利于菌体的生长,却导致多糖产量的降低;酵母膏添加量也不易过低,过低导致黑色素产生过多。综上分析的结论与正交试验得出的最优组合方案相一致。
验证试验:在正交试验最佳组合 A3B1C2下进行发酵,做了3组平行实验,发酵结果如表7所示:

表7 验证试验
4 结语
选择原糖作为碳源发酵生产普鲁兰多糖可以节约经济成本,发酵产生的普鲁兰多糖产量也相比其它碳源要高出16%~53%,同时原糖可以抑制菌体发酵后期黑色素的产生,使得产物普鲁兰多糖的色泽更白,更有利于普鲁兰多糖后期的提纯。通过对发酵培养基成分磷酸二氢钾、有机氮源酵母膏以及无机氮源硫酸铵进行正交优化,确定出最适发酵培养基配方,在最适培养基的条件下,发酵生成的普鲁兰多糖产量可以达到12.39 g/L,多糖转化率可以达到26.65%。
在国内,普鲁兰多糖的开发与应用还处于实验室研究阶段,相比国外尤其是日本大规模的生产和垄断还有较大的差距,使得普鲁兰多糖的市场价格在 150元/kg[15]。而普鲁兰多糖独特的性质以及在食品、医药、日用化工、建材、环保等众多领域上的应用,使其开发和生产的价值更具有较大的前景[16]。广西作为中国的产糖大省,具有丰富的发酵普鲁兰多糖的原料,开发新型多功能普鲁兰多糖的产业链,对广西制糖产业经济转型具有一定的指导意义。
[1] CATLEY B J, RAMSAY A, SERVIS C. Observations on the structure of the fungal extracellular polysaccharide,pullulan [J]. Carbohydrate Research, 1986(153): 79-86.
[2] SINGH R S, SAINI G K, KENNEDY J F. Pullulan:Microbial sources, production and applications[J].Carbohydrate Polymers, 2008, 73(4): 515-531.
[3] 曹飞,任俊,陈福生. 茁霉多糖在食品工业中的应用研究进展[J]. 中国食品与营养,2009(5):31-33.
[4] KUMAR A S, MODY J B. Bacteria exopolysaccharides a perception[J]. Basic Microbiol, 2008(47): 103-117.
[5] 马霞,关凤梅,王瑞明. 新型高分子材料——普鲁兰多糖[J]. 中国酿造,2005(2):9-11.
[6] RAJEEVA G, RANJAN S, MONIKA G, et al.Aureobasidium pullulans, an economically important polymorphic yeast with special reference to pullulan[J].African Journal of Biotechnology, 2010, 9(47):7989-7997.
[7] CHENG K C, DEMIRCI A, CATCHMARK J M..Pullulan: biosynthesis, production, and applications[J].Appl Microbiol Biotechnol, 2011(92): 29-44.
[8] 何凤仪. 原糖的质量与加工[J]. 甘蔗糖业,2007(2):37-44.
[9] HEALD P J, KRISTIANSEN B. Synthesis of polysaccharide by yeast-like forms of Aureobasidium pullulans [J]. Biotechnology and Bioengineering, 1985,27: 1516-1519.
[10] RAM S S, GAGANPREET K S, JOHN F K. Pullulan:Microbial sources, production and applications [J].Carbohydrate Polymers, 2008(73): 515-531.
[11] 焦莎莎,付湘晋,童群义. 短梗霉多糖发酵液后处理工艺研究[J]. 食品与生物技术学报,2007,7(4):93-96.[12] 杨勇杰,姜瑞芝,陈英红,等. 苯酚-硫酸法测定杂多糖含量的研究[J]. 中成药,2005,6(6):706-708.
[13] 冯印,苏安祥,王玉华. 复合诱变选育茁霉多糖高产菌株[J]. 中国酿造,2011,30(8):84-86.
[14] DUAN X H, CHI Z M, WANG L, et al. Influence of different sugars of pullulan production and activities of α-phosphogucose mutase, UDPG-pyrophosphorylase and glucosyltransferase involved in pullulan synthesis in Aureobasidium pullulans Y68[J]. Carbohydrate Polymers,2008(73): 587-593.
[15] 安超,常帆,马赛箭,等. 出芽短梗霉发酵生产普鲁兰多糖研究进展[J]. 陕西农业科学,2012(3):121-124.
[16] REKHA M R, SHARMA C P. Pullulan as a promising biomaterial for biomedical applications: a perspective [J].Trends in Biomaterials Artificial Organs, 2007(20):116-121.
