瓜蒌皮提取物抑制高糖诱导人脐静脉内皮细胞衰老的机制研究
2015-01-13刘思妤卢新华
刘思妤, 卢新华, 谭 斌, 韩 瑛, 谷 彬
(湘南学院基础医学部,湖南 郴州423000)
研究表明,活性氧参与了糖尿病血管并发症的发病机制,高血糖可以促进自由基的产生,诱导血管衰老[1],而血管衰老是增加血管风险的一个重要因素,它能加速糖尿病动脉粥样硬化的进程[2]。高浓度葡萄糖诱导的内皮细胞衰老能通过抑制细胞内ROS 得到缓解,这可能是治疗糖尿病相关的动脉粥样硬化的新目标[3]。同时新近研究也发现活性氧能增加炎症的产生,同时促进血管内皮细胞衰老[4-5]。中药瓜蒌皮是葫芦科植物栝楼或者双边栝楼等的果皮,有利气宽胸、润肺化痰的功效,主要用于治痰热咳嗽、咽痛、胸闷、消渴等疾病[6]。有研究表明,瓜蒌皮提取物能增强清除自由基能力,并且通过清除自由基,减少NO的灭活,对糖尿病大鼠有保护作用[7]。本研究通过提取瓜蒌皮有效成分,采用高糖诱导的内皮细胞衰老模型探索瓜蒌皮提取物有效成分对其的影响及可能机制。
1 材料
1.1 药材及细胞株 实验用瓜蒌皮购自湖南省郴州市老百姓大药房(经湖南省郴州市药品检验所黄丽彬副主任中药师鉴定为葫芦科植物栝楼干燥成熟果皮。本品性状边缘向内卷曲,外表面橙红色或橙黄色,内表面黄白色。质较脆,易折断。具焦糖气,味淡、微酸。薄层色谱鉴别与瓜蒌皮对照品和对照药材相同);HUVECs 购自中科院细胞生物学研究所上海细胞库(编号C-003-5C)。
1.2 主要试剂 胰蛋白酶购自武汉亚法生物技术公司;DMEM 培养基为Hyclone 公司产品;胎牛血清(FBS)为浙江杭州四季青公司产品;MTS 购自Promega 公司,批号G1112;活性氧(ROS)试剂盒,碧云天生物技术研究所出品,批号S0033;β-半乳糖苷酶染色(SA-β-gal)试剂盒,碧云天生物技术研究所出品,批号C0602;PCR 试剂盒购自北京全式金公司;逆转录试剂盒购自美国Fermenta 公司;TRIzol 试剂盒购自美国Invitrogen 公司,批号10296010;其余试剂均为市售分析纯产品。
1.3 仪器 CXK41 荧光倒置显微镜(OLYMPUS);MCO-15AC 二氧化碳培养箱(日本三洋公司);荧光酶标仪(Thermo 公司);PCR 仪、凝胶成像系统(美国Bio-Rad 公司)。
2 方法
2.1 瓜蒌皮提取物的制备 将5 kg 瓜蒌皮粉碎,用70%的乙醇溶解分次冷凝回流,将回流所得溶液浓缩后用三氯甲烷萃取,再将萃取液浓缩至浸膏,即得初提物。采用硅胶柱层析法分离瓜蒌皮的有效成分,经过TLC 法分析选用极性较大的甲醇-三氯甲烷系统作为洗脱剂。收集中间层即得瓜蒌皮有效成分,再将其浓缩回流得有效成分的浸膏,得率为3.16%。将其静置在空气流通处,任其自由挥干。分离得到的浸膏用DMSO 配制成贮备液 (50 mg/mL),DMSO 终浓度控制在0.1%,用0.22 μm 滤器过滤除菌后使用。
2.2 细胞培养及实验分组 人脐静脉内皮细胞株(HUVECs)37 ℃饱和湿度、5% CO2条件培养于含10% 胎牛血清的低糖DMEM 培养基中,将铺满90% 的HUVECs 细胞用0.25% 的胰蛋白酶消化传代,均匀接种于12 孔或96孔的培养板中。实验分组:①正常对照组,培养液为含葡萄糖5.6 mmol/L 的DMEM;②高糖损伤组,培养液为含葡萄糖30 mmol/L 的DMEM;③瓜蒌皮提取物预处理组(瓜蒌皮提取物+高糖组),细胞在处理前使用终质量浓度为12.5、25、50 μg/mL 瓜蒌皮提取物处理1 h,其余处理同高糖损伤组;④高渗组,培养液为含甘露醇30 mmol/L 的DMEM。
2.3 MTS 法检测HUVECs 细胞的存活率 收集对数生长期的HUVECs 以胰酶消化,收集细胞,以1 ×105个/L 的密度接种于96 孔板。孵育24 h 后,用含1% 胎牛血清的培养基同步消化24 h。再根据上述实验分组给药后继续培养48 h,每孔加20 μL 0.5 mg/mL MTS,置于培养箱继续培养1 h。用酶标仪在波长490 nm 处测定各孔的OD 值。细胞存活率(%) =(各实验组平均OD 值/正常对照组平均OD值)×100%。
2.4 细胞衰老SA-β-gal 检测 12 孔板培养处理的细胞,吸除上清液,PBS 洗涤1 次,每孔加入0.5 mL 固定液,室温固定15 min,用PBS 洗涤细胞3 次,每孔加入0.5 mL 染色工作液,37 ℃孵育过夜,普通光学显微镜下观察计数,蓝绿色为SA-β-gal 阳性细胞,衰老率用阳性细胞数/总细胞数×100% 表示。
2.5 细胞内活性氧水平检测 采用ROS 敏感的荧光探针DCFH-DA 测定细胞内活性氧。药物处理后去除上清液,加入适当体积稀释好的DCFH-DA。37 ℃细胞培养箱内孵育20 min。用无血清细胞培养液洗涤3 次,使用荧光酶标仪在488 nm 激发波长,525 nm 发射波长处检测ROS 水平。
2.6 RT-PCR 检测细胞TNF-α、IL-6 mRNA 表达 细胞接种于12 孔培养板培养48 h,加入0.5 mL TRIzol 提取RNA,1% 琼脂糖凝胶电泳鉴定其完整性。TNF-α 引物正向序列5'-GCTGCACTTTGGAGTGATCG-3',反 向 序 列 5'-GCTTGAGGGTTTGCTACAACA-3',扩增产物144 bp;IL-6 引物正向序列:5'-ACCCCCAATAAATATAGGACTGGA-3',反向序列:5'-GAAGGCGCTTGTGGAGAAGG-3',扩增产物128 bp;β-actin 正向序列:5'-TGTACGTTGCTATCCAGGCTGTGCT-3',反向 序 列:5'-GTCAGGCAGCTCGTAGCTCTTCTCC -3',扩增产物为338 bp。PCR 反应条件为94 ℃×2.5 min,而后94 ℃×30 s,60 ℃×30 s,72 ℃×20 s,35 个循环,72 ℃×7 min 扩增得到的产物用2%的琼脂糖凝胶电泳,QuantityOne 软件分析。
2.7 统计学方法 数据采用SPSS 17.0 统计软件进行处理,用均数±标准差表示。各组间差异采用单因素方差分析(One-Way ANOVA),两两组间采用LSD 法,P <0.05认为有统计学差异。
3 结果
3.1 MTS 法检测HUVECs 在不同质量浓度瓜蒌皮提取物作用下的存活率 MTS 比色法检测表明,在同样的培养环境下,对数生长期的内皮细胞经不同质量浓度的瓜蒌皮提取物处理48 h。与正常对照组比较,高糖处理内皮细胞后存活率下降,具有显著差异(P <0.01)。与高糖组比较,药物处理48 h 内皮细胞存活率显著升高,内皮细胞的存活率随着瓜蒌皮提取物药物剂量的逐渐提高显著升高 (P <0.05 或P <0.01),推断不同质量浓度的瓜蒌皮提取物对HUVECs 的存活有明显促进作用。见表1。
表1 瓜蒌皮提取物对HUVECs 存活率的影响(±s,n=6)
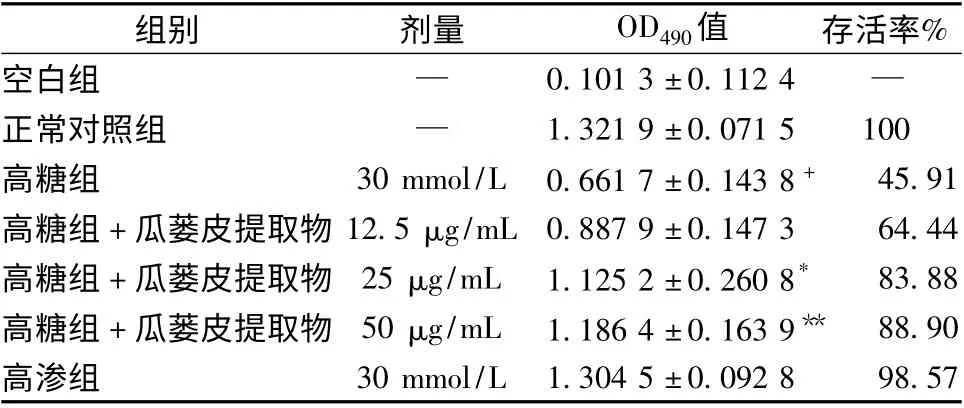
表1 瓜蒌皮提取物对HUVECs 存活率的影响(±s,n=6)
注:与正常对照组比较,+ P < 0.01;与高糖组比较,* P <0.05,**P <0.01
组别 剂量 OD490值 存活率%空白组 — 0.101 3 ±0.112 4—正常对照组 — 1.321 9 ±0.071 5 100高糖组 30 mmol/L 0.661 7 ±0.143 8 + 45.91高糖组+瓜蒌皮提取物12.5 μg/mL 0.887 9 ±0.147 3 64.44高糖组+瓜蒌皮提取物 25 μg/mL 1.125 2 ±0.260 8* 83.88高糖组+瓜蒌皮提取物 50 μg/mL 1.186 4 ±0.163 9** 88.90高渗组30 mmol/L 1.304 5 ±0.092 8 98.57
3.2 瓜蒌皮提取物对高糖诱导内皮细胞衰老SA-β-gal 活性的比较 孵育48 h 后,与正常对照组比较,高糖组SA-βgal 阳性细胞率明显升高(P <0.01)。与高糖组比较,内皮细胞SA-β-gal 阳性细胞率随着瓜蒌皮提取物药物剂量的逐渐提高显著降低(P <0.05 或P <0.01)。渗透压对HUVECs 无影响。见图1。
3.3 瓜蒌皮提取物对高糖诱导细胞内活性氧水平的影响活性氧能促进衰老的发生,通过检测细胞内活性氧水平观察到,孵育48 h 后,与正常对照组比较,高糖组活性氧水平明显升高(P <0.01)。与高糖组比较,内皮细胞活性氧水平随着瓜蒌皮提取物药物剂量的逐渐提高显著降低(P <0.05 或P <0.01)。高渗组活性氧水平与正常对照组相近(P >0.05)。见图2。
3.4 瓜蒌皮提取物对内皮细胞TNF-α 和IL-6 mRNA 表达水平比较 与正常对照组比较,高糖组TNF-α 和IL-6 mRNA 表达明显增加(P <0.01)。与高糖组比较,内皮细胞TNF-α 和IL-6 mRNA 表达水平随着瓜蒌皮提取物药物剂量的逐渐提高显著降低(P <0.05 或P <0.01)。高渗组TNFα 和IL-6 mRNA 表达水平与正常对照组相近(P >0.05)。见图3。
4 讨论
内皮功能障碍是糖尿病动脉粥样硬化发病过程中的一个关键因素。有研究表明动脉粥样硬化斑块处内皮细胞呈现衰老特征,如β-半乳糖苷酶阳性、端粒酶缩短等[8]。越来越多的证据证明,高血糖能加速细胞衰老[9-10],衰老的细胞同时伴随着增殖能力的改变。研究显示,高糖能诱导内皮细胞衰老引起血管内皮完整性的缺失,导致血管并发症[3]。因此本实验利用高糖诱导内皮细胞衰老,探讨瓜蒌皮提取物抑制细胞衰老的作用及其机制。实验显示,体外培养的HUVECs 在高糖条件下48 h,MTS 检测细胞活力明显下降,β-半乳糖苷酶阳性细胞数显著增多。通过硅胶层析法分离的瓜蒌皮醇提物,与高糖损伤组相比,瓜蒌皮提取物能显著抑制高糖诱导的细胞活力下降并减少β-半乳糖苷酶阳性细胞,提示瓜蒌皮提取物对高糖诱导的内皮细胞衰老有较好的抑制作用。

图1 瓜蒌皮提取物对高糖诱导内皮细胞衰老SA-β-gal 活性的影响
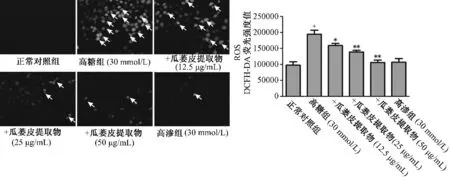
图2 瓜蒌皮提取物对高糖诱导内皮细胞活性氧水平的影响
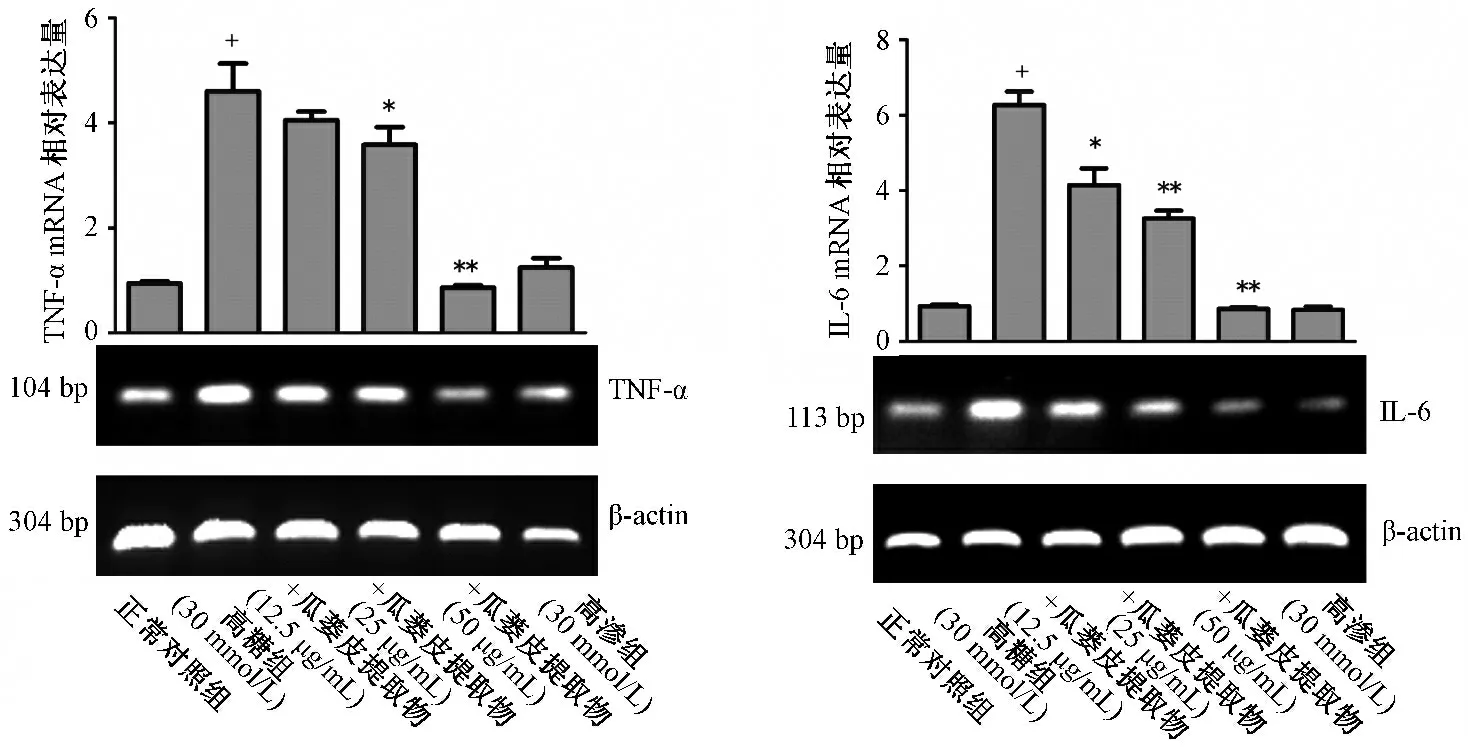
图3 瓜蒌皮提取物对高糖诱导内皮细胞TNF-α 和IL-6 mRNA 表达水平的影响
氧化应激是细胞损伤重要机制,其也是衰老的原因之一。研究表明,高血糖促进氧化应激的发生,使得活性氧生成增加,这是促进内皮细胞损伤加速内皮细胞的衰老[11]。同时衰老与促炎症反应状态相关,促炎细胞因子(如TNF-α、IL-1β、IL-6 等)通过促进ROS 的产生诱导上皮细胞衰老[12]。糖尿病血管衰老与炎症也同样紧密相关,糖尿病血管损伤,内皮衰老常伴有炎症的发生,因此有学者建议把慢性炎症作为衰老的生物标志物[13]。本实验显示,HUVECs 高糖处理48 h,细胞中活性氧水平、TNF-α和IL-6 mRNA 的表达显著升高,这与以往的报道相一致。大量临床研究和动物实验证明,瓜蒌皮提取物具有较强的体内抗氧化活性[14-15]。本研究也显示,瓜蒌皮提取物显著减少高糖诱导的ROS 的增加,同时促炎细胞因子TNF-α 和IL-6 mRNA 的表达显著下降,提示其抑制内皮细胞衰老作用与抗氧化和抗炎作用有关。
综上所述,瓜蒌皮提取物对高糖诱导的HUVECs 衰老具有抑制作用。其机制可能与改善氧化应激和炎症,维持细胞膜的稳定性,提高内皮细胞在高糖环境下的活力有关。这提示瓜蒌皮提取物可能具有改善糖尿病血管功能障碍的潜在药用价值,对防治糖尿病血管并发症有一定意义。
[1] Piconi L,Corgnali M,Da R R,et al. The protective effect of rosuvastatin in human umbilical endothelial cells exposed to constant or intermittent high glucose[J]. J Diabetes Complicat,2008,22(1):38-45.
[2] Kijima E S,Honma R T. 1-Deoxynojirimycin attenuates high glucose-accelerated senescence in human umbilical vein endothelial cells[J]. Exp Gerontol,2014,55(3):63-69.
[3] Zhong W,Zou G,Gu J,et al. L-arginine attenuates high glucose-accelerated senescence in human umbilical vein endothelial cells[J]. Diabetes Res Clin Pract,2010,89(1):38-45.
[4] Daniela L,Alla P,Maurelli R,et al. Anti-inflammatory effects of concentrated ethanol extracts of Edelweiss (Leontopodium alpinum Cass.)callus cultures towards human keratinocytes and endothelial cells [ J ]. Mediators Inflamm, 2012,2012:e498373.
[5] Olivieri F,Lazzarini R,Babini L,et al. Anti-inflammatory effect of ubiquinol-10 on young and senescent endothelial cells via miR-146a modulation[J]. Free Radic Biol Med,2013,63:410-420.
[6] 韦 丰. 皮的药用(十九)[J]. 开卷有益:求医问药,2013(7):37-37.
[7] 罗革灵,陈伟利,谷 彬,等. 瓜蒌皮提取物对糖尿病大鼠血管内皮的保护作用[J]. 中国心血管病研究,2009,7(7):549-551.
[8] 单海燕,白小涓,王鹤智,等. Valsartan 延缓血管内皮细胞衰老及p16INK4a 表达变化的研究[J]. 中国动脉硬化杂志,2012,20(10):881-884.
[9] Hayashi T,Kotani H,Yamaguchi T,et al. Endothelial cellular senescence is inhibited by liver X receptor activation with an additional mechanism for its atheroprotection in diabetes[J]. Proc Natl Acad Sci USA,2014,111(3):1168-1173.
[10] Arunachalam G,Samuel S M,Marei I,et al. Metformin modulates hyperglycaemia-induced endothelial senescence and apoptosis through SIRT1[J]. Br J Pharmacol,2014,171(2):523-535.
[11] Eckers A,Altschmied J,Haendeler J. Oxidative stress in endothelial cells and in diabetes type 2[J]. Z Gerontol Geriatr,2012,45(2):90-94.
[12] Sasaki M,Ikeda H,Sato Y,et al. Proinflammatory cytokine-induced cellular senescence of biliary epithelial cells is mediated via oxidative stress and activation of ATM pathway:a culture study[J]. Free Radic Res,2008,42(7):625-32.
[13] Singh T,Newman A B. Inflammatory markers in population studies of aging[J]. Ageing Res Rev,2011,10(3):319-29.
[14] 卢鹏飞,施伟丽,王志国,等. 瓜蒌皮的临床应用及作用机制[J]. 中医杂志,2013(16):1428-1431.
[15] 谭 斌,刘 韵,王俊杰,等. 瓜蒌皮提取物对大鼠血管内皮损伤的保护作用[J]. 中国现代医药杂志,2010,12(9):9-11.
