基于NF-κB通路探讨疏肝健脾含药血清对LPS刺激下大鼠肝细胞、Kup ffer细胞炎症损伤保护作用机制研究
2015-01-13龚享文杨钦河闫海震张玉佩李媛媛徐拥建张金文林春梅
韩 莉, 龚享文, 杨钦河*, 闫海震, 张玉佩, 李媛媛, 徐拥建, 张金文,林春梅
(1.暨南大学附属第一医院,广东广州510632;2.暨南大学医学院,广东广州510632)
基于NF-κB通路探讨疏肝健脾含药血清对LPS刺激下大鼠肝细胞、Kup ffer细胞炎症损伤保护作用机制研究
韩 莉1, 龚享文2, 杨钦河2*, 闫海震2, 张玉佩2, 李媛媛2, 徐拥建2, 张金文2,林春梅2
(1.暨南大学附属第一医院,广东广州510632;2.暨南大学医学院,广东广州510632)
目的基于核转录因子kappaB(nuclear transcription factor-kappaB,NF-κB)信号通路探讨脂多糖(lipopolysaccharides,LPS)刺激大鼠肝细胞及Kupffer细胞炎症损伤以及疏肝健脾含药血清的保护作用。方法通过体外培养以及免疫荧光鉴定SD大鼠肝细胞及Kupffer细胞,利用LPS刺激大鼠肝细胞及Kupffer细胞产生炎症反应,酶联免疫法检测肝细胞及Kupffer细胞培养上清液中白介素-1(interleukin-1,IL-1)、人血清淀粉样蛋白(seruMamyloid A,SSA)的表达,Western blot法检测大鼠肝细胞及Kupffer细胞NF-κB通路相关蛋白的表达。结果每只大鼠通过纯化后获得肝细胞数量1.5×108~2.0×108个,Kupffer细胞数量0.5×107~1.0×107个,Typan blue染色测定肝细胞及Kupffer细胞活力均可达到95%以上。LPS组肝细胞及Kupffer细胞较空白血清组IL-1、SSA水平均有显著升高 (P<0.01)。而与LPS组比较,药物干预组可显著降低 (P<0.01)。肝细胞、Kupffer细胞的蛋白表明,与空白血清组比较,LPS组肝细胞及Kupffer细胞NF-κB、IκB及磷酸化IKKβ蛋白表达均有显著升高(P<0.01);与LPS组比较,疏肝健脾方药含药血清能显著下调肝细胞IκB及p-IKKβ蛋白的蛋白表达水平(P<0.01),但NF-κB蛋白表达水平无显著差异(P>0.05),疏肝健脾含药血清能下调Kupffer细胞NF-κB、IκB及p-IKKβ蛋白表达(P<0.01)。结论疏肝健脾含药血清能够对LPS刺激大鼠肝细胞、Kupffer细胞炎症损伤产生保护作用,其机制可能与NF-κB信号通路相关。
疏肝健脾方药;NF-κB通路;肝细胞、Kupffer细胞;LPS刺激;炎症损伤;含药血清
疏肝健脾方药由参苓白术散和柴胡疏肝散组成,其具有疏肝健脾,理气祛湿的临床疗效,既往研究表明,疏肝健脾方能够起到改善非酒精性脂肪性肝病患者临床症状、调节肝功以及降低血脂的效果[1]。其可能与疏肝健脾方药能够通过肝细胞、Kupffer细胞NF-κB通路,使IL-1、TNF-α、IL-6等炎症介质表达降低,从而减轻炎症损伤相关[2-4],但其具体途径有待于进一步研究。本次研究基于体外培养大鼠肝细胞、Kupffer细胞,通过疏肝健脾含药血清进行干预,从体外实验角度探讨疏肝健脾方药作用途径及机制。
1 材料与方法
1.1 动物及分组 选用SPF级SD大鼠30只,雌雄各半,体质量 (200±20)g之间,购自暨南大学动物实验管理中心,许可证号SYXK(粤)2012-0117。各组大鼠依据随机数字表法可分为正常组、细胞提取组,含药血清提取组,每组各10只。
1.2 药物及动物分组 疏肝健脾方药是参苓白术散及柴胡疏肝散按1∶1比例的组合而成。参苓白术散:茯苓15 g、白术15 g、人参15 g、山药15 g、白扁豆12 g、莲子9 g、薏苡仁9 g、炙甘草9 g、砂仁6 g、桔梗6 g。柴胡疏肝散:柴胡6 g、陈皮6 g、枳壳5 g、香附5 g、白芍5 g、川芎5 g、炙甘草3 g。两方均为中药配方颗粒剂,由中国深圳华润三九公司提供,各方药物剂量和方剂组成参考国家《方剂学》教材[5]。疏肝健脾方药组含药血清的制备参考李仪奎等[6-7]的方法,其剂量为59.5 g/kg,该剂量是在体实验剂量11.9 g/kg的5倍[8],而正常组及细胞提取组给予等体积的生理盐水灌胃。
1.3 试剂与仪器 胎牛血清(购自美国Hyclone公司);Rabbit polyclonal to CK 18(Lot:20110823)、Goat anti-Rabbit IgG(H+L),FITC conjugated Rabbit polyclonal to ED1(Lot:100346)(购自中国镇江厚普生物科技有限公司),IV型胶原酶 (购自美国Gbico公司);LPS(Lot# 072M4100V)(购自美国Sigma公司);IL-1试剂盒 (购自中国上海依科赛生物制品有限公司)、SSA试剂盒 (购自中国上海蓝基生物科技有限公司);NF-κB p65抗体、IKKβ抗体、p-IKKβ抗体(购自美国CST公司);CO2细胞培养箱(购自美国Thermo Scientific公司);ELISA检测仪(购自美国Thermo Scientific公司);冷冻离心机(购自德国Hamburg公司);电泳仪、凝胶成像系统 (购自美国BIORAD公司)。
1.4 含药血清制备 SD大鼠常规喂养1周。第8天起开始灌胃给予干预措施 (分别给予药物和生理盐水),连续给予3 d,每天2次,每12 h一次。干预结束后,通过腹主动脉采血,通过3 000 r/min离心后分离血清,而后热灭活处理,0.22μm微孔滤膜进行过滤除去细菌,冰冻保存。
1.5 细胞提取及培养 大鼠肝细胞及Kupffer细胞分离与鉴定:采用离体循环灌注,差速离心法提取大鼠肝细胞及Kupffer细胞,具体方法参照本课题组前期方案[9],分离获得肝细胞及Kupffer细胞,将其接种在细胞培养瓶,并置于37℃的CO2培养箱中进行培养。
1.6 LPS刺激肝细胞及Kup ffer细胞及药物干预 将大鼠肝细胞和Kupffer细胞分为6组,每组6孔,具体干预方案:空白血清组 (A组):20%空白血清;LPS组 (B组):20%空白血清+LPS(40 mg/L);疏肝健脾组 (C组):20%疏肝健脾含药血清+LPS(40mg/L)。
1.7 指标检测
1.7.1 显微镜观察肝细胞及Kupffer细胞形态、状态及免疫荧光鉴定 Typan blue染色后,应用倒置相差显微镜,在血细胞计数板上对所获细胞进行常规计数,并镜下观察大鼠肝细胞及Kupffer细胞状态,运用免疫荧光对大鼠肝细胞及Kupffer细胞进行细胞鉴定。
1.7.2 ELISA法检测大鼠肝细胞及Kup ffer细胞上清IL-1、SSA 当每孔大鼠肝细胞及Kupffer数量分别不少于1×104个时,加入不含血清的DMEM/F12基础培养基,之后再依据各组既定的干预方案添加药物至所需的目标浓度后,再分别将大鼠肝细胞及Kupffer细胞放回细胞培养箱中继续培养,24 h后分别吸取大鼠肝细胞及Kupffer细胞上清,保存备用。用ELISA法检测大鼠肝细胞及Kup ffer细胞上清IL-1、SSA的表达水平。
1.7.3 Western blot法检测大鼠肝细胞及Kupffer细胞NF-κB相关通路蛋白表达水平 取适量的细胞裂解液,在使用前3~5 Min内加入苯甲基磺酰氟,使得苯甲基磺酰氟最终浓度可以达到1 mmol/L。按照5×106~10×106个肝细胞或Kupffer细胞加入1 ML蛋白质裂解液,4℃,10 000~14 000×g,离心5~10 min,吸取上清,留下肝细胞或Kupffer细胞的沉淀备用。蛋白含量的测定选用碧云天BCA蛋白浓度试剂盒,操作严格按照说明书。肝细胞及Kupffer细胞样本通过凝胶电泳,转膜,封闭,一抗,孵育,4℃过夜,洗涤,二抗,再孵育及洗涤,化学发光,曝光,显影,定影等步骤,再对结果进行光密度扫描分析。
1.8 统计学分析 用SPSSForWindows13.0软件进行统计分析,用均数±标准差 (x±s)表示,各组间比较采用完全随机设计资料的方差分析,检验水准为α=0.05,P<0.05有统计学差异。
2 结果
2.1 细胞数量 每只大鼠所获肝细胞数量为1.5×108~2.0×108个,Kupffer细胞数量为0.5×107~1.0×107个。吸净细胞培养基后,采用PBS进行细胞冲洗,再用胰蛋白酶进行消化,后行台盼蓝染色,测定肝细胞及Kupffer细胞的活力均可达95%以上。
2.2 细胞形态以及荧光鉴定 倒置相差显微镜下大鼠肝细胞呈圆形或椭圆形,边界清晰,色泽光亮,体积增大,边缘伸展(图1-A)。Kupffer细胞呈圆点形状,体积较肝细胞小,贴壁后Kupffer细胞呈梭形,部分有伪足 (图1-B)。CK18对肝细胞进行免疫荧光鉴定,肝细胞释放出绿色荧光,CK18阳性表达,提示为肝细胞 (图1-D)。采用ED1对Kupffer细胞做免疫荧光鉴定,可见梭形的Kupffer细胞呈绿色荧光,ED1阳性表达,提示为Kup ffer细胞(图1-D)。

图1 细胞形态及免疫荧光鉴定
2.3 细胞状态
2.3.1 肝细胞形态 空白血清组肝细胞生长状态良好,色泽光亮,部分肝细胞体积明显增大,呈现细胞分裂增殖,而LPS组可见部分肝细胞脱落,肝细胞浆里出现大小不一的空泡,细胞胞浆的颜色明显变淡,部分肝细胞里的胞核消失,肝细胞形态明显不规则,疏肝健脾组与空白血清组比较未见显著差异 (见图2)。
2.3.2 Kupffer细胞形态 空白血清组Kupffer细胞贴壁生长,少见细胞脱落,细胞多有伪足,呈健康的梭形细胞形态。LPS组可见大量细胞脱落或细胞挛缩成小圆点,贴壁细胞极少,细胞核不可见,伪足基本全部消失。疏肝健脾方组与空白血清组比较未见明显差异 (见图3)。
2.4 ELISA法检测肝细胞及Kupffer细胞上清液中IL-1,SSA的表达水平 LPS组与空白血清组比较,肝细胞及Kupffer细胞IL-1、SSA的表达水平均有显著升高(P<0.01)。疏肝健脾组与LPS组比较,肝细胞及Kupffer细胞中IL-1、SSA的表达水平呈显著降低 (P<0.01),见图4、5。

图2 肝细胞形态

图3 Kup ffer细胞形态
2.5 Western blot法检测大鼠肝细胞NF-κB相关通路蛋白表达水平 LPS组与空白血清组比较,肝细胞NF-κB、IκB、IKKβ蛋白表达均有显著升高 (P<0.01);疏肝健脾组与LPS组比较,疏肝健脾含药血清不能下调肝细胞NF-κB蛋白下调(P>0.05),能下调肝细胞IκB、IKKβ的蛋白表达水平,相互间比较有显著差异 (P<0.01),见图6。

图4 肝细胞及Kupffer细胞IL-1表达

图5 肝细胞及Kupffer细胞SSA表达
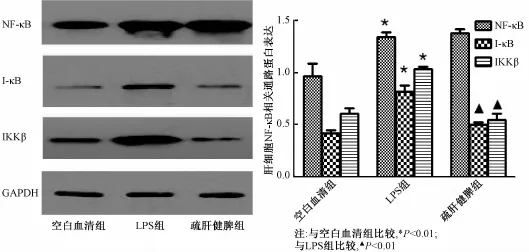
图6 肝细胞NF-κB信号通路相关蛋白灰度值及表达水平比较
2.6 Western blot法检测大鼠Kupffer细胞NF-KB相关通路蛋白表达水平 LPS组与空白血清组比较:Kupffer细胞NF-κB、IκB、IKKβ蛋白表达均有显著升高(P<0.01);疏肝健脾组与LPS组比较:疏肝健脾含药血清能下调NF-κB、IκB、IKKβ蛋白下调(P<0.01),见图7。
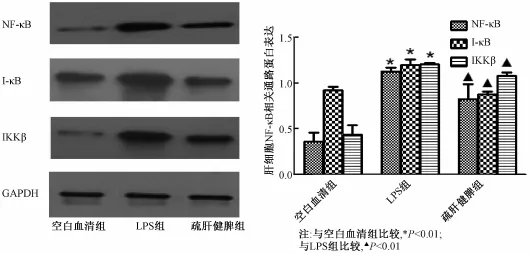
图7 Kup ffer细胞NF-κB信号通路相关蛋白灰度值及表达水平比较
3 讨论
前期研究表明,长期高脂饲料喂养能够诱导大鼠肝组织呈现典型NASH炎症损伤病理改变,但具体机制有待于进一步研究。 “肠-肝”轴学说可能有助于该现象的阐释,也给NASH的发病机制的深入研究提供了新的方向[10-11]。研究表明,高脂饮食可造成肠内养料来源的减少、改变肠道的细菌氧化还原状态以及破坏菌群的微环境,从而影响肠道菌群的构成[12-14]。肠道微生态的破坏可以导致肠道内粪便中拟杆菌等有害菌增加,而双歧杆菌等益生菌减少[15-16]。大量肠道寄存的阴性杆菌可以释放大量内毒素(尤其是LPS),通过肠-肝血液循环进入肝脏,激活Kupffer细胞以及诱导细胞因子的产生和增加。同时肠道细菌性质和数量的变化也可导致肠道通透性增高以及肠道内毒素易位,诱导肝脏多种炎性细胞的转录基因及细胞因子的激活[17-18]。LPS来源于革兰氏阴性菌外膜,是肠源性内毒素最重要的组成部分之一。本研究表明,LPS能够刺激肝细胞和Kupffer细胞产生炎症损伤,诱导炎症因子IL-1,SSA表达明显增加,并较LPS组有显著性统计学差异。提示:LPS能够对同时诱导肝细胞和Kupffer细胞两种细胞产生炎症损伤。这与Zenewicz,Zeng等的研究结果相一致[19-20]。
前期研究表明高脂饮食诱导NASH肝组织炎症损伤与IKKβ/NF-κB信号通路活化密切相关,并且肝细胞、Kupffer细胞NF-κB、IκB蛋白及IKKβ磷酸化表达明显增高[2-3,21]。本研究也表明在LPS的刺激下能够激活IκB蛋白、NF-κB蛋白增加并使IKKβ磷酸化、并较对照组有显著性统计学差异 (P<0.01)。这与前期体内实验结果相吻合。提示:LPS通过NF-κB信号通路在NASH发病中重要的作用。其具体作用机制可能与LPS刺激可以激活IKK复合物相关。IκB激酶(IKK)复合物是激活NF-κB信号通路主要调节器[22]。IκB激酶复合物包含两个催化亚基:IKKα和IKKβ以及调节亚基IKKγ,其通过磷酸化IκB蛋白介导NF-κB活化响应于各种刺激。LPS刺激IκB蛋白磷酸化,泛素化,使NF-κB细胞核定位点暴露出来,进入细胞核后参与NF-κB依赖的基因的调节[23-24]。激活的NF-κB释放大量炎症介质又反馈加强IKKβ活化,形成IKKβ-NF-κB恶性循环而加重肝脏炎症损害[25]。
既往研究表明:疏肝健脾方药能够通过肝细胞及Kupffer细胞NF-κB信号通路对高脂饮食诱导NASH炎症损伤发挥保护作用,但其作用途径有待于进一步研究[2-3]。中药化学研究表明,疏肝健脾方药含有橙皮苷、阿魏酸、柚皮苷等活性成分,而上述成分被证实具有的抗炎作用[26]。含药血清用于体外细胞培养将为疏肝健脾方药的作用途径提供了新的研究方向。将药物经口给药后,取其含药血清作为药物源加入到离体的反应系统中从而研究其含药血清的药理作用,更加能够反映药物在体内环境中所产生药理效应,其原有药物成分或可在体内转化成为药物的活性成分,或这经代谢后失活,也可能经第二信使而发挥间接作用,所有这些均可通过血清药理学研究所反映出来,从而使理论上更具科学性和真实性[27-28]。本次研究成功地从SD大鼠中提取并制备疏肝健脾含药血清,并对LPS刺激大鼠体外肝细胞、Kup ffer细胞造成的炎症损伤进行含药血清干预,结果表明,疏肝健脾组大鼠肝细胞及Kupffer细胞状态与正常血清组无显著差异,并且疏肝健脾组IL-1、SSA炎症介质释放也较LPS组显著减少,同时疏肝健脾含药血清对肝细胞IκB蛋白、IKKβ磷酸化及Kupffer细胞NF-κB、IκB蛋白、IKKβ磷酸化蛋白的表达具有明显的抑制作用。该结果提示:疏肝健脾含药血清调控Kupffer细胞NF-κB信号通路相关蛋白表达及活化,减少炎症介质 (IL-1,SSA)的释放,减轻炎症反应。
[1]李玉权,杨钦河,谢维宁,等.疏肝健脾法治疗非酒精性脂肪肝35例[J].中医杂志,2007,48(9):824-825.
[2]杨钦河,徐拥建,冯高飞,等.疏肝健脾方药对NASH大鼠原代肝细胞NF-κB信号通路相关基因及蛋白表达的影响[J].中药材,2013,36(9):1469-1476.
[3]韩 莉,杨钦河,杨雪松,等.疏肝健脾方药对NASH大鼠Kupffer细胞NF-κB p65和IKKβmRNA及蛋白表达的影响[J].中国病理生理杂志,2013,29(4):641-646.
[4]金 玲,杨钦河,张玉佩,等.疏肝健脾方药对非酒精性脂肪性肝炎大鼠肝组织TNF-α、IL-6及IL-1的影响[J].暨南大学学报:自然科学与医学版,2012,33(2):161-166.
[5]段富津.方剂学[M].上海:上海科学技术出版社,1995:114-115,178-179.
[6]李仪奎.中药血清药理学实验方法的若干问题[J].中药新药与临床药理,1999,10(2):31-34.
[7]李仪奎,吴健宇.中药血清药理实验方法及其评价[C]//中华人民共和国国家中医药管理局、世界卫生组织.国际传统医药大会论文摘要汇编.中华人民共和国国家中医药管理局、世界卫生组织,2000:1.
[8]魏 波,杨钦河,王文晶,等.疏肝健脾方对NASH大鼠肝组织IKKβmRNA和蛋白表达的影响[J].中国病理生理杂志,2012,28(8):1448-1454.
[9]冯高飞,杨钦河,王文晶,等.非酒精性脂肪性肝炎大鼠肝细胞和库普弗细胞同时分离及鉴定[J].广东医学,2012,33(1):40-43.
[10]Hojo M,Watanabe S.Pharmacological therapy of nonalcoholic steatohepatitis[J].Hepatol Res,2011,41(3):209-216.
[11]Compare D,Coccoli P,Rocco A,etal.Gut-liver axis:the impact of gutmicrobiota on non alcoholic fatty liver disease[J]. Nutr Metab Cardiovasc Dis,2012,22(6):471-476.
[12]Ley R E,Turnbaugh P J,Klein S,et al.Microbial ecology:human gutmicrobes associated with obesity[J].Nature,2006,444(7122):1022-1023.
[13]Resta SC.Effects of probiotics and commensals on intestinalepithelial physiology:implications for nutrient handling[J].J Physiol,2009,587(17):4169-4174.
[14]Attene-Ramos MS,Nava G M,Muellner MG,et al.DNA damage and toxicogenomic analysesof hydrogen sulfide in human intestinal epithelial FHs 74 Int cells[J].Environ Mol Mutagen,2010,51(4):304-314.
[15]de La Serre C B,Ellis C L,Lee J,et al.Propensity to high-fat diet-induced obesity in rats is associated with changes in the gut microbiota and gut inflammation[J].AMJ Physiol Gastrointest Liver Physiol,2010,299(2):G440-G448.
[16]Hekmatdoost A,FeizabadiMM,Djazayery A,etal.The effectof dietary oils on cecalmicroflora in experimental colitis in mice[J].Indian JGastroenterol,2008,27(5):186-189.
[17]Nagata K,Suzuki H,SakaguchiS.Common pathogenic mechanisMin developmentprogression of liver injury caused by non-alcoholic or alcoholic steatohepatitis[J].JToxicol Sci,2007,32(5):453-468.
[18]Vajro P,Paolella G,Poeta M,et al.Pediatric non alcoholic fatty liver disease:more on novel treatment targets[J].BMC pediatrics,2013,13(1):109.
[19]Zenewicz L A,Yancopoulos GD,Valenzuela DM,et al.Interleukin-22 but not interleukin-17 provides protection to hepatocytes during acute liver inflammation[J].Immunity,2007,27(4):647-659.
[20]ZengW,Zhang J,Li Y,etal.A new method to isolate and culture rat Kupffer cells[J].PloS one,2013,8(8):e70832.
[21]杨钦河,闫海震,张玉佩,等.疏肝健脾方药对非酒精性脂肪性肝炎大鼠肝组织核因子-κBmRNA及蛋白表达的影响[J].中国老年学杂志,2013,33(2):324-328.
[22]Hinz M,ScheidereitC.The IκB kinase complex in NF-κB regulation and beyond[J].EMBO reports,2014,15(1):46-61.
[23]Oeckinghaus A,Hayden MS,Ghosh S.Crosstalk in NF-[kappa]B signaling pathways[J].Nat Immun,2011,12(8):695-708.
[24]Baker R G,Hayden MS,Ghosh S.NF-κB,inflammation,and metabolic disease[J].Cell Metabol,2011,13(1):11-22.
[25]Sunami Y,Leithäuser F,Gul S,et al.Hepatic activation of IKK/NFκB signaling induces liver fibrosis viamacrophage-mediated chronic inflammation[J].Hepatology,2012,56(3):1117-1128.
[26]王术玲,贾 薇,高晓玲.柴胡疏肝散水提液HPLC特征图谱研究及指标成分的测定[J].中成药,2012,34(12):2384-2388.
[27]杨 萃.中药复方在体外实验的研究进展[J].光明中医,2013,28(10):2229-2231.
[28]刘 红.中药复方药理研究方法进展—血清药理学[J].湖北民族学院学报:医学版,2004,21(4):38-40.
R285.5
:B
:1001-1528(2015)05-1114-06
10.3969/j.issn.1001-1528.2015.05.044
2014-02-12
国家自然科学基金项目 (30973694);广东省科技计划资助项目 (2013B021800164)
韩 莉 (1963—),女,硕士,副主任医师,从事中西医结合肝病基础与临床研究。
*通信作者:杨钦河 (1961—),男,博士,教授,主任医师,博士生导师,从事中西医结合肝病研究。E-mail:tyangqh@jnu.edu.cn
