麦角甾醇在小鼠体内药代动力学及生物利用度
2015-01-13孙嘉辰陈玉皎吴玥婷张晓倩杜思邈张耀洲
孙嘉辰, 陈玉皎, 吴玥婷, 张晓倩, 杜思邈, 张耀洲,3*
(1.天津中医药大学,天津300193;2.天津国际生物医药联合研究院,天津300457;3.天津大学,天津300072)
[制 剂]
麦角甾醇在小鼠体内药代动力学及生物利用度
孙嘉辰1,2, 陈玉皎1,2, 吴玥婷1,2, 张晓倩2,3, 杜思邈2, 张耀洲1,2,3*
(1.天津中医药大学,天津300193;2.天津国际生物医药联合研究院,天津300457;3.天津大学,天津300072)
目的研究蛹虫草的麦角甾醇在小鼠体内的药动学和口服生物利用度。方法100只健康的昆明种小鼠,随机分为2组,定时采血,用反相高效液相色谱法测定小鼠分别经灌胃和尾静脉注射给予10 mg/kg麦角甾醇后的血药浓度。Kinetica软件进行房室模型拟合并计算药代动力学参数和绝对生物利用度。结果麦角甾醇在0.06~60μg/mL质量浓度范围内线性关系良好(r=0.999 7);低(0.23μg/mL)、中 (3.75μg/mL)、高(60μg/ML)3个质量浓度的绝对回收率分别为 (102.0±10.2)%、 (94.4±13.2)%和 (101.3±8.7)%;日内RSD分别为10.8%、9.6%和8.0%,日间RSD分别为12.0%、8.8%和12.8%。小鼠口服及静注麦角甾醇后的药-时曲线均符合二室模型,两种给药方式的 T1/2α分别为 (1.546 3±0.004 9)h和 (0.349 3±0.003 5)h,T1/2β分别为 (2.99±0.16)h和(3.31±0.02)h,K10分别为 (0.349 0±0.009 1)/h和(0.388 7±0.001 2)/h,K12分别为 (0.153 8±0.005 4)/h和(0.736 5±0.005 3)/h,K21分别为 (0.038 4±0.003 1)/h和(1.068 5±0.015 1)/h,Vc分别为 (81.61±0.75)mL和(71.27±0.08)mL。采用非房室模型法计算,灌胃组小鼠的T1/2为 (6.34±0.07)h,AUC0-t为 (300.68±0.96)μg·h/mL,尾静脉注射组小鼠的T1/2为 (5.58±0.06)h,AUC0-t为 (396.64±0.11)μg·h/mL。按剂量折算,麦角甾醇经灌胃给药的绝对生物利用度为74.72%。结论麦角甾醇经口服途径给药的生物利用度与静脉给药存在明显差异可能与其水溶性较差有关。
蛹虫草;麦角甾醇;小鼠;灌胃;尾静脉给药;药动学;绝对生物利用度
蛹虫草又被称为北冬虫夏草,是世界广布种,是目前研究最多的虫草之一。由于较易栽培,样品容易得到,它实际上是目前分离出化合物最多的虫草[1]。大量报道表明蛹虫草菌丝体、生药、醇提物、水提物等提取物具有广泛药理活性,包括免疫调节、抗疲劳、抗惊厥、镇静、抗癌、抗菌、抗肝纤维化、抗糖尿病、抗炎和雄性激素样作用等[2]。麦角甾醇(ergosterol)是蛹虫草中主要的甾醇类化合物[3],活性指导下分离蛹虫草得到的麦角甾醇,具有抗肿瘤活性[4-5]。生物活性的化合物能否在生物体内发挥效应,很大程度上取决于血浆中药物浓度和生物利用度,但其口服生物利用度研究尚未见文献报道。本研究采用HPLC分析方法测定小鼠灌胃和静脉给予麦角甾醇后不同时间点的血药浓度,进而研究麦角甾醇在小鼠体内的药动学特征及口服生物利用度,为麦角甾醇不同剂型的制备以及临床应用提供理论依据。
1 材料
1.1 药物与试剂 麦角甾醇对照品(SIGMAALDRICH公司,批号45480-50G-F,纯度≥95%)。蛹虫草购于正源堂 (天津)生物科技有限公司。色谱纯无水乙醇购于天津康科德试剂有限公司,超纯水为Mili-Q级,实验室自制(κ=18.2 MΩ· cm)。
1.2 仪器 日本HITACHI高效液相色谱仪(L-2400检测器,L-2200自动进样器,L-2130泵,温控箱,HITACHI色谱工作站);Kromasil C18色谱柱(4.6 mm×250 mm,5μm,100Å)。电子分析天平(AB204-A,梅特勒-托利多上海仪器公司);注射器 (上海治宇医疗器械有限公司);秒表;台式冷冻离心机(德国HITTICH公司);微量移液枪(美国RAININ公司);漩涡混合器 (宁波新芝生物科技股份有限公司);针头式滤膜 (纤维素型0.22μm);Mili-Q超纯水系统(Milipore,USA);氮吹仪 (杭州蓝焰科技有限公司)。
1.3 动物 100只健康的昆明种小鼠,体质量18~22 g,购自北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2012-0001,合格证号11400700020779。在温度20~22℃,相对湿度45%~65%,光照黑暗12 h/12 h条件下饲养自由饮食饮水,适应性饲养1周后开始实验。实验前禁食不禁水12 h,随机分成2组,每组50只雌雄各半,分别为10 mg/kg灌胃给药组和10 mg/kg静脉注射给药组。
2 方法
2.1 蛹虫草中麦角甾醇的制备 取蛹虫草5 000 g,-20℃超微粉碎,加5倍量丙酮提取3次,每次4 h,合并滤液,回收丙酮,得浓浸膏,将浓浸膏挥去丙酮后,用50%正己烷-50%乙醇溶解,流动相为正己烷和乙醇,通过动态轴向压缩工业制备色谱分离纯化,得到麦角甾醇供试品。用8%的乙醇-水溶液溶解对照品和供试品,分别吸取麦角甾醇对照品溶液和供试品溶液10μL,通过高效液相色谱 (HPLC)法检测,按相同的色谱条件测定,以面积归一化法计算供试品溶液麦角甾醇纯度98.2%,保留时间17.2 min。麦角甾醇样品经EIMS分析,m/z396.4[M]+,计算得相对分子质量396,确定为麦角甾醇[6],见图1、2。
2.2 药液的配制 灌胃给药溶液:用0.2%吐温80-水溶液溶解,混合均匀,配制成0.25mg/mL溶液 (临用前配制)。静脉给药溶液:用5%无水乙醇-生理盐水溶解,混合均匀,配制成1 mg/mL溶液 (临用前配制)。

图1 麦角甾醇的HPLC检测图Fig.1 HPLC chromategraMs of ergosterol
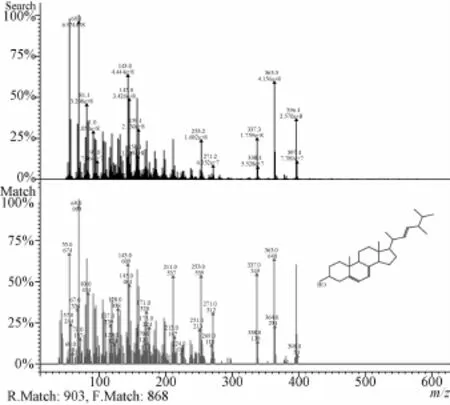
图2 麦角甾醇供试品的EI-MS图Fig.2 EI-MS chromatograms of ergosterol samples
2.3 给药与样品采集 将100只小鼠随机分为2组,每组50只,雌雄各半,在给药前每组均禁食不禁水12 h,分别为口服灌胃组 (10 mg/kg)和尾静脉给药组(10 mg/kg),每组又随机分为15 min、30 min、45 min、1 h、2 h、4 h、6 h、8 h、10 h、24 h取血组。采血0.2 ML注入肝素化抗凝管中,4℃、6 000 r/min离心10 min取血浆,-80℃冰冻保存,备用。
2.4 标准溶液的制备 精确称取麦角甾醇25 mg于25 ML量瓶中,用无水乙醇溶解并定容至25 mL,得1 mg/mL的麦角甾醇标准贮备液,于4℃保存,以此来配制系列质量浓度的麦角甾醇标准工作液 (临用前稀释)。
2.5 血浆样品处理 准确吸取待测的肝素抗凝小鼠血浆样品100μL,加入1 mL无水乙醇溶液,漩涡混匀,4℃、16 000 r/min离心10 min,取上清液,氮吹仪中吹干,干燥后的样品加入100μL无水乙醇复溶样品,漩涡混匀,4℃、16 000 r/min离心10 min,取上清液,备用。
2.6 色谱条件 Kromasil C18色谱柱(4.6 mm× 250 mm,5μm,100Å);柱温35℃;流动相为乙醇-水(85∶15,V/V);体积流量0.8 ML/min;检测波长292 nm;进样量20μL(进样前使用0.22 μm纤维素型微孔滤膜过滤)。
2.7 数据分析 将实验所得的血药浓度数据采用Kinetica 4.4软件进行模型拟合,以曲线拟合优度、AIC值等为标准确定最佳房室模型,并计算麦角甾醇的药代动力学参数。灌胃实验所得的血药浓度数据采用非房室模型法计算药代动力学参数,将静注实验所得的血药浓度数据采用同法处理,对两种给药途径的参数进行比较。麦角甾醇灌胃后药物的绝对生物利用度按照公式 (1)计算,AUCig为灌胃时的AUC;AUCiv为静注时的AUC;Dig为灌胃药物剂量;Div为静注药物剂量。
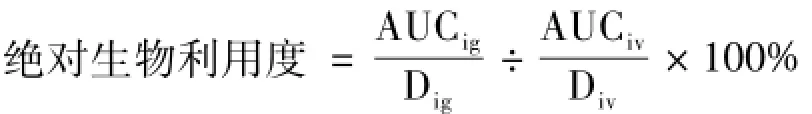
3 结果
3.1 方法专属性 空白血浆、空白血浆加20 mg/L麦角甾醇对照品、口服麦角甾醇后0.5 h的血浆样品和口服麦角甾醇后2 h的血浆样品各5份,按 “血浆样品处理方法”处理,分别进样、测定,经HPLC分析测定得到的色谱图见图3。由图3可见在本实验条件下,血浆中麦角甾醇的出峰位置与空白血浆加入对照品的出峰位置基本相同,保留时间为12.8 min,并且在空白血浆样品色谱图中未出现内源性杂质的干扰峰,表明血浆中的内源性物质不会干扰麦角甾醇的测定,方法的专属性良好。
3.2 标准曲线及线性范围 精密吸取小鼠血浆置于1 mL离心管中,每份90μL,分别加入麦角甾醇标准溶液10μL,使血浆中药物质量浓度分别为0.06、0.23、0.94、3.75、15、60μg/mL,摇匀,再按“血浆样品处理方法”处理,测定麦角甾醇峰面积,以峰面积为纵坐标 (Y),以所对应各点质量浓度为横坐标 (X)进行直线回归绘制标准曲线,得麦角甾醇的标准曲线回归方程为Y=5 674.1X-1 137.3,r=0.999 7。结果表明,血浆中麦角甾醇在0.06~60 μg/mL范围内线性关系良好。

图3 小鼠血浆中麦角甾醇的HPLC色谱图Fig.3 HPLC chromatograMs of ergosterol in Mice plasma
3.3 绝对回收率试验 取麦角甾醇标准贮备液及小鼠空白血浆,分别配制低、中、高3个质量浓度(0.23、3.75、60.00μg/mL)的麦角甾醇血浆标准品溶液,每个质量浓度5份,再按 “血浆样品处理方法”处理后检测,记录麦角甾醇的峰面积,为血浆标准的峰面积。另取锥形试管3支,一个一组;每组加入与配制血浆对照品溶液相同的麦角甾醇对照品溶液,直接吹干后用流动相100μL复溶,20 μL进样检测;记录不同质量浓度麦角甾醇的峰面积,为该质量浓度的纯对照品的峰面积。计算血浆标准的峰面积与纯标的峰面积的比值,即为绝对回收率,绝对回收率分别为 (102.0±10.2)%、(94.4 ±13.2)%、(101.3±8.7)%,RSD均分别<15%,符合生物样品定量分析方法指导原则的要求。
3.4 精密度试验 取麦角甾醇对照品贮备液及小鼠空白血浆,分别配制低、中、高3个质量浓度(0.23、3.75、60μg/mL)的麦角甾醇血浆对照品溶液,每个质量浓度5份,再按 “血浆样品处理方法”处理后取上清液供HPLC分析,于同一日内测定血浆中麦角甾醇,依据当日标准曲线计算检测量,计算日内精密度;连续3 d同样操作,计算日间精密度。结果显示低、中、高3个质量浓度的麦角甾醇的日内精密度分别为10.8%、9.6%、8.0%(n=5),日间精密度分别为12.0%、8.8%、12.8%(n=5)。上述方法测得的日内和日间RSD均小于15%,符合生物分析方法指导原则的要求。3.5 样品稳定性 分别配制低、中、高3个质量浓度(0.23、3.75、60.00μg/mL)的麦角甾醇血浆对照品溶液,每个浓度5份。取低、中、高3个质量浓度的血浆样品按 “血浆样品处理方法”处理,取上清液于0、4、8、24 h注入HPLC仪分析,测定血浆中麦角甾醇量,考察室温放置24 h样品的稳定性,结果显示低、中、高3个质量浓度的RSD分别为4.2%、4.7%和13.8%;取低、中、高3种质量浓度的血浆样品反复冻融3个循环测定血浆样品从-80℃至室温冻融的稳定性,低、中、高3个质量浓度麦角甾醇的 RSD分别为9.6%、12.3%和8.5%;取低、中、高3个质量浓度的血浆样品,考察样品在-80℃下保存1个月内的稳定性,低、中、高3个质量浓度麦角甾醇的RSD分别为9.9%、7.9%和7.4%;结果其稳定性RSD均<15%,说明血浆样品在以上3种情况下基本稳定。
3.6 麦角甾醇的血药浓度对数-时间曲线 灌胃和静注给药后小鼠血浆中麦角甾醇的血药浓度对数-时间曲线见图4。
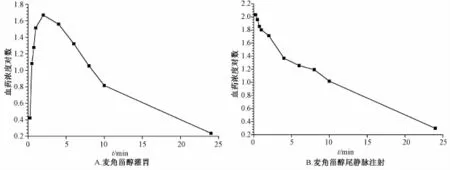
图4 小鼠血浆中麦角甾醇的血药浓度对数-时间曲线Fig.4 Log time curves of ergosterol in Mice plasma(b lood drug concentration)
3.7 药动学参数和绝对生物利用度 将测得的血药浓度数据,利用Kinetica 4.4软件对其进行房室模型拟合,结果表明麦角甾醇灌胃及静注给药后的药代动力学过程均符合双室模型。灌胃给予麦角甾醇后,K a为0.534 4 h-1,T1/2α为1.5463 h,T1/2β为2.99 h,说明麦角甾醇具有在胃肠道中较快吸收和分布,在体内消除较快的特点;与静注组相比,灌胃组的中央室分布容积 (V c)显著较大 (P<0.01),提示麦角甾醇在在中央室停留的时间较长,以高浓度分布在肝脏等中央室,因此在整体清除上较快。将麦角甾醇的药代动力学研究结果相比较,静脉注射的K10较灌胃给药大,说明静注麦角甾醇从中央室消除的较快,而口服较慢;灌胃给药的K12小于静脉注射,说明静脉注射后,麦角甾醇从中央室往周边室的转运速度较快,因而麦角甾醇静注后中心室药物浓度较低,消除也较少 (见表1)。
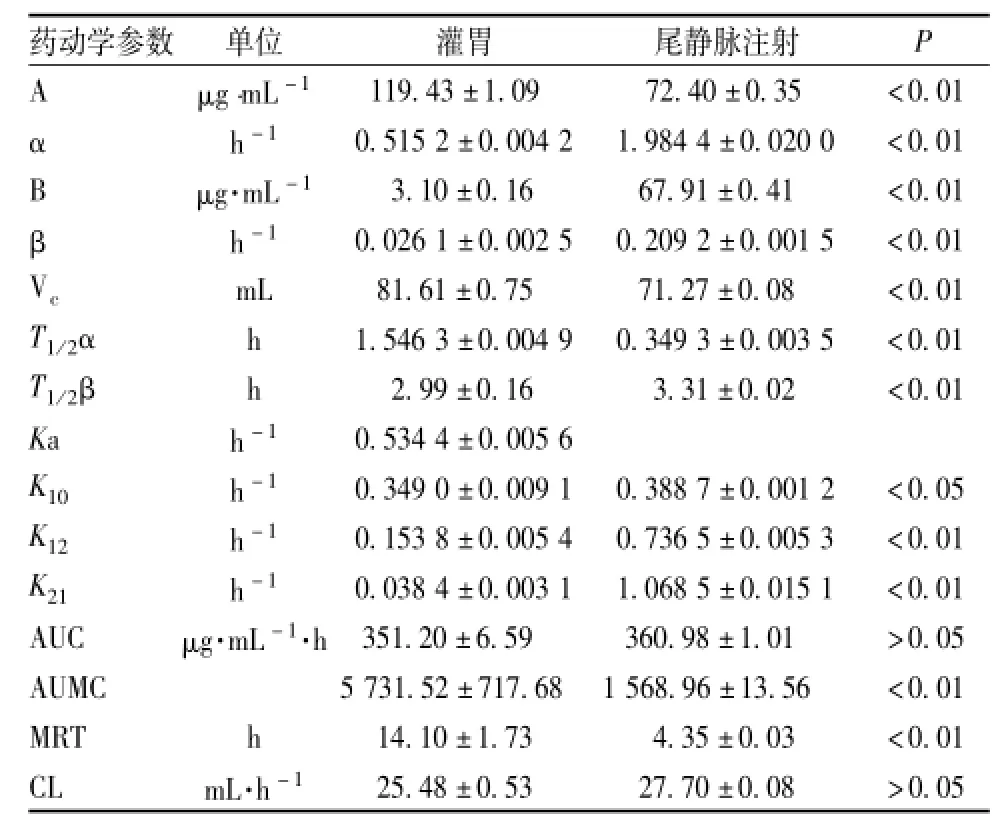
表1 小鼠灌胃及静脉注射给予10 mg/kg麦角甾醇的药动学参数(x±s,n=5)Tab.1 Pharmacokinetic parameters in Mice adMinistered w ith ergosterol intragastrically or intravenously at 10 mg/kg body weight,respectively(x±s,n=5)
灌胃给药后的AUC和Cmax值较低,表明麦角甾醇口服吸收程度较差;口服麦角甾醇达峰时间2 h,平均滞留时间 (MRT)7.03 h,半衰期 T1/26.34 h,说明药物在体内以较短的时间达到峰值,并维持相当长时间,且药物浓度波动不大,保持相对平稳 (见表2)。
同样采用非房室模型法计算小鼠静脉注射麦角甾醇给后的药动学参数,并与灌胃实验结果相比较,应用公式 (1)计算麦角甾醇的口服生物利用度为74.72%,说明麦角甾醇在小鼠体内口服吸收尚可。
4 讨论
麦角甾醇在临床上多为口服给药蛹虫草的主要活性成分,具有生物活性的化合物能否在生物体内有效地发挥作用很大程度上取决于它的生物利用度及其在靶器官的浓度。因此研究麦角甾醇灌胃给药后在小鼠体内药代动力学过程及绝对生物利用度对蛹虫草的药物开发具有重要意义,并为其制剂研制以及临床应用提供依据[7]。国内对麦角甾醇生物利用度的相关研究尚未见报道,本实验采用高效液相色谱法测定血浆中麦角甾醇,以反相C18硅胶作为色谱柱,以极性溶剂作为流动相,取得满意效果。该方法操作简便,标准曲线的线性相关性较好,灵敏度高,重复性好,能够符合药物动力学研究的需要。本实验中,观察到小鼠血压仅有轻微的下降,而且所有小鼠在术后都存活良好。实验取血量0.2 ML占小鼠总血量的15%左右,符合药理学中动物实验的取血总量不得超过15%~20%的原则,因此可以认为取血过程的小鼠处于近似生理状态。
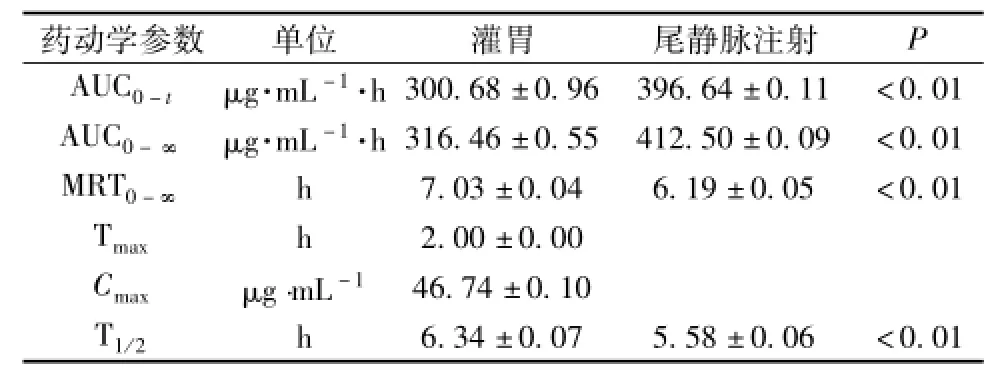
表2 小鼠麦角甾醇10 mg/kg灌胃和10 mg/kg静注的药动学参数 (非房室模型法,x±s,n=5)Tab.2 Pharmacokinetic parameters after intragastric or intravenous adMinistration of ergosterol at 10 mg/kg body weight,respectively(non-coMpartmentmodel,x±s,n=5)
4.1 液相色谱检测波长的选择 关于血浆药物的检测,一般采用HPLC-UV的方法[8]。麦角甾醇在整个紫外区均有良好的吸收,二极管阵列检测器(DAD)三维立体图显示,麦角甾醇的最大吸收波长为282 nm,此波长处其他杂质也有一定的吸收,若采用282 nm为检测波长测定,杂质干扰将导致测定结果偏高[9]。除282 nm外,麦角甾醇在272 nm和292 nm附近还有两个峰,而杂质在292 nm处的紫外吸收曲线基本呈直线,其ΔA值为零。本研究使用292 nm波长检测麦角甾醇,内源性杂质不干扰麦角甾醇的测定,获得了良好的色谱峰。
4.2 药代动力学 小鼠分别经灌胃(10 mg/kg)、尾静脉注射(10 mg/kg)给予麦角甾醇后,比较2种给药途径的药代动力学参数可以看到,除了AUC和CL无显著差异,其他参数有显著差异 (表3及表4),这都说明:药动学参数差异较大,说明它们的体内代谢过程不同;在同样剂量条件下,2种给药途径的麦角甾醇在体内均可以较长时间保持较高浓度,并可在一定程度上长时间体内循环。同时从药时曲线分布相可知,静注后血药浓度几小时内就迅速下降了几倍,这可能是麦角甾醇经静脉注射后迅速向各脏器分布。以上这些数据可以为麦角甾醇的药效学研究提供给药剂量的参考。
4.3 绝对生物利用度 口服麦角甾醇的绝对生物利用度为74.72%,说明口服麦角甾醇在小鼠体内吸收尚可。许多中药有效成分都存在着口服生物利用度不高的缺陷[10-13]。影响药物生物利用度主要归因于以下几个因素:药物在胃肠道中被破坏或代谢;药物分子不具备合适的理化性质,导致药物吸收差;药物是胃肠道代谢酶和外排泵的底物;药物的溶解性差等[14]。此次试验中,初步推测可能与其水溶性较差有关,从而影响其在胃部的吸收。导致麦角甾醇生物利用度不高的原因及增强其口服吸收的方法有待进一步研究,后期可考虑从剂型方面提高其生物利用度。
[1]胡丰林,李增智.虫草及相关真菌的次生代谢产物及其活性[J].菌物学报,2007,26(4):607-632.
[2]冯孝章.冬虫夏草及人工虫草化学成分[J].中草药现代化研究,1995(1):99-103.
[3]Li Y H,Li X L.Determination of ergosterol in Cordyceps sinensis and Cordyceps Black-bone Chicken Capsules by HPLC[J]. Acta PharMSin,1991,26(10):768-771.
[4]Matsuda H,Akaki J,Nakamura S,et al.Apoptosis-inducing effects of sterols froMthe dried powder of cultured myceliuMof Cordyceps sinensis[J].CheMPharMBull,2009,57(4):411-414.
[5]Wu JY,Zhang Q X,Leung PH.Inhibitory effects ofethyl acetate extract of Cordyceps sinensis myceliuMon various cancer cells in culture and B16 melanoma in C57BL/6 mice[J].Phytomedicine,2007,14(1):43-49.
[6]McEwen C,Gutteridge S.Analysis of the inhibition of the ergosterol pathway in fungi using the atmospheric solids analysis probe(ASAP)method[J].J AMSoc Mass Spectr,2007,18(7):1274-1278.
[7]钟 杰,王海南,马越鸣.中药药物代谢动力学在中药新药研究中的作用[J].中国临床药理学与治疗学,2010(3):241-246.
[8]王 萍,陈 坚.阿维菌素缓释注射液在家兔体内药物动力学的研究[J].新疆医科大学学报,2005,28(6):530-532.
[9]高 虹,谷文英.三波长光度法测定姬松茸中麦角甾醇含量[J].分析化学,2007,35(4):586-588.
[10]陈淑娟,庞雪冰.蝙蝠葛碱大鼠体内药物代谢动力学研究[J].中国药理学通报,2001,17(2):225-229.
[11]张海防,郭健新,黄罗生,等.羟基红花黄色素A在大鼠体内的药代动力学[J].中国药科大学学报,2006,37(5):456-460.
[12]顾 轶,王广基,孙建国,等.LC-MS法测定Beagle犬血浆中人参皂苷20(R)-Rh2及其药代动力学研究[J].中国临床药理学与治疗学,2006,11(3):256-260.
[13]Yang K Y,Lin L C,Tseng T Y,et al.Oral bioavailability of curcumin in ratand the herbal analysis froMCurcuma longa by LC-MS/MS[J].J.Chromatogr.B,2007,853(1):183-189.
[14]李 静,王广基.药物胃肠道吸收屏障及新型促吸收方法[J].药学学报,2005,40(7):600-605.
The pharmacokinetics and bioavailability of ergosterol in Mice
SUN Jia-chen1,2, CHEN Yu-jiao1,2, WU Yue-ting1,2, ZHANG Xiao-qian2,3, DU Si-miao2,ZHANG Yao-zhou1,2,3*
(1.Tianjin University of Traditional ChineseMedicine,Tianjin 300193,China;2.Tianjin International Joint Academy of Biomedicine,Tianjin 300457,China;3.Tianjin University,Tianjin 300072,China)
AIMTo study the pharmacokinetics and bioavailability of ergosterol(froMCordycepsmilitaris)in mice.METHODSOne hundred healthy KMmice were randoMly assigned into two groups for gastric lavage or tail vein injection of ergosterol,(10 mg/kg)respectively.The plasma ergosterol levels were determined by reversed phase high-performance liquid chromatography,and then the pharmacokinetic parameters and absolute bioavailability of ergosterolwere obtained through kinetica software analysis.RESULTSThe linear relationship was good within the range of 0.06-60μg/mL(r=0.999 7).The absolute recoveries were(102.0±10.2)%,(94.4±13.2)%,and(101.3±8.7)%at ergosterol concentration levels(0.23μg/mL,3.75μg/mL,60 μg/mL),respectively.The intraday RSDswere10.8%,9.6%,and 8.0%,respectively,while the interday RSDs being 12.0%,8.8%,and 12.8%,respectively.The plasma ergosterol level-time curves,after gastric lavage and introvenous use of ergosterol,fitted with a two compartmentmodel,their T1/2αwere(1.546 3±0.004 9)hand(0.349 3±0.003 5)h,T1/2βwere(2.99±0.16)h and(3.31±0.02)h,K10were(0.349 0± 0.009 1)/h and(0.388 7±0.001 2)/h,K12were(0.153 8±0.005 4)/h and(0.736 5±0.005 3)/h,K21were(0.038 4±0.003 1)/h and(1.068 5±0.015 1)/h,Vcwere(81.61±0.75)mL and(71.27±0.08)ML,respectively.The parameters of AUC0-tand T1/2were obtained by calculation with non-compartment model,T1/2(6.34±0.07)h and AUC0-t(300.68±0.96)μg·h/mL for gastric lavage,T1/2(5.58±0.06)h and AUC0-t(396.64±0.11)μg·h/mL for intravenous use,respectively.The absolute bioavailability for oral administration was determined to be 74.72%.CONCLUSIONThe difference in ergosterol bioavailability,dosing between gastric lavage and tail vein injection may be in line with its poor water-solubility in mouse gut.
Cordycepsmilitaris;ergosterol;mouse;gastric lavage;tail vein injection;pharmacokinetics;absolute bioavailability
R969.1
:A
:1001-1528(2015)05-0965-06
10.3969/j.issn.1001-1528.2015.05.009
2014-09-29
国家高技术研究发展计划 (863计划)(2011AA100603)
孙嘉辰(1989—),男,硕士生,从事中药学研究。Tel:15022357925,E-mail:sjcsunjiachen@foxmail.com
*通信作者:张耀洲(1964—),男,教授,从事中药学、生物化学研究。Tel:(022)83714098,E-mail:yaozhou.zhang@foxmail.com
