SiO2-CaO-Al2O3-MgO-FeO熔渣的电解还原行为
2015-01-12高运明杨映斌
高运明, 阮 栋, 杨映斌, 段 超
(武汉科技大学 钢铁冶金及资源利用省部共建教育部重点实验室,武汉 430081)
钢铁冶金行业是主要温室气体CO2排放的重要来源之一[1,2].使用惰性电极直接电解含有铁氧化物的熔渣制取金属铁是一个可供选择的减少甚至消除CO2排放的绿色短流程新工艺[3~5].但存在难以找到合适的高温惰性阳极以及电解效率低、副反应不易控制等问题[4~6].“可控氧流还原[7]”采用只对氧离子有很强选择透过性的氧化锆基固体电解质膜作为控制氧定向流动的介质,能实现电解时熔渣内的阳极和阴极物理及电子隔离,既防止阳极反应参与物对阴极的不利影响,又能阻塞电子和其他非氧离子通过,消除漏电电流或熔渣中其他非氧离子的干扰,提高电解时的电流效率;氧化锆基固体电解质良好的抗渣性也为制备出抗氧化且耐渣侵蚀的固体电解质基惰性阳极提供了更大可能.一些研究者已利用类似原理方法从溶解有所要提取金属的氧化物电解质熔体(熔渣、熔盐)中提取了Fe、Mg、Ti、Ta等金属[8~13],也有一些研究者以熔盐作为介质电解所要提取金属的固态氧化物阴极直接制备金属[14~16].最近Sadoway等[3,4]的研究表明SiO2-CaO-MgO-Al2O3渣系有可能是电解提铁的潜在介质.本文采用MgO或Y2O3稳定的氧化锆管作为氧离子膜[17],构建可控氧流电解池,外加电压研究SiO2-CaO-Al2O3-MgO-FeO熔渣的电解还原行为,以期为绿色电解提铁新工艺的基础研究提供一些参考.目前,直接电解时实用化的高温惰性阳极材料的选择仍较为困难,为简单起见,本文电解采用装在氧化锆管内的碳饱和铁熔体做阳极.
1 实 验
1.1 渣料制备
实验渣料由在箱式电阻炉内 1 223 K 下保温6 h烘干的CaCO3、SiO2、Al2O3、MgO试剂(均为分析纯)制备,FeO以FeC2O4·2H2O(分析纯)粉末形式配入[18].设定渣的组成(质量分数)为42.3% SiO2-25.2% CaO-8.1% Al2O3-14.4% MgO-10% FeO[19],熔渣二元碱度R(定义为渣中CaO与SiO2质量分数之比)为0.6,混匀后分别装入已连接铁棒的大或小铁坩埚,将铁坩埚置于立式硅钼棒管式电阻炉恒温区的刚玉坩埚(高100 mm)内.炉内通入经过铜丝和镁屑二级净化后的干燥Ar气保护.高温炉升温至1 673 K,保温1 h,使渣料熔化均匀后,取出铁坩埚在水中急冷,获得装在铁坩埚内的预熔渣料,备用.
1.2 实验方法
电化学实验装置示意如图1所示.将装有预熔渣的铁坩埚(加装中心开孔的致密氧化铝盖)置于炉内恒温区,并直接以铁坩埚做阴极,与铁坩埚连接的铁棒作为阴极引线,铁棒外套刚玉绝缘保护通管;采用一端封闭的ZrO2(Y2O3)管[20]或ZrO2(MgO)管(外购)内装适量碳饱和铁作阳极,在碳饱和铁液中插入高纯石墨棒(直径4 mm,长度460 mm)并连接铜丝作阳极引线.为方便操作,将ZrO2管与刚玉通管通过高温水泥黏结.高温炉内通净化Ar气保护,Ar气流量为400 mL/min.升温至实验温度1 723 K后,保温30 min,使铁坩埚中的熔渣再次充分熔清.将CHI1140A型电化学分析仪的辅助电极和参比电极同时与阴极引线(铁棒)相连接,工作电极与阳极引线(与石墨棒相连的铜丝)相连接.启动电化学分析仪,将内装有碳饱和铁液的ZrO2管通过铁坩埚上氧化铝盖中心孔缓慢插入熔渣中,构建可控氧流电池:
铁棒|Fe+FeO(slag)|ZrO2(MgO或Y2O3)
|[O](Fe+C饱和)|石墨棒
同时自动记录电池的开路电压-时间曲线.待开路电压稳定后,进行线性扫描实验测定.实验参数设定:扫描初始电压为实验过程中测得的开路电压,终止电压为4 V,扫描速率为10 mV/s,记录实验过程中的电流随扫描电压变化关系.最后外加恒电压电解,记录电解电流I-时间t曲线.各实验条件如表1所示.

图1 电解实验装置示意图Fig.1 Schema of the electrolytic cell
实验完毕后,冷却到室温,观察到各实验中氧化锆管外形均完好,解剖电池,通过比较残渣颜色大体判断渣中FeO的还原效果.制样抛光,通过扫描电镜(Nova 400 Nano SEM)结合能谱仪(INCAIE 350 Penta FET X-3 EDS)分析残样的组织形貌及有关成分.
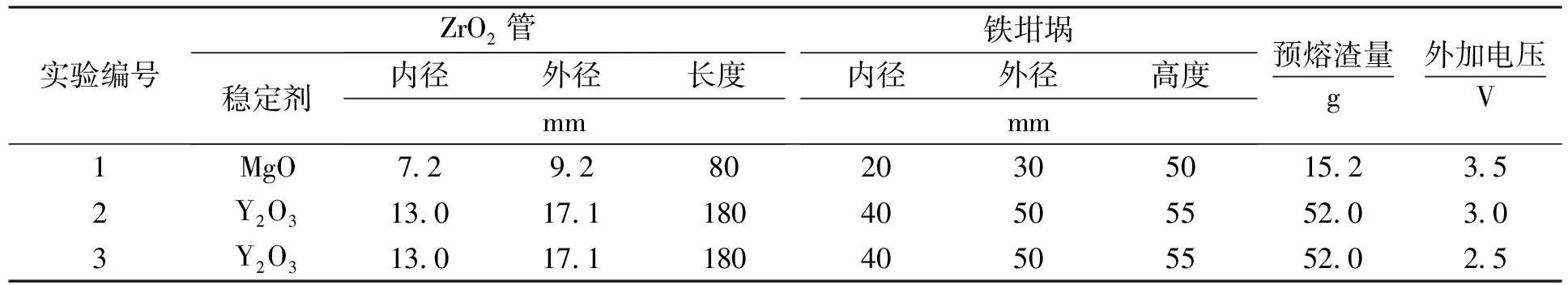
表1 实验条件安排
2 结果与讨论
2.1 开路电位-时间曲线
铁氧化物分解电压是电解过程中确定外加电压大小、探索电极过程机理的一个重要依据,一般采用线性扫描伏安法测定.为了确定线性扫描曲线测定时初始外加电压的大小,本文先进行电池开路电压随时间的曲线测定.开路电压反映了氧化锆管内外两侧(固体电解质原电池)氧浓度差的大小.由于氧化锆管外为含FeO的熔渣,而管内为碳饱和铁熔体,在氧化锆管内外侧存在氧势差.熔渣侧氧势较高,铁棒为原电池正极引线;铁碳侧氧势较低,石墨棒为原电池负极引线.图2为1 723 K下采用 ZrO2(MgO)管的电池开路电压随时间变化的典型曲线.在实验初始阶段,石墨棒并未插入碳饱和铁熔体,所显示的波动的开路电压并不是正常的原电池两端的开路电压.在石墨棒下降的过程中,可以观察到在50 s时电压值突变,表明石墨棒与碳饱和铁熔体刚好接触,电池体系接通,最后趋于稳定,通过曲线可以观察到测定的开路电压约为-0.25 V.此处由于与石墨棒(原电池负极引线)相连的工作电极为电化学分析仪测定电压的正极,故测得的开路电压值为负.考虑到电极引线Fe棒(+)与石墨棒(-)之间的热电势约为0.05V[8],修正后可确定平衡时电池的开路电压实际约为-0.20 V.
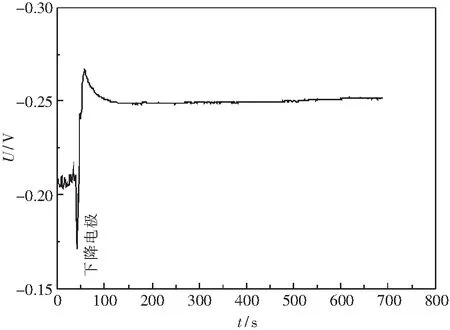
图2 ZrO2(MgO)管实验的开路电位-时间曲线Fig.2 Open circuit potential-time curve for the experiment with ZrO2(MgO) tube
理想情况下测定的开路电压与固体电解质电池的理论电动势应相等.针对本电池体系,设下述电池反应达到平衡:
(FeO)+[C]=Fe(s)+CO
(1)
此时铁液中饱和[C]及产物Fe(s)的活度均为1.利用FactSage热力学软件[21]计算的 1 723 K 温度下本文熔渣中FeO活度约为0.17,当气体产物为CO(设其压力为100 kPa)时,得到电池的理论电动势为0.43 V,电动势为正表明上述反应可自发进行.考虑到电化学分析仪的极性,与开路电压值符号对应的电池的电动势理论值应为-0.43 V,但该值与上述开路电压测定值存在较大差别.分析其原因主要有二:一是碳饱和铁熔体还原性强,此时ZrO2(MgO)管存在较大电子导电性,导致上述实验测定值(绝对值)偏低.文献[9~11]在短路还原以及外加电压电解实验中,均发现在熔渣/氧化锆管界面附近发现有细小铁珠生成,这是电池内部电子短路还原电流的结果,证明氧化锆管在碳饱和铁熔体条件下存在电子导电性.另外一个原因是实验测定过程中气体产物可能还有CO2生成,CO2的生成也会导致开路电压测定值偏低.
2.2 线性扫描曲线分析
利用ZrO2(MgO)管内装碳饱和铁液做电解阳极(此时石墨棒为电解池阳极引线),测定铁坩埚内熔渣中氧化物分解电压的线性扫描伏安曲线如图3所示.为便于对比,图中还绘出了文献[22]针对52.2% SiO2-22.5% CaO-9% Al2O3-6.3% MgO-10% FeO熔渣(R=0.43)的线性扫描曲线.外加电压条件下熔渣中的O2-通过ZrO2(MgO)管在阳极氧化为O2,O2溶解在铁碳熔体中并与[C]发生反应,非均相形核生成CO等气泡,气体产物的排出使氧化锆管内壁与阳极熔体接触的表面积不稳定,导致扫描电流波动较大,且外加电压越大,反应越激烈,排出气体量也越大,电流波动也越大,如图3所示.本工作与文献[22]中曲线的反应规律基本相同,但显然本实验工作中的反应较激烈.这可能与熔渣组成(或碱度)、扫描速率不同有关.本工作中,熔渣碱度高,黏度小,离子扩散快,反应激烈;扫描速率大,外加电压增加较快,反应也加快.另外,文献[22]中熔渣碱度低,SiO2含量高,在氧化锆管/渣界面发现有高熔点ZrSiO4生成,而本工作中在SEM下观察并未发现有新相生成.ZrSiO4的生成阻挡了熔渣中氧离子向氧化锆管内的迁移,显著降低了反应速度.

图3 采用ZrO2(MgO)管实验的线性扫描曲线 Fig.3 Linear scanning curves for the experiment with the ZrO2(MgO) tube
高温下铁坩埚与熔渣保持平衡,熔渣中的铁氧化物只有FeO.热力学分析表明,熔渣中最易还原的氧化物为FeO,其次为SiO2.因此,在图3所示的线性扫描伏安曲线中出现的一个还原峰(峰电压约1.9 V,峰电流约0.7 A),对应FeO到Fe的还原,其起峰段电流随外加电压几乎呈直线增加,但达到还原峰值电流以后,FeO电解过程将受扩散步骤控制,电流下降[23].随后又出现电流随外加电压增加而增加的另一直线段,对应SiO2的还原.通过直线外推法可以获得本工作中与横轴的第一个交点电压(对应熔渣中FeO的分解电压)、第二个交点电压(对应熔渣中SiO2的分解电压)分别约为-0.25、0.4 V.FeO与SiO2的分解电压值符号不同,表明二者电解还原难易程度存在较大差别.本实验条件下FeO分解电压为负值,表明在无外加电压甚至外加反向电压的情况下,熔渣中FeO的电解还原也能进行,文献[8~10]已证明在类似实验条件下无需外加电压(短路)即可还原熔渣中FeO;SiO2的分解电压值为正,表明熔渣中SiO2必须外加电压才能电解还原.在实验温度下,碳饱和铁液做阳极,且气体产物为CO+CO2时,通过FactSage热力学软件[21]计算FeO的理论分解电压(产物Fe活度为1)在-0.43 V 到-0.09 V之间,而SiO2理论分解电压(设产物Si活度为1)在0.29 V到0.62 V之间.本工作的测定结果处于FactSage热力学软件[21]理论计算值范围内,表明分解电压的测定是合理的.依据文献[22]中的扫描曲线,可确定FeO还原峰电压仅约0.4 V,且FeO、SiO2分解电压分别为-0.255 V和0.15 V(如图3所示),其中FeO的分解电压值与本工作基本相同,而SiO2分解电压比本工作小.考虑到文献中熔渣的SiO2较高、碱度较低、产物Si活度小于1以及扫描速率的不同,结果与本工作(或理论计算结果)相比有一定差别是可以理解的.以上分析也表明,与文献[22]比较,采用本工作的渣系组成, FeO还原的峰电压、峰电流均较高,能在较宽的外加电压范围内提高电解电流,因而本工作渣系组成对提高渣中FeO电解还原速率更有利.
在线性扫描过程中达到各自分解电压后,熔渣中FeO、SiO2分别按(1)~(4)式被电解,一般认为高温下生成CO的(1)、(3)是主要电池反应:
2(FeO)+[C]=2Fe(s)+CO2
(2)
(SiO2)+2[C]=[Si]+2CO
(3)
(SiO2)+[C]=[Si]+CO2
(4)
2.3 恒电压下电解电流-时间曲线
在本实验条件下,尽管熔渣中的FeO无需外加电压也可自发还原,但为加快电解反应速率,同时考虑到电极反应的超电势和电路电阻的电压降等因素,对可控氧流电池外加2.5~3.5 V的恒电压U,考察熔渣的电解还原行为.分别采用MgO和Y2O3稳定的氧化锆管内装碳饱和铁做阳极进行实验,得到外加不同恒电压U下电流随时间的变化曲线,如图4所示.
图4 恒电压电解电流-时间曲线Fig.4 Current-time curves of potentiostatic electrolysis
图4中电流I-时间t曲线波动较大,正如前面所分析,这是铁碳熔体中排出气体产物的结果.总体上看,各外加恒电压下电流随时间变化逐渐减小,这是电解还原导致熔渣中FeO含量不断下降的结果.从还原后残渣颜色的明显差别可比较三个实验中渣中FeO的还原效果.众所周知,含10%的FeO原始预熔渣是黑色的.但采用ZrO2(Y2O3)管的实验后残渣颜色是无色或浅绿色,表明残渣中FeO量很低;而采用ZrO2(MgO)管的实验后残渣颜色显墨绿色,表明残渣中FeO量较高,FeO还原不完全.因此,采用ZrO2(Y2O3)管构建的可控氧流电池中FeO的还原效果明显高于采用ZrO2(MgO)管的.
对于不同外加电压下相同稳定剂的ZrO2(Y2O3)管实验,在电解初始阶段,外加电压为2.5 V时的最大电流值甚至大于3 V时的电流,主要是由于ZrO2(Y2O3)管插入熔渣中的深度不同所致.实验结束后取出样品,发现外加电压为3 V时ZrO2(Y2O3)管插入渣中仅2 mm,几乎只有ZrO2(Y2O3)管底部与渣面接触,而2.5 V时ZrO2(Y2O3)管插入渣中超过5 mm.ZrO2(Y2O3)管插入深,与熔渣接触的表面积大,相当于增大了电极有效面积,一方面减小电路中渣、ZrO2(Y2O3)管引入的电阻,另一方面可加快电极反应.因此,熔渣中FeO的还原效果较好.这与通过残渣颜色变化判断的FeO还原效果是一致的.在外加电压为2.5 V时电解的后期,熔渣中的FeO含量已经降到很低,但电流又有所升高,这可能与电极附近熔渣中SiO2的还原有关.
相同温度下ZrO2(Y2O3)固体电解质的离子电导率一般大于ZrO2(MgO)固体电解质[17].外加电压为3 V时ZrO2(Y2O3)管插入渣中仅2 mm,其阳极面积明显小于ZrO2(MgO)管时的阳极面积,尽管采用ZrO2(Y2O3)管的实验的外加电压(3 V)小于采用ZrO2(MgO )管的实验的外加电压(3.5 V),且渣量也较大,但前者的还原电流远大于后者,且从残渣颜色判断前者中FeO的还原效果明显好于后者.这表明可控氧流还原效果与氧化锆管的稳定剂种类有关.另外,采用ZrO2(MgO)管做实验的还原时间较短,也是其FeO还原效果差的一个原因.
2.4 显微观察与能谱分析
采用ZrO2(Y2O3)管外加3V电压和ZrO2(MgO)管外加3.5 V电压电解后阴极铁坩埚/渣界面的扫描电镜图及能谱分析分别如图5和表2所示.

图5 铁坩埚/渣界面SEM图Fig.5 SEM images in the iron crucible /slag interface (a)—ZrO2(Y2O3)管电解实验(U=3 V); (b)—ZrO2(MgO)管电解实验(U=3.5 V)
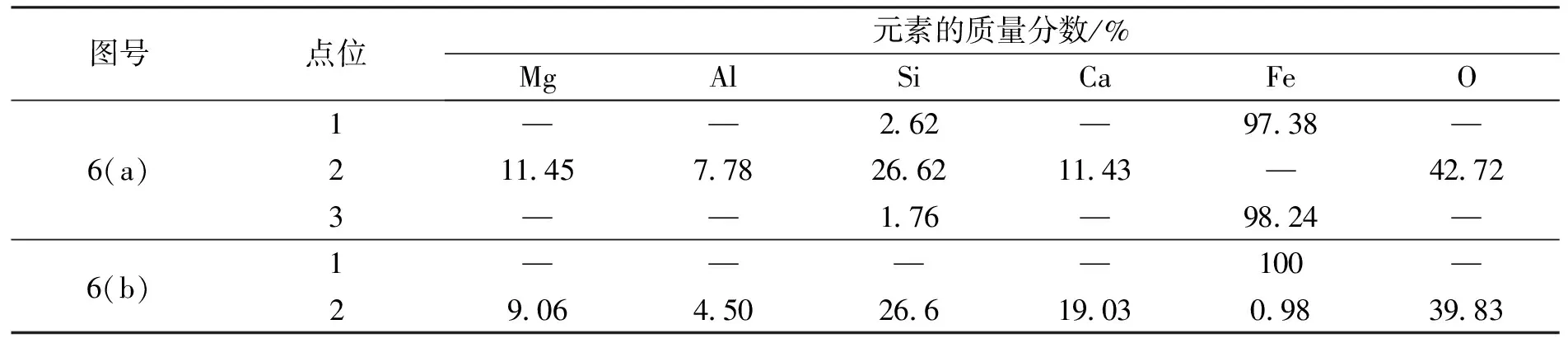
从图5可以看出,在铁坩埚壁与熔渣接触处,熔渣中有发亮且呈枝晶状的物质析出,经能谱分析(如表2所示)证明该物质为纯铁.实验结果表明,在外加电压的条件下,熔渣中的Fe2+向阴极铁坩埚表面移动,在阴极得到电子而析出固态金属铁,新析出的铁与铁坩埚结合在一起构成新的阴极.随着电解的进行,阴极的电极面积与初始状态相比逐渐增大,且由于电解新析出的铁活性较强,Fe2+更容易在刚析出的铁上析出,并以此为基础,不断的向渣中延伸,最后形成树枝状的铁枝晶结构.观察还可以发现,距离阴极铁坩埚壁越近,析出的铁枝晶状物质越多,而在远离铁坩埚壁的熔渣中几乎没有铁析出.熔渣冷却结晶后组织成分虽有一定偏析,但一般在距离铁坩埚壁或铁枝晶(阴极)较近的渣中FeO很低,甚至不含FeO,而在远离阴极的渣中含有FeO,表明在阴极Fe2+的电极反应很快,一般不会是电解还原过程的控速环节.

表2 铁坩埚/渣界面附近EDS分析
采用ZrO2(Y2O3)管电解熔渣,当外加电压为3 V时,可以观察到渣内部不仅在铁坩埚壁析出较多枝晶状的铁(图5(a)),且有些枝晶延伸到铁坩埚壁与 ZrO2(Y2O3) 管外壁之间的渣表面上,并汇集成较大铁片;但外加电压为2.5 V时,出乎意料的是在铁坩埚内壁面没有观察到明显的铁枝晶,而仅在铁坩埚内壁与 ZrO2(Y2O3) 管外壁之间的渣面上观察到汇集形成的较大铁片,如图6所示.较大铁片的形成实际上有利后续渣铁的磁选或熔融分离.能谱分析(表3)结果表明,外加电压为3 V时,在渣表面形成的较大铁片为纯Fe,残渣中含有少量的FeO,这可能与 ZrO2(Y2O3) 管插入渣中深度不够,导致FeO还原不完全有关.但在外加电压为2.5 V时,在渣表面形成的较大铁片为Fe-Si合金(Si量较低),残渣中不含FeO,表明熔渣中FeO完全被还原,并存在SiO2的还原.依据Fe-Si相图[24],Si与Fe可形成低熔点合金.外加电压为2.5 V时铁坩埚壁面没有观察到明显的铁枝晶可能是由于后期Si的析出导致先前析出的铁枝晶破碎而脱落.
由于熔渣中存在FeO与SiO2的还原,且电解中不能直接确定电子电流的大小(电子电流可以影响电流效率[11]),因此本文未能通过外电路电流的大小计算熔渣电解过程中FeO的还原率.为获得较大电解速率,外加电压较大时,如需电解获得纯铁,应在FeO基本还原完毕后及时结束电解.

图6 ZrO2(Y2O3)管实验中渣表面金属片的SEM图Fig.6 SEM images of metal sheet on the surface of slag after electrolysis with ZrO2(Y2O3) tube(a)—外加电压U=2.5 V; (b)—外加电压U=3 V
图号点位元素的质量分数/%MgAlSiCaFeO1——262—9738—6(a)2114577826621143—42723——176—9824—6(b)1————100—290645026619030983983
3 结 论
(1) 利用构建的可控氧流电池,采用线性扫描技术测定,得到本实验条件下SiO2-CaO-Al2O3-MgO-FeO熔渣中FeO、SiO2分解电压分别约为-0.25 V、0.4 V,实验测定结果位于FactSage热力学软件理论计算值范围内,表明了本实验装置测定熔渣中氧化物组元分解电压的可行性.同时扫描曲线也表明本文所选熔渣组成对外加电压电解FeO是有利的.
(2) 采用MgO或Y2O3稳定的ZrO2管内装碳饱和铁作阳极,构建可控氧流电池,外加电压均可以从SiO2-CaO-Al2O3-MgO-FeO熔渣中电解还原获得金属铁(或铁合金).外加电压过大,易导致熔渣中SiO2的还原.
(3) 在相同的实验条件下,可控氧流电解电流的大小以及熔渣中FeO的还原效果与外加电压、ZrO2稳定剂的种类和ZrO2管(阳极)插入熔渣中的深度、电子电流等有关.对于不同稳定剂的ZrO2管,ZrO2(Y2O3)管比ZrO2(MgO)管似乎更利于熔渣中FeO电解还原反应的进行.
[1] Sun Wenqiang, Cai Jiuju, Mao Hujun,etal. Change in carbon dioxide (CO2) emissions from energy use in China's iron and steel industry[J]. Journal of Iron and Steel Research, International, 2011, 18(6): 31-36.
[2] Tian Yihui, Zhu Qinghua, Geng Yong. An analysis of energy-related greenhouse gas emissions in the Chinese iron and steel industry[J]. Energy Policy, 2013, 56: 352-361.
[3] Wang D H, Gmitter A J, Sadoway D R. Production of oxgen gas and liquid metal by electrochemical decomposition of molten iron oxide[J]. Journal of the Electrochemical Society , 2011, 158(6): E51-E54.
[4] Kim H J, Paramore J, Allanore A,etal. Electrolysis of molten iron oxide with an iridium anode:The role of electrolyte basicity[J]. Journal of The Electrochemical Society, 2011,158 (10): E101-E105.
[5] Sirk A H C, Sadoway D R,Sibille L. Direct electrolysis of molten lunar regolith for the production of oxygen and metals on the moon[J]. ECS Transactions, 2010,28 (6): 367-373.
[6] Allanore A, Yin L, Sadoway D R. A new anode material for oxygen evolution in molten oxide electrolysis[J]. Nature, 2013, 497(7449):353-356.
[7] 高运明, 姜英, 张华, 等.可控氧流冶金[J]. 武汉科技大学学报, 2007, 30(5): 449-453.
(Gao Yunming, Jiang Ying, Zhang Hua,etal. Metallurgy with controlled oxygen flow[J]. Journal of Wuhan University of Science and Technology, 2007, 30(5): 449-453.)
[8] 高运明. 无污染短路还原法提铁的基础研究[D]. 北京: 北京科技大学, 2004, 9.
(Gao Yunming. Study on extraction of iron by the short circuit reduction method with no pollution [D]. Beijing: Beijing University of Science and Technology, 2004, 9.)
[9] 高运明, 郭兴敏, 周国治. 熔渣无污染短路电化学还原分析[J]. 中国有色金属学报, 2006, 16(3): 530-535.
(Gao Yunming, Guo Xingmin, Zhou Guozhi. Unpolluted short circuit electrochemical reduction analysis for molten oxide slags[J]. The Chinese Journal of Nonferrous Metals, 2006,16(3):530-535.)
[10] 高运明, 郭兴敏, 周国治.短路还原法提取铁的研究[J]. 金属学报, 2006, 42(1): 87-92.
(Gao Yunming, Guo Xingmin, Zhou Guozhi. Study on extraction of iron by the short circuit reduction method[J]. Acta Metallurgica Sinica, 2006, 42(1): 87-92.)
[11] Gao Y M, Wang B, Wang S B,etal. Study on electrolytic reduction with controlled oxygen flow for iron from molten oxide slag containing FeO[J]. Journal of Mining and Metallurgy Section B Metallurgy, 2013, 49 (1) B: 49-55.
[12] Pal U B, Powell A C. The use of solid-oxide-membrane technology for electrometallurgy[J]. JOM, 2007, 59(5): 44-49.
[13] Krishnan A, Pal U B, Lu X G. Solid oxide membrane process for magnesium production directly from magnesium oxide[J]. Metallurgical and Materials Transactions B, 2005, 36(4): 463-497.
[14] Lu X, Zou X, Li C,etal. Green electrochemical process solid-oxide oxygen-ion-conducting membrane(SOM):Direct extraction of Ti-Fe alloys from natural ilmenite[J]. Metallurgical and Materials Transactions B, 2012, 43(3): 503-512.
[15] 陈朝轶, 鲁雄刚, 李谦, 等. SOM法金属氧化物制取金属新技术[J]. 材料与冶金学报, 2007,6(3):204-208.
(Chen Chaoyi, Lu Xionggang, Li Qian,etal. A new technique study of metal preparation by SOM method[J]. Journal of Materials and Metallurgy, 2007, 6(3):204-208.)
[16] Zou Xingli, Lu Xionggang, Zhou Zhongfu,etal. Direct selective extraction of titanium silicide Ti5Si3from multi-component Ti-bearing compounds in molten salt by an electrochemical process[J]. Electrochimica Acta, 2011, 56(24): 8430-8437.
[17] 王常珍. 固体电解质和化学传感器[M]. 北京: 冶金工业出版社, 2000.
(Wang Changzhen. Solid electrolyte and chemical sensors[M]. Beijing: Metallurgical Industry Press,2000.)
[18] Franks E. Electroanalysis of iron in molten slags[J]. Journal of Applied Electrochemistry, 1977, 7(2): 147-151.
[19] 王少博, 高运明, 王兵, 等. 电解提铁酸性熔渣介质的组成及熔化性能研究[J]. 中国稀土学报, 2012,30(专辑): 334-339.
(Wang Shaobo, Gao Yunming, Wang Bing,etal. Study on compositions and melting property of acid slag medium by electrolysis for iron[J]. Journal of Chinese Society of Rare Earths, 2012, 30(Spec. Issue):334-339.)
[20] 石亮, 谢光远, 高运明, 等. 凝胶注模制备氧化锆管工艺研究[J]. 武汉科技大学学报, 2013, 36(5): 366-369.
(Shi Liang, Xie Guangyuan,Gao Yunming,etal. Preparation of zirconia tube with gel-casting method[J]. Journal of Wuhan University of Science and Technology, 2013,36(5):366-369.)
[21] Bale C W, Bélisle E, Chartrand P,etal. FactSage thermochemical software and databases: Recent developments[J]. Calphad, 2009, 33(2): 295-311.
[22] 高运明, 王兵, 王少博, 等. 含FeO熔渣对ZrO2固体电解质侵蚀性研究[J]. 武汉科技大学学报, 2012, 35(5): 330-337.
(Gao Yunming, Wang Bing, Wang Shaobo,etal. Study on the corrosion of ZrO2solid electrolyte by molten slag containing FeO[J]. Journal of Wuhan University of Science and Technology, 2012,35(5):330-337)
[23] 张圣弼. 冶金物理化学实验[M]. 北京: 冶金工业出版社,1994: 232.
(Zhang Shengbi. Experiments in physical chemistry of metallurgy[M]. Beijing: Metallurgical Industry Press, 1994:232.)
[24] 虞觉奇, 易文质, 陈邦迪, 等. 二元合金状态图集[M]. 上海: 上海科学技术出版社, 1987: 375.
(Yu Jueqi, Yi Wenzhi, Chen Bangdi,etal. Binary alloy phase atlases[M]. Shanghai: Shanghai Science and Technology Publishing House, 1987:375.)
