关于1 873 K下铁液中铝脱氧平衡热力学的讨论
2015-01-12王天龙张红伟
刘 达, 雷 洪, 王天龙, 张红伟
(东北大学 材料电磁过程研究教育部重点实验室, 沈阳 110004)
由于铝与氧的结合能力很强,炼钢过程中金属铝经常被用作脱氧剂,其脱氧产物为Al2O3.小尺寸的Al2O3和AlN可以跟Ti、Mn的氧、硫复合物结合从而起到促进晶内铁素体形核和细化组织的作用[1],然而大尺寸的簇状Al2O3会造成水口结瘤,影响钢铁的生产.同时,铝的质量分数高达0.7%~1.1%的38CrMoAl高铝钢具有坚硬、耐磨、抗腐蚀的性能,在航空工业、常规武器及机械制造业方面具有广泛的应用前景.为了节约成本,提高钢产品的质量,有必要准确确定脱氧过程中铝的用量.铝脱氧是一个经典问题,对于钢液中铝含量较低时铝脱氧行为,炼钢工作者已有共识:随着铝含量的增加,氧含量降低.但是,对于钢液中铝含量较高时铝脱氧行为,则存在如下争论:(1)在高铝的情况下,随着铝含量的增加,氧含量是继续降低还是升高?(2) 在高铝的情况下,如果随着铝含量的增加氧含量反而升高(即Al-O平衡曲线“上翘”),氧含量升高的原因有两种观点,一种观点认为是由于铝铁化合物的生成,另一种观点认为是二阶相互作用系数作用的结果.
因此,本文在前人[2]实验结果的基础之上,利用热力学计算方法,分别从可能生成金属氧化物、Al-Fe金属间化合物和Al2O3的平衡热力学三个方面来对“上翘”原因进行探究和考察,希望能够对1873K下钢液中Al-O平衡曲线有更加确切的认识,为实现国内钢铁生产中氧化物夹杂的精确控制创造条件.
1 Fe-Al-O三元系的反应产物
对于Fe-Al-O三元系,可能存在如下反应产物:(1)Fe-O化合物(2)Al-Fe化合物(3)Al-O化合物(4)FeO·Al2O3化合物.
1.1 金属氧化物
对于钢液中铝脱氧,当加入的铝很少时,钢液中仍有较高量的[O],能以FeO形式和生成的Al2O3结合成FeO·Al2O3,随着钢液中铝含量的增加,脱氧产物则为Al2O3[3],同时生成的FeO·Al2O3是不能形成熔体的脱氧产物,其活度为1,不会影响脱氧曲线的形状及斜率.基于表1中的热力学数据,可以得到生成不同脱氧产物分界点的w[Al]=2.78×10-3%[2]、2.37×10-5%[4]、7.8×10-5%[5],但是在炼钢过程中,金属Al通常在出钢过程和精炼过程加入.在钢液中,铝脱氧钢中w[Al]数量级一般为0.1%,远远高于不同脱氧产物分界点的w[Al]值,且w[O]仅为0.01%~0.1%.因此在实际生产过程中,Fe-Al-O三元系优先出现Al2O3这种氧化物.
1.2 Al-Fe化合物
图1是通过Thermo-Calc软件计算得到的Fe-Al二元相图.纯铁的熔点是1 538 ℃,纯铝熔点是660 ℃.它们之间的金属间化合物的熔点均小于纯铁的熔点,因此在1 873 K(1 600 ℃)时不可能出现Fe-Al金属间化合物.

图1 Fe-Al相图Fig.1 Phase diagram of Fe-Al system
2 生成Al2O3的脱氧反应热力学
2.1 铝脱氧的脱氧常数
铝脱氧的脱氧常数可表示为
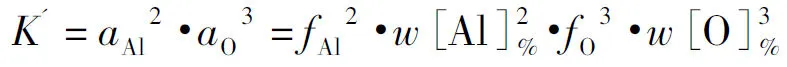
(1)
由于高温实验的复杂性,不同研究者对铝脱氧反应的吉布斯自由能和化学平衡常数给出了不同的结果.图2表明,当T=1 873 K时,Itoh给出的K′值三者中最大,Sigworth给出的K′值其次,Rohde给出的K′值最小,仅是Itoh的1/11.因此选择合理的反应平衡常数是一个关键问题.
2.2 活度系数
对于铝脱氧反应,存在两个活度系数(fAl、fO),它们的计算式如下:

表1 Fe-Al-O体系中反应方程式及标准吉布斯自由能

图2 不同研究者给出的脱氧常数Fig.2 Equilibrium constants proposed by different researchers
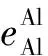

(2)


(3)
图3给出了前人在铝脱氧方面的实验结果.当w[Al]%<0.1时,w[O]随w[Al]的增加而减少.当w[Al]%>1.0时,文献[4][11][14][16]表明w[O]随w[Al]的增加而增加,而文献[12][13][15]没有w[Al]%>1.0时的数据.
图3还表明,当温度为1873K,w[Al]%<0.1时,六条曲线给出了相似的结果.但w[Al]%>1.0时,各曲线的趋势却大相径庭.其中,曲线1的总体趋势是随w[Al]的增加,w[O]先减小接着增大最后减少,这与已有的实验结果明显不符.曲线2、3、4、5和6的总体趋势是随w[Al]的增加,w[O]先减小后增大.陈家祥给出的数据忽略了Sigworth等的二阶活度系数,但铝氧平衡曲线与Sigworth曲线大致重合;但是当w[Al]%→0.75时,曲线2和曲线6中w[O]无限增大;当w[Al]%→3.5时,曲线3中w[O]无限增大,当w[Al]%→5.1时,曲线4中w[O]无限增大,这样的结果也是不能接受的.而曲线5的最低点位于w[Al]%=0.25,w[O]%=3.2×10-4,经过最低点后,随w[Al]的增加,w[O]的增加较为缓慢,且此处数据与文献[4][14]的实验数据规律相符.可见,曲线5的可靠性最高,换言之,Itoh给出的标准吉布斯自由能和活度系数较为可信.

表2 1 873 K Al-O间元素的相互作用系数
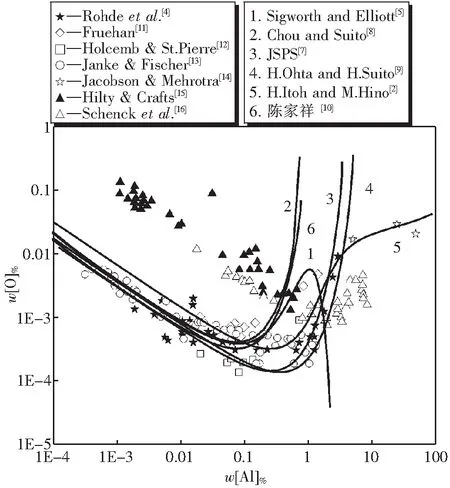
图3 1 873 K时钢液中铝脱氧平衡曲线Fig.3 Deoxidation equilibrium with Al in liquid iron at 1 873 K

图4 1 873 K下铝脱氧反应达到平衡时铝和氧的活度Fig.4 Activities of aluminum and oxygen in aluminum deoxidation equilibrium at 1 873 K
图4是利用Itoh的铝氧反应标准吉布斯自由能计算得到的铝氧活度图.随着w[Al] 的增加,铝氧反应达到平衡时氧的活度降低,铝的活度增大.当w[Al]%>0.25 时,虽然图3中w[O] 随w[Al] 的增大而增大,但是其相应的活度aO仍然随w[Al] 的增大而减少.换言之,钢液中铝脱氧反应,随着w[Al] 的增大,铝和氧的活度变化趋势均符合正常规律.仅当w[Al]%>0.25 时反应平衡w[O]%曲线出现最低点.
图3表明曲线2至6的变化规律均为随着钢中w[Al]增加,w[O]先减小后增大.其中“上翘” 曲线2、3和6均只考虑一阶相互作用系数,曲线4和5则同时考虑了一阶和二阶相互作用系数.而曲线2、3、4、6的上翘程度基本相同.曲线5的上翘程度有所减缓.因此,铝脱氧平衡曲线“上翘”主要是一阶活度相互作用系数影响的结果,二阶相互作用系数仅减小曲线上翘的程度.
3 结 论
(1) 在温度为1 873 K时,炼钢条件下,优先生成Al2O3.
(2) 铝脱氧的标准吉布斯自由能建议取Itoh的推荐值,ΔGθ(J·mol-1)=-867 300+222.5T.
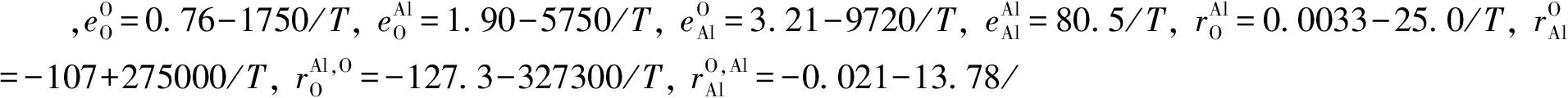
(4) 当铝脱氧反应处于平衡时,钢液中,随着w[Al] 增加,w[O]先减小后增加,但是aO单调减小,aAl单调增加.铝脱氧平衡曲线“上翘”主要是一阶相互作用系数影响的结果,二次相互作用系数会减小曲线上翘的程度.
符号
ΔGθ,标准吉布斯自由能, J·mol-1
a, 活度;
e, 一阶相互作用系数;
r, 二阶相互作用系数;
f, 活度系数;
K, 化学平衡常数;
T, 温度.
[1] 李树森 , 刘敏, 左秀荣. 高强管线钢焊接裂纹产生的原因及控制[J]. 材料与冶金学报, 2013(1): 67-71.
(Li Shusen, Liu Min, Zuo Xiurong. Reasons and controlling measures for cracking in weld joint for high-strength pipeline steels[J]. Journal of material and metallurgy, 2013(1):67-71. )
[2] Itoh H, Hino M, Ban-Ya S. Thermodynamics on the formation of spinel nonmetallic inclusion in liquid steel[J]. Metallurgical and Materials Transactions: B, 1997, 28(5): 953-956.
[3] 黄希祜. 钢铁冶金原理[M]. 北京:冶金工业出版社,第四版. 2013:545-546
(Huang Xihu. Principle of Metallurgical [M]. Beijing: Metallurgical Industry Press, 4th ed, 2013:545-546.)
[4] Rohde L E, Choudhury A, Wahlster M. New investigations on the Al-O equilibrium in Iron melts[J]. Arch Eisenhüttenwes, 1971, 42(3): 165-174.
[5] Sigworth G K, Elliott J F. The thermodynamics of liquid dilute iron alloys[J]. Journal of Materials Science, 1974, 8(1): 298-310.
[6] Turkdogan E T. Fundamentals of steelmaking[M]. London: The Institute of Materials, 1996.
[7] Steelmaking Data Sourcebook, The Japan Society for the Promotion of Science[C]//The 19th Committee on Steelmaking, New York: Gordon and Breach Science Publishers, 1988:45-49.
[8] Cho S W, Suito H. Assessment of aluminum-oxygen equilibrium in liquid iron and activities in CaO-Al2O3-SiO2slags[J]. ISIJ international, 1994, 34(2): 177-185.
[9] Ohta H, Suito H. Thermodynamics of aluminum and manganese deoxidation equilibria in Fe-Ni and Fe-Cr alloys[J]. ISIJ international, 2003, 43(9): 1301-1308.
[10] 陈家祥. 炼钢常用图表数据手册[M]. 北京:冶金工业出版社,1984:758-759.
(Chen Jiaxiang. Steelmaking common chart data manual[M]. Beijing: Metallurgical Industry Press, 1984:758-759.)
[11] Fruehan R J. Activities in liquid Fe-Al-O and Fe-Ti-O alloys[J]. Metallurgical Transactions, 1970, 1(12): 3403-3410.
[12] Holcomb G R, Pierre G R S. The solubility of alumina in liquid iron[J]. Metallurgical and Materials Transactions: B, 1992, 23(6): 789-790.
[13] Janke D, Fischer W. Deoxidation equilibria of Ti, Al and Zr in Fe melts at 1 600 ℃[J]. Arch Eisenhuttenwes, 1976, 47(4): 195-198.
[14] Jacobson N S, Mehrotra G M. Thermodynamics of iron-aluminum alloys at 1 573 K[J]. Metallurgical and Materials Transactions: B, 1993, 24(3): 481-486.
[15] Hilty D C, Crafts W. The solubility of oxygen in liquid iron containing aluminum[J]. Transaction of American Institute of Mining, Metallurgical, and Petroleum Engineers, 1950, 188(414): 181-204.
[16] Schenck H, Steinmetz E, Mehta K K. Equilibria and kinetics of the separation of alumina from the Fe-O-Al system at 1 600 ℃[J]. Arch Eisenhuttenwes, 1970, 41(2): 131-138.
