补肾活血方中单体成分的体外炎性抑制作用研究
2015-01-11孙东东闫秋莹刘丽萍沈卫星程海波
孙东东,闫秋莹,刘丽萍,沈卫星,程海波
南京中医药大学转化医学研究中心 国家中医药管理局名医验方评价与转化重点研究室 江苏省抗肿瘤验方研究与产业化工程实验室,南京 210023
补肾活血方是南京中医药大学第一附属医院用于治疗骨关节炎(osteoarthritis,OA)的协定处方,为深入研究补肾活血方治疗骨关节炎(OA)的效应物质基础及药效分子机制,前期试验采用液质联用技术(LC-MSn),围绕复方进行了定性和定量分析[1-3],确定了复方中存在的若干化合物,同时比较了配伍前后相关成分的含量变化。本研究结合文献查阅,选取出5 种在复方提取液中分离得到,并且文献报道有明确或潜在治疗OA 活性的单体作为体外炎症试验对象,他们分别是芍药苷[4]、阿魏酸[5]、白藜芦醇[6]、蛇床子素[7]、补骨脂素[8]。TNF-α、IL-6 及NO是目前已经验证的,与炎症有关或与OA 相关的细胞因子,这些炎性因子在OA 的发病过程中起着重要调节作用,可以加速关节软骨基质的分解代谢[9-12]。本实验采用酶联免疫法(ELISA)测定芍药苷等5 种单体成分及复方水提部位,对脂多糖(LPS)刺激诱导的RAW264.74 小鼠巨噬细胞释放炎症介质TNF-α、IL-6、NO 的抑制作用,方法快速、便利、准确,对于评价和验证复方OA 治疗活性,阐明药效分子机制,探究效应物质基础具有重要意义。
1 仪器与试药
ACQUITY UPLC 系统(四元泵溶剂系统,在线脱气机和自动进样器,美国Waters 公司),Xevo TQ型质谱检测器(美国Waters 公司),MassLynxTM 型质谱工作站软件(美国Waters 公司),BT125 型电子天平(赛多利斯科学仪器有限公司);EPED 超纯水系统(南京易普达易科技发展有限公司);TGL16 型低温高速离心机(长沙湘智离心机仪器有限公司);RE-52A 旋转蒸发仪(上海亚荣生化仪器厂);SY-1220 型水浴锅(美国Crystal 公司);1300SeriesA2 型无菌操作台(美国Thermo scientific 公司);无菌CO2恒温培养箱(美国Thermo scientific 公司);酶标仪(美国Thermo scientific 公司)。
独活、桑寄生、怀牛膝、淫羊藿、当归、川芎、白芍、虎杖、制天南星等药材,均购自安徽亳州,经南京中医药大学陈建伟教授对照2010 版药典(一部)的药材标准,进行定性和相关指标定量分析,鉴定为正品;芍药苷(批号:0736-9811)、阿魏酸(批号:0773-9910)、白藜芦醇(批号:10040-201201)、蛇床子素(批号:0822-9802)、补骨脂素(批号:739-8701)等标准品均购于中国药品生物制品检定所;脂多糖(LPS,1 mg/mL,Sigma 公司)、1640 培养基(Gibico公司)、FBS(上海四季青公司)、胰酶(批号:27250018,Gibico 公司)、DMSO(批号:20110105,上海凌风)、小鼠TNF-α ELISA 试剂盒(批号:EM004-96,规格96t,上海依科赛生物制品有限公司)、小鼠IL-6 ELISA 试剂盒(批号:EM008-96,规格96t,上海依科赛生物制品有限公司)、NO ELISA 试剂盒(批号:S0021-2,规格200t,江苏碧云天生物技术研究所);乙腈、甲酸(色谱纯,德国Merk 公司),水为超纯水,其他试剂均为分析纯;RAW264.74 小鼠巨噬细胞(批号:13-00302,上海汉博生物科技有限公司)。
2 实验方法
2.1 LC-MS 样品制备
独活等复方药材合并后加入8 倍量水,煎煮3次,时限分别为1、1、0.5 h,过滤后合并滤液,95%乙醇沉淀,离心后取上清液浓缩至干,精密称取0.1000 g 浸膏用50%甲醇定容至200 mL 容量瓶,经0.22 μm 微孔滤膜滤过,供液质连用分析;剩余浸膏供药效试验使用。
2.2 LC-MS 条件
色谱分离及质谱分析检测条件参考前面的定性和定量分析实验相关参数[1-3],取样锥孔电压、碰撞能量等5 种化合物的主要质谱检测参数参见表1。

表1 5 种化合物的主要质谱检测参数Table 1 The main MS detection parameters of 5 targeted compounds
2.3 细胞铺板[13]
用1640 培养基+10%FBS 培养小鼠巨噬细胞RAW264.74(培养条件:5% CO2,37℃恒温培养),待细胞长至适量后,用0.25%胰酶消化细胞,计数,稀释至1×105个/mL,以200 μL/孔的量铺至48 孔板中。放入无菌培养箱中,继续培养24 h。
2.4 给药方法及分组
用1640 培养基将LPS 稀释至500 μg/L,芍药苷、阿魏酸、白藜芦醇、蛇床子素、补骨脂素及复方水提部位等分别用DMSO 溶解使其浓度为1×105μg/mL,而后用培养基将待测试药分别稀释至100、20 μg/mL。吸净孔中培养基,将稀释后的试药依次加入300 μL,实验分设阴性对照组(不加药),LPS 对照组(只加LPS),芍药苷组(LPS+20 μg/mL 芍药苷、LPS+100 μg/mL 芍药苷),阿魏酸组(LPS+20 μg/mL 阿魏酸、LPS+100 μg/mL 阿魏酸),白藜芦醇组(LPS+20 μg/mL 白藜芦醇、LPS+100 μg/mL白藜芦醇),蛇床子素组(LPS+20 μg/mL 蛇床子素、LPS+100 μg/mL 蛇床子素),补骨脂素组(LPS+20 μg/mL 补骨脂素、LPS+100 μg/mL 补骨脂素),复方水提部位组(LPS+20 μg/mL 复方水提部位、LPS+100 μg/mL 复方水提部位);每组设三个复孔。将48 孔板置于无菌培养箱继续培养24 h。
2.5 检测方法
收集细胞上清液,在4 ℃下,10 000 rpm 离心2 min 后,吸取上清液,按照说明书中检测步骤处理上清液,最后用酶标仪以450 nm 为检测波长,检测TNF-α、IL-6 水平;以540 nm 为波长,检测NO 水平。按照试剂盒说明书要求进行操作,以标准品浓度为横坐标,吸光度为纵坐标,绘制标准曲线,根据样品OD 值计算样品细胞因子浓度,并记录。
2.6 数据计算及统计分析
抑制率(%)=100%-(加药组C 值-空白对照C值)/(LPS 组C 值-空白组C 值)(C 为细胞因子浓度);应用SPSS 12.0 软件进行统计分析,各组检测结果以均数±标准差(±s)表示,组间比较采用单因素方差分析,以P<0.05 为差异有统计学意义。
3 实验结果
3.1 补肾活血方中化合物的检测
结合LC-MS 测定,通过软件积分,文献比对和数据分析,确定补肾活血方中确实存在芍药苷、阿魏酸、白藜芦醇、蛇床子素及补骨脂素等化合物。
3.2 对LPS 诱导RAW264.74 细胞释放TNF-α,IL-6 及NO 的抑制作用
对根据酶标仪所测结果进行数据分析,与空白组比较,模型组TNF-α、IL-6、NO 含量明显升高(P<0.01);与模型组比较,阿魏酸、白藜芦醇及补骨脂素在100 μg/mL,以及蛇床子素在20、100 μg/mL 均对TNF-α 的释放具有显著的抑制(P<0.01),并且它们的最高抑制率强于复方水提部位;阿魏酸及补骨脂素在100 μg/mL,白藜芦醇及蛇床子素在20、100 μg/mL 均对IL-6 水平具有显著的抑制(P<0.01),并且它们的最高抑制率强于复方水提部位;芍药苷在100 μg/mL,阿魏酸、白藜芦醇、蛇床子素及补骨脂素在20、100 μg/mL 均对NO 的释放具有显著抑制(P<0.01),并且阿魏酸、白藜芦醇、蛇床子素、补骨脂素的最高抑制率均强于复方水提部位。从实验数据来看,样品浓度与TNF-α、IL-6 及NO 的释放抑制率基本是呈正相关系,仅发现补骨脂素在20 μg/mL 浓度时对于 NO 释放的抑制率为93.46%,大于在100 μg/mL 浓度时的抑制率81.31%,该现象有待进一步探究其原因。实验具体数据与结果见表2~4。
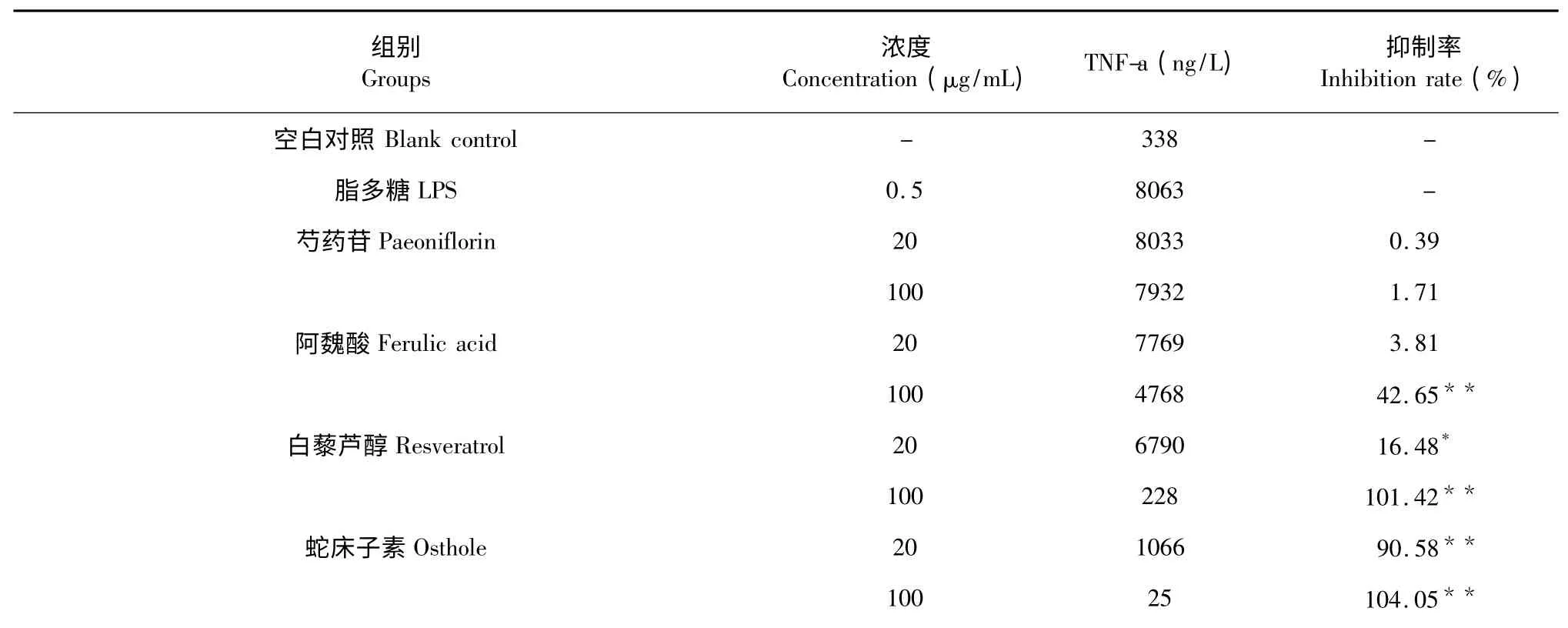
表2 复方中5 种单体对LPS 诱导RAW264.74 细胞释放TNF-α 的抑制作用Table 2 The inhibition effects of 5 components in recipe on TNF-α released by LPS-induced RAW264.74 cell

注:±s,n=3,加药组与LPS 模型对照组比较,* P<0.05,**P<0.01。Note:±s,n=3,compared with LPS group,* P<0.05,**P<0.01.
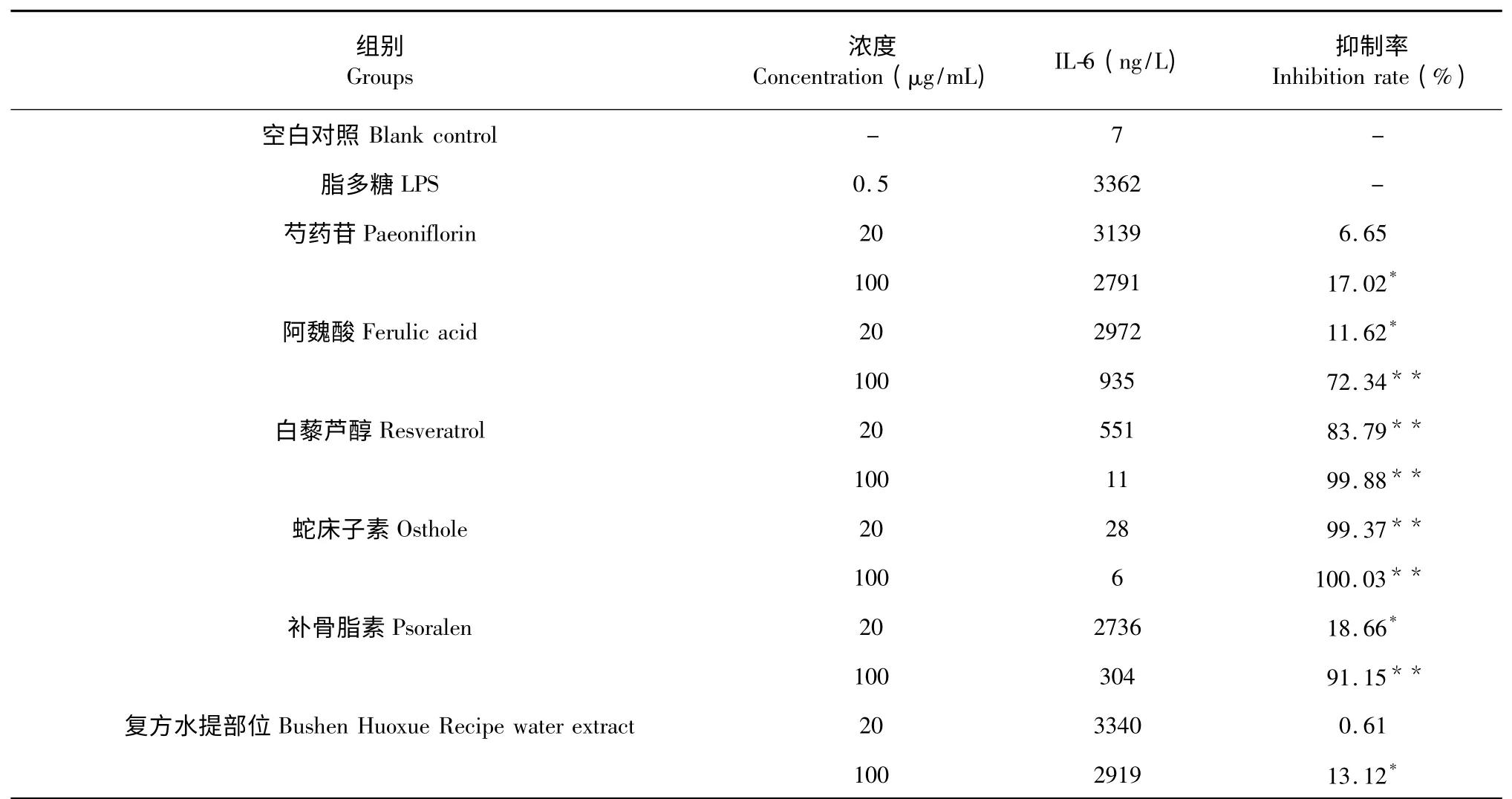
表3 复方中5 种单体对LPS 诱导RAW264.74 细胞释放IL-6 的抑制作用Table 3 The inhibition effects of 5 components in recipe on IL-6 released by LPS-induced RAW264.74 cell
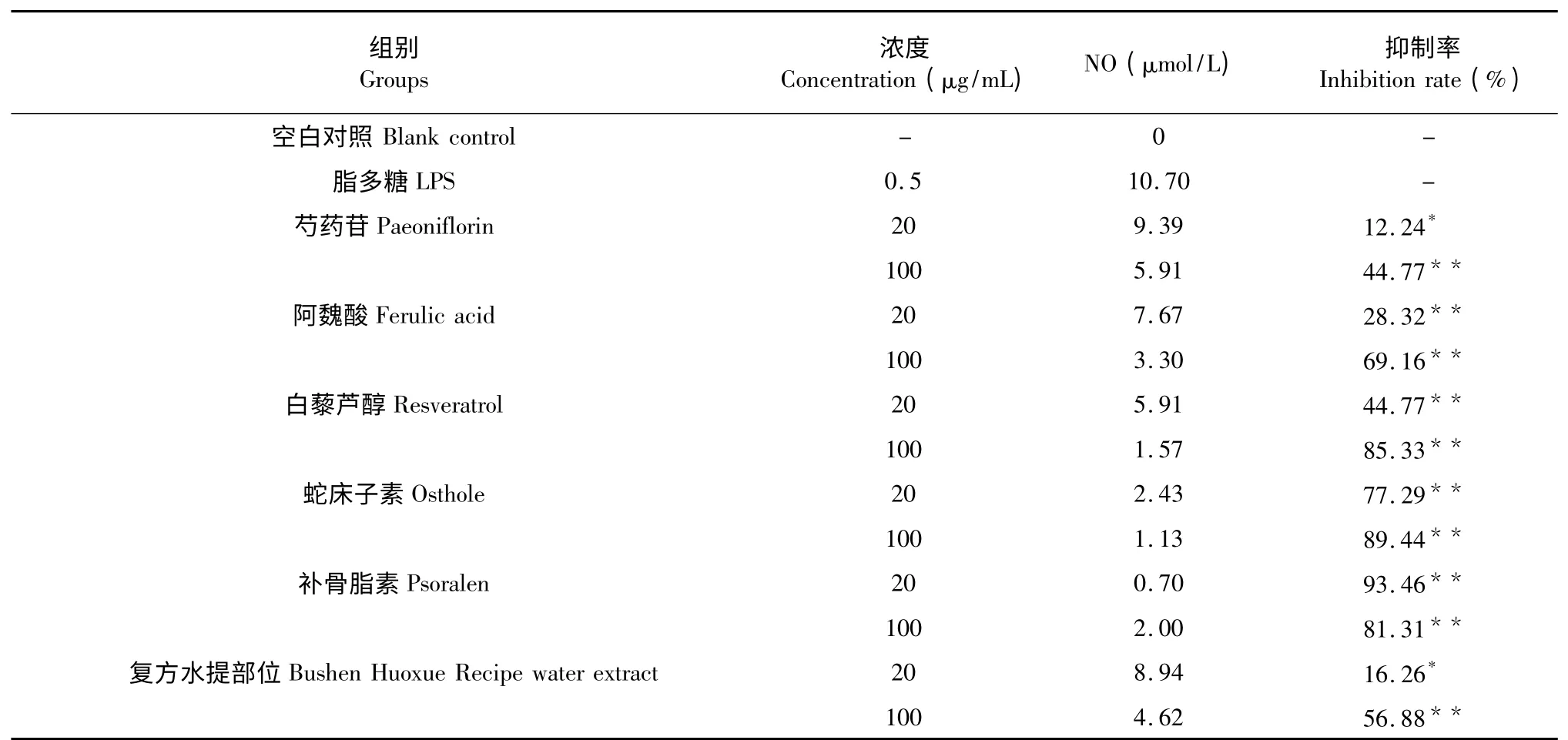
表4 复方中5 种单体对LPS 诱导RAW264.74 细胞释放NO 的抑制作用Table 4 The inhibition effects of 5 components in recipe on NO released by LPS-induced RAW264.74 cell
4 讨论
TNF-α 可激活多型棱细胞,刺激滑膜细胞的PGE 产生,增加骨、软骨的破坏。邓康夫等通过对TNF-α 的研究指出,TNF-α 以促滑膜成纤维细胞样细胞增殖作用为主,并因其增强滑膜细胞RNA 的表达功能,而使滑膜组织纤维性变大及滑液中细胞因子水平异常升高,从而改变关节的力学特征和软骨细胞的生活微环境,而成为参与OA 关节软骨退变的途径之一[9]。IL-6 又称B 细胞分化因子,其作用与B 细胞功能相关联,IL-6 可激活B 细胞和T 细胞,通过其自分泌形式作用于软骨细胞,促进软骨细胞的增殖[10]。NO 是多种细胞因子的信号分子,介导它们发挥生物学作用。正常情况下,NO 起着宿主防疫作用,但过量的NO 可导致各种慢性炎症。OA 发病早期,受损裸露的软骨细胞在周围细胞因子的作用下诱发诱导型一氧化氮合成酶(iNOS)蛋白表达,从而导致NO 大量释放。NO 又进一步促进炎症细胞因子释放,从而抑制软骨细胞分泌细胞外基质和合成Ⅱ型胶原,影响软骨的营养交换,使软骨处在一个不良的微环境中,最终导致软骨质量不断下降和进行性退化[11]。作为具有明确功能和效应的炎症介质,抑制细胞TNF-α、IL-6 及NO 的释放水平,对于缓解炎症症状、控制炎症进程具有重要意义。
复方中的多种成分对于TNF-α、IL-6 及NO 的释放显示了不同程度的抑制作用,这正验证了中药药效以及复方治疗的多靶点效应;复方其他的提取部位以及废弃的醇沉部位是否具有炎症因子释放抑制效应,这是我们活性实验需要补充努力的方向,为复方的多功能、不同药效找到科学实验依据;此外对于这些部位或成分还可以探索开展针对其他炎性因子的抑制效应研究,为更深层次的药理药效评价、作用机制分析提供支撑;另外补骨脂素在20 μg/mL的实验浓度时对于NO 的释放抑制率为93.46%,大于在100 μg/mL 浓度时的抑制率81.31%,其是否属于实验误差,还是具有双向调节机制作用,需要进一步探究其原因。
目前临床上治疗OA,主要采用非甾体抗炎药、镇痛剂以及关节注射透明质酸钠等手段,但是实际疗效往往并不理想,经常加重OA 的发病程度,延长病情;补肾补血方作为一个治疗OA 的临床验方,实践证明其疗效确切、安全可行;OA 从中医的角度应归于痹症范畴,痹症往往伴随大量的炎症反应,所以说如何有效结合中医的病机研判,从治则、治法等角度,通过药效实验,揭示复方治疗和干预的协同机制。反证中医的病机理论,提升完善中医理论,较好地达到医药结合,中药研究与中医理论的科学呼应,这也是我们复方研究下一步的重点和方向。
1 Sun DD(孙东东),Xu XF(徐晓芳),Yan SH(严世海),et al.Analysis on chemical components from water extract of Angelicae pubescentis Radix by high performance liquid chromatography-electrospray ionization-quadrupole-time of flightmass spectrometry.Nat Prod Res Dev(天然产物研究与开发),2014,26:69-76.
2 Sun DD(孙东东),Xu XF(徐晓芳),Liu LP(刘丽萍),et al.Content determination of twelve kinds of active ingredients in compound Bushen Huoxue Formula with UPLC-ESI-TQMS.China J Tradit Chin Med Pharm(中华中医药杂志),2014,29:1587-1590.
3 Sun DD(孙东东),Xu XF(徐晓芳),Cui JC(崔九成),et al.Analysis on chemical components from water extract of Paeoniae Radix Alba by high performance liquid chromatography-electrospray ionization-quadrupole-time of flight-mass spectrometry.Chin J Chin Mater Med(中国中药杂志),2013,38:1760-1765.
4 Zheng SC(郑世存),Li XY(李晓宇),Ouyang B(欧阳兵),et al.Research development on pharmacological of paeoniflorin.Chin J Pharmacovigilance(中国药物警戒),2012,9:100-103.
5 Huang F(黄丰),Deng HM(邓华明),Zhu MM(朱苗苗),et al.Inhibitory effect of ferulic acid on inflammatory response in microglia induced by lipopolysaccharides.Zoologic Res(动物学研究),2011,32:311-316.
6 Shen JL(沈皆亮),Hu ZM(胡侦明),Zhong XM(钟小明),et al.Resveratrol stimulates extracellular matrix synthesis in degenerative nucleus pulposus cells via upregulation of SIRT1.Chin J Cell Mol Immunol(细胞与分子免疫学杂志),2012,28:1146-1150.
7 Ming LG(明磊国),Wang MG(王鸣刚),Chen KM(陈克明),et al.Effect of osthol on apoptosis and bone resorption of osteoclasts cultured in vitro.Acta Pharm Sin(药学学报),2012,47:174-179.
8 Zhai YK(翟远坤),Pan YL(潘亚磊),Niu YB(牛银波),et al.Comparative studies on the differentiation and maturation of rat calvarial osteoblasts by psoralen and isopsoralen in vitro.Chin Pharm Bull(中国药理学通报),2012,28:355-361.
9 Deng LF(邓廉复),Chai BF(柴本甫),Yang QM(杨庆铭).Effects of tumor necrosis factor-α on proliferation and RNA expression of human osteoarthritic synoviocytes.Chin Pharmacol Bull(中国药理学通报),1998,14:506-508.
10 Li YN(李忆农).Cytokines and osteoarthritis.Chin J Rheumatol(中华风湿病学杂志),2000,4:56-58.
11 Jin DD(金大地),Sun W(孙炜),Wang JX(王吉兴),et al.Potential clinical evaluation of nitric oxide synthase inhib-itor for the treatment of osteoarthritis.Chin J Orthop(中华骨科杂志),2002,22:367-371.
12 Yang XJ(杨晓军),Miao WL(苗文丽),Pei L(裴林),et al.Influence of the Tianxing Jiangu recipe on the serum interleukin-1 and tumor necrosis factor alpha of adjuvant arthritis in rats.Chin J Basic Med Tradit Chin Med(中国中医基础医学杂志),2013,19:1284-1286.
13 Xu SY(徐叔云),Bian RL(卞如濂),Chen X(陈修).Methodology in Pharmacological Experiment,Third Edition.Beijing:People's Health Publishing House,2003.1785.
