杂豆植物化学素研究进展
2015-01-07梁亚静李爱科第文龙林亲录
梁亚静,韩 飞,李爱科,第文龙,梁 盈 ,林亲录
(1 国家粮食局科学研究院,北京 100032; 2 中南林业科技大学 食品科学与工程学院,湖南 长沙 410004)
杂豆植物化学素研究进展
梁亚静1,2,韩 飞1,李爱科1,第文龙1,梁 盈2,林亲录2
(1 国家粮食局科学研究院,北京 100032; 2 中南林业科技大学 食品科学与工程学院,湖南 长沙 410004)
杂豆富含植物化学素,这些天然化学物质具有一定的生物活性,尤其在预防与营养相关的慢性疾病方面。现对多种杂豆的植物化学素进行综述,包括植物化学素的种类及其抗氧化、预防代谢综合症和预防癌症的效果等,旨在为杂豆的合理开发利用提供科学依据。
杂豆;植物化学素;生物活性;杂豆资源利用
21世纪初,我国的心脑血管疾病、癌症、糖尿病以及慢性肺部疾病等4类慢性疾病患者人数已接近2亿,其中心脑血管疾病、癌症及心脏病死亡病例占我国死亡人口总数的63.40%[1]。近几年,我国慢性疾病患者人数还在不断增加,如何预防和减轻这些病症已成为人们最为关注的问题之一。慢性疾病病因复杂,流行病学调查和动物试验发现其与人体营养物质的摄入密切相关[2-3]。研究表明,合理的膳食搭配可以预防约80%的心脏病和糖尿病以及约40%的癌症[1]。《中国居民膳食指南(2007)》第1条推荐“食物多样,谷类为主,粗细搭配”,其中“粗”指的就是传统的杂粮和杂豆[4],可见杂豆在人们的健康膳食中占有非常重要的地位。
杂豆中富含对人体健康有益的植物化学素,如酚酸、黄酮、植酸、植物雌激素等,这些植物化学素可作为天然的抗氧化剂,合理食用杂豆可潜在预防一些相关的慢性疾病[2]。本研究对杂豆植物化学素单体、含量及其抗氧化能力、预防慢性疾病的效果等进行了综述,旨在为我国杂豆资源的综合开发利用提供理论依据。
1 杂豆中的植物化学素
我国杂豆种植历史悠久,种类繁多,种植区域分布较广。种植的种类主要包括绿豆、小豆、芸豆、豌豆、蚕豆、豇豆、扁豆、鹰嘴豆、饭豆等。不同种类的杂豆中均含有丰富的植物化学素[2],这些植物化学素主要存在于豆类种皮中,仅有少量存在于子叶中[5]。杂豆中的植物化学素主要有类胡萝卜素、生物碱、蛋白酶抑制剂、植酸、皂苷、植物固醇、酚酸、类黄酮、花色苷/花青素、植物甾醇类、植物雌激素、维生素E和维生素C等[2,6]。研究表明,杂豆中的植物化学素具有较强的抗氧化活性,可延缓衰老、预防癌症,能使血液流动畅通并可以保护视力等,有些活性物质还能提高人体免疫力,促进脂肪代谢[7]。此外,部分杂豆中含有少量的类胡萝卜素,其不仅自身具有一定的生物活性功能,而且能够转化为与人体视觉有关的维生素A[3]。杂豆中的植物甾醇含量较谷类稍高一些,摄入一定量的植物甾醇能有效降低一些慢性疾病的发病率。杂豆的种皮呈现多种色泽的主要原因是富含多酚类(黄酮、单宁、酚酸、花青素)化合物,大量的研究表明,这些有色物质具有降低人体代谢综合症的发病率和预防癌症等作用,部分有色化合物还能提高人体免疫力[8]。
1.1 酚 类
酚类主要包括酚酸类、黄酮类化合物及单宁和花青素,大部分杂豆中的酚类物质含量高于谷类,各种杂豆中主要的黄酮、酚酸和维生素E单体等酚类物质详见表1。由表1可见,杂豆中的黄酮类化合物主要包括黄烷醇、黄烷-3-醇、黄酮和花青素(表1),其多数以苷类存在于豆类中;杂豆的主要酚酸类物质包括香草酸、咖啡酸、阿魏酸和芥子酸,每100 g干绿豆、扁豆、蚕豆中的酚酸类物质含量为2~3 mg,相较其他杂豆低,而菜豆、扁豆、豇豆等豆类的酚酸含量较高[9]。
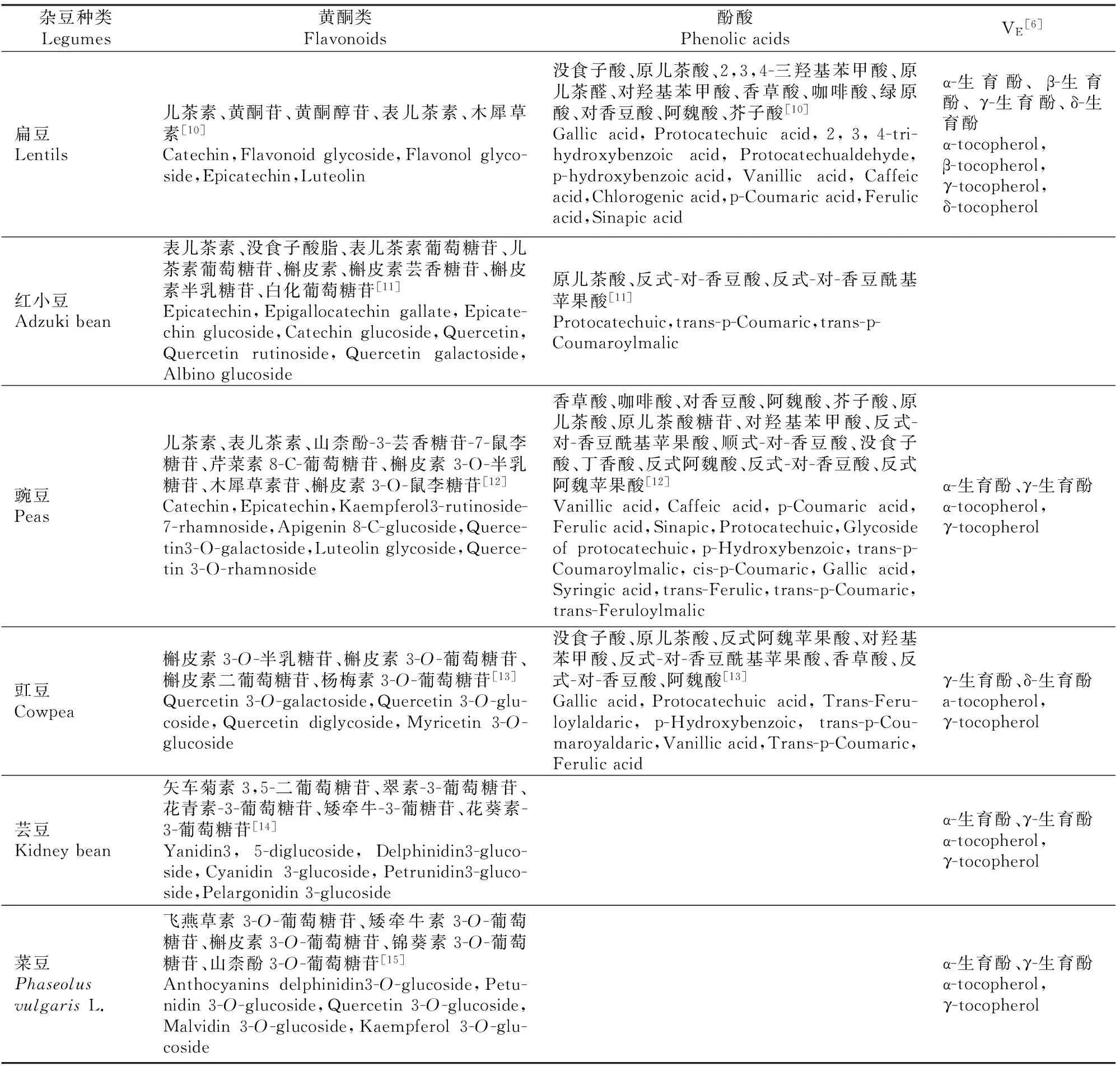
表1 杂豆中的黄酮类、酚酸类化合物和维生素E Table 1 Flavonoids,phenolic acids and vitamin E in legumes
杂豆中总酚的含量见表2,其中红小豆、芸豆、扁豆、菜豆的总酚含量较其他杂豆高[6]。缩合单宁(即原花青素)是以黄烷-3-醇为基础的聚合物,在温度较高的酸性乙醇溶液中可分解为花青素和儿茶素[18]。扁豆、红小豆中单宁含量较丰富,扁豆和黑豆中含有的缩合单宁最丰富,干扁豆中原花青素B2、B3和B4的含量为1~5 μg/kg[22],红小豆的提取物中原花青素B1、B2、B3和B4的含量为15.9~213 μg/g[11]。

表2 常见杂豆的总酚含量Table 2 Total phenolic content in legumes
注:“*”总酚含量以儿茶素当量计;“&”总酚含量以没食子当量计。
Note:“*” The total phenolic content is shown as catechin equivalent;“&” the total phenolic content is shown as Gallic equivalent.
各种杂豆中的黄酮含量见表3。表3显示,绿豆、豌豆、黄豌豆、鹰嘴豆、小扁豆、红芸豆等豆类的总黄酮含量为0.08~4.54 mg/g(以儿茶素当量(CAE)计)[15,20,23]。

表3 常见杂豆的总黄酮含量Table 3 Total flavonoids content of legumes

续表3 Continued table 3
注: 总黄酮含量以儿茶素当量计。
Note:Total flavonoids are shown as catechin equivalent.
1.2 维生素
维生素E又名生育酚,包括生育三烯酚、α-生育酚、γ-生育酚、β-生育酚和δ-生育酚等5种异构体,除生育三烯酚外,目前其他4种生育酚的异构体在杂豆中均有检出报道[6],不同杂豆的生育酚见表1。杂豆中含有的α-生育酚和γ-生育酚较多,β-生育酚和δ-生育酚含量相对较少,其β-生育酚含量为1.94~3.81 mg/g[24]。绿豆生育酚含量丰富,生育酚α、γ、δ的含量分别为1.1~10.1,60.7~80.9和4.6~11.2 mg/kg[25]。干鹰嘴豆、扁豆、豌豆中的γ-生育酚含量为45~57 mg/kg,较其他杂豆高。杂豆中的γ-生育酚可能具有独特的功能,可排出二氧化氮和其他活性氮,有研究表明γ-生育酚可以预防心血管疾病[6,24]。α-生育酚由于含有三甲基取代基,因此其在生育酚中的抗氧化活性最强[26]。维生素C以抗坏血酸和脱氢抗坏血酸的形式存在于杂豆中,鲜绿豆中的抗坏血酸含量为62.7 mg/kg,鲜菜豆、豌豆、红小豆中的抗坏血酸含量为2.1~25.9 mg/kg,绿豆芽中的维生素C含量较绿豆种子高[2,27],杂豆中维生素的抗氧化能力对其抗氧化活性的贡献较大[6]。
2 杂豆植物化学素的功能与作用
2.1 抗氧化作用
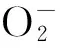
以维生素E为例,其能够直接修复氧化的自由基,防止反应链传输过程中脂质的自动氧化,其与来自多不饱和脂肪酸的烷氧基(LO·)、脂质过氧自由基(LOO·)、烷基自由基(L·)等发生氧化反应,通过维生素C、还原型谷胱甘肽或辅酶Q可以生成还原形式的生育酚。生育酚通过改变电荷转移机制可作为单线态氧的清除剂和单重态氧的物理失活剂,在这个过程中生育酚不能生成原来的还原形式[26]。
2.1.2 抗氧化性 杂豆植物化学素抗氧化能力研究的最常用方法有DPPH·自由基清除能力(DPPH)、ABTS+·自由基清除能力(ABTS)、铁离子还原抗氧化能力(FRAP)、氧化自由基吸收能力(ORAC)、细胞抗氧化活性(CAA)评价等[28-30],常见杂豆的抗氧化能力见表4。采用不同方法测得的抗氧化活性存在差异,当DPPH与某些植物化学素的紫外吸收有重迭时,会对试验结果产生一定的影响[31];FRAP法不能检测出含有疏基的植物化学素;ORAC法具有较高的特异性和较好的重现性[29];CAA较化学分析更能准确地表示生理特性,且检测周期短、测定程序简单[32]。以Trolox当量计,扁豆和黑豆的DPPH自由基平均清除能力最高(18~19 μmol/g),其次是菜豆(约14 μmol/g)和黄色、绿色的豌豆与黄豆(低于2 μmol/g)。以Fe2+当量计,扁豆类具有最高的三价铁离子还原抗氧化能力(FRAP值),平均水平为11.79 μmol/hg,其次是菜豆(5.83 μmol/hg),黄豌豆和绿豌豆均低于1.5 μmol/hg。以Trolox当量计,黑豆类杂豆的氧化自由基吸收能力(ORAC)平均水平最高(131.34 μmol/g),其次是扁豆(80.84 μmol/g)、菜豆(62.57 μmol/g)、黄豆(38.73 μmol/g),豌豆和青豆均低于10 μmol/g[20]。
不同溶剂提取的杂豆多酚、黄酮含量存在一定的差异,进而影响其抗氧化能力。Xu等[16]研究表明,扁豆、黑豆、红芸豆的体积分数70%酸性丙酮(V(丙酮)∶V(水)∶V(乙酸)=70∶29.5∶0.5)提取物中总酚和总黄酮含量最高,抗氧化能力FRAP值较高;所有试验豆类中,其体积分数70%乙醇(V(乙醇)∶V(水)=70∶30)提取物的氧化自由基吸收能力(ORAC值)最高;黄豌豆、绿豌豆、鹰嘴豆、黄豆体积分数80%丙酮(V(丙酮)∶V(水)=80∶20)提取物的总黄酮、缩合单宁含量较高,DPPH自由基清除活性较强。
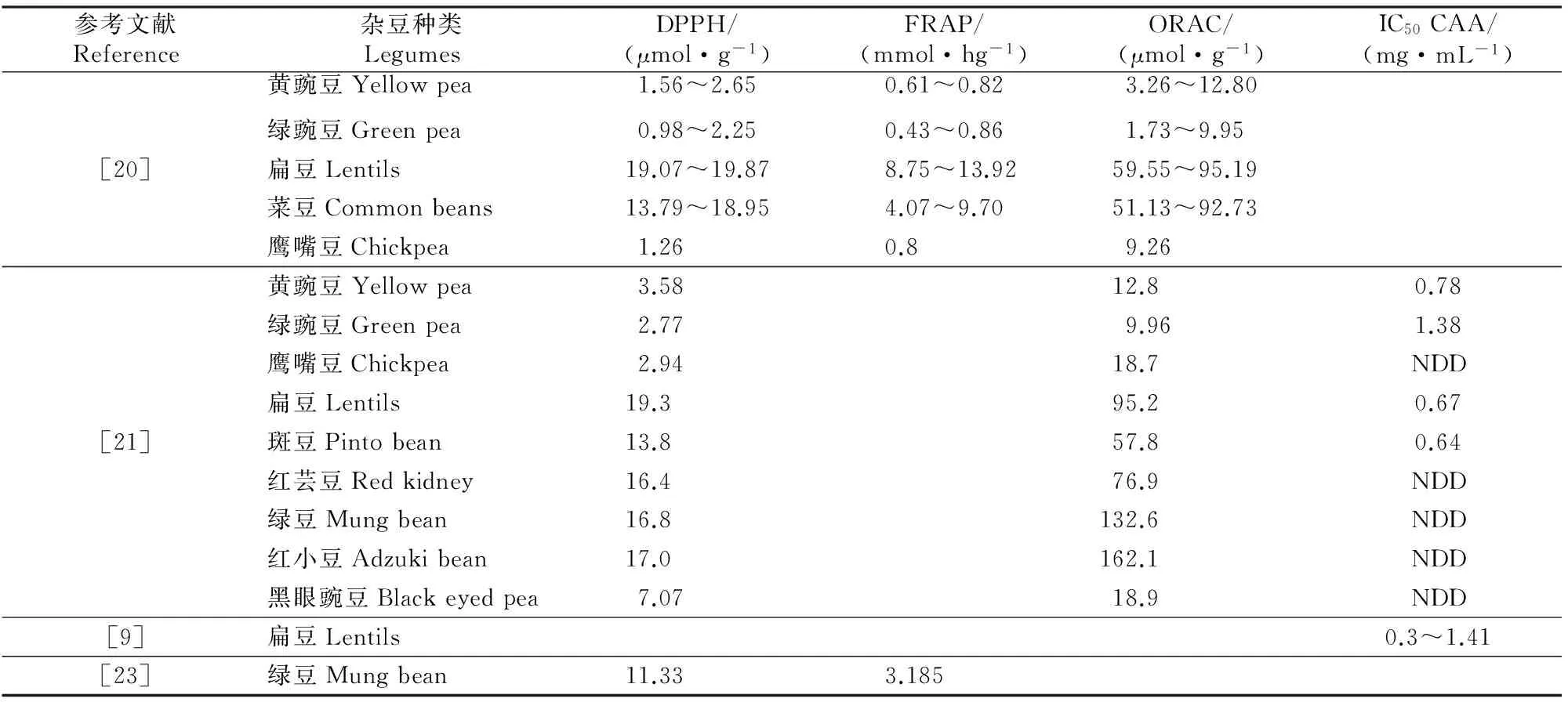
表4 常见杂豆的抗氧化能力Table 4 Antioxidant capacity of legumes
注:DPPH、ORAC结果以Trolox 当量计;FRAP结果以Fe2+当量计;IC50表示诱导肿瘤细胞凋亡50%时的抗氧化剂质量浓度; NDD表示无剂量依赖性。
Note:DPPH and ORAC results are shown as Trolox equivalent;FRAP results are expressed as Fe2+equivalent;IC50represents the concentration of antioxidant when tumor cell apoptosis is 50%;NDD means no measure dependence.
经过不同热处理后,杂豆植物化学素会有部分损失,因而其抗氧化能力也会有所改变。 Boateng等[33]的研究表明,红芸豆、黑眼豌豆经1 200 W微波炉焙烤6 min后,其总酚含量高于未加工和浸泡的同种豆类;红芸豆经过相同条件焙烤后的抗氧化能力(FRAP值)强于未加工和浸泡的值,而DPPH自由基清除能力较未加工的弱;未经加工的黑眼豌豆的抗氧化指标(FRAP和DPPH值)高于经过常规蒸煮的黑眼豌豆,这可能与2种豆类的植物化学素组成有关[30]。未加工黑菜豆和斑豆的细胞抗氧化活性(CAA)与植物化学素的剂量呈正相关,黑菜豆的CAA值高于斑豆,而经过热加工后2种豆类的CAA值普遍降低[34]。
2.2 代谢综合症预防
2.2.1 降血脂 目前关于豆类植物化学素降血脂作用的研究非常少。Gupta等[35]研究了印度一种山扁豆提取物对高脂饮食大鼠血脂代谢的影响,结果表明这些提取物能有效降低血清总胆固醇甘油三酯和磷脂,并有显著的剂量依赖性。植物化学素的降血脂作用可能是所有植物化学素和其他物质协同作用的结果,也有可能是某类物质单独作用的体现[36]。
2.2.2 降血糖 近年来的研究表明,鹰嘴豆、羽扇豆、绿豆等豆类具有降血糖作用,人体摄入一定量的豆类可有效预防和控制Ⅱ型糖尿病[37]。李燕等[38]研究表明,鹰嘴豆异黄酮类物质对糖尿病小鼠的治疗效果优于常用药物二甲双胍。Yao等[39]用绿豆芽和绿豆皮提取物喂食KK-Ay糖尿病小鼠,5周后发现小鼠的血糖、血浆C肽、胰高血糖素、总胆固醇、甘油三酯和尿素氮水平都有所降低,同时小鼠的葡萄糖耐受性得到显著改善,并且胰岛素的免疫反应性水平有所提高。Ghattas等[40]将鹰嘴豆添加到糖尿病患者的食物中,来辅助Ⅱ型糖尿病患者的治疗,结果表明患者的胰岛素和糖化血红蛋白水平等均显著提高,证明这些物质的添加有利于降低他们的血糖含量。
2.2.3 降血压 ACE酶是一种血管紧张素转换酶,其在调节血压和维持正常的心血管功能中发挥着关键作用。有研究表明,抑制ACE酶的活性能够降低血压[41-42]。食用植物中的生物活性物质具有ACE酶抑制活性,从草本植物中获得的多酚提取物能够调节ACE活性。动物试验表明,饮食多酚含量丰富的食物具有降血压的功效,纯绿原酸能有效抑制高血压大鼠体内的ACE酶活性[42]。Hanson等[43]研究表明,用含质量分数30%蚕豆、豌豆、小扁豆、鹰嘴豆的食物分别连续喂养高血压和自发性高血压大鼠4周后,大鼠的总胆固醇(TC)、LDL-胆固醇和HDL-胆固醇含量均有所降低,扁豆还能显著降低自发性高血压大鼠的血压,但对大鼠的脉波传递速度无明显影响。Huisamen等[44]用牧豆喂食高血压大鼠12~16周,结果表明,牧豆能保护心脏和预防心肌梗塞,且不会影响试验动物的体质量。
2.3 预防癌症
2.3.1 抑制癌细胞的增殖 癌细胞能产生过量H2O2,使得丝裂原-活化蛋白激酶受到过度激活,从而激活氧化还原敏感性转录因子和应答基因,这样就增强了癌细胞的生存能力,植物化学素可以和受体相互作用向细胞传递信号并清除过量的H2O2,从而抑制癌细胞的增殖[45]。Xu等[20]用MTT法研究豌豆、鹰嘴豆、扁豆、菜豆、绿豆和红小豆的植物化学素对9种癌细胞(急性髓细胞白血病细胞系HL-60、卵巢腺癌细胞系SK-OV-3、胃癌细胞株AGS、舌鳞癌细胞株CAL27、大肠腺癌细胞株SW480、乳腺癌细胞系MCF-7、前列腺癌细胞系DU145、肝癌细胞株HepG2、结肠癌细胞株Caco-2)的抑制作用,结果表明,红小豆具有最强的抗增殖作用,并对肿瘤细胞株CAL27、AGS、HepG2、SW480和Caco-2呈剂量依赖性抑制作用;黄豌豆仅对SW480细胞系具有抑制作用;鹰嘴豆对细胞系CAL27、AGS和SW480表现出剂量依赖性的抑制作用,证明有色豆类更具抗癌潜力。Boue等[46]用MCF-7细胞系来研究绿豆芽、大豆、绿菜豆等植物雌激素的抗癌活性,结果表明几种豆类的雌激素均可抑制MCF-7细胞的增殖。
2.3.2 诱导肿瘤细胞的凋亡 细胞凋亡是指细胞在一定的生理或病理条件下,受内在遗传机制的控制而自动结束生命的过程,是细胞的程序性死亡(PCD)。细胞凋亡发生在细胞内,涉及一系列的生化反应,从而使细胞的形态和功能发生变化,最终导致细胞死亡[47]。豌豆、小扁豆、豆角中的植物雌激素单体三羟异黄酮具有较强的生物活性,能有效诱导癌细胞凋亡[48]。Yuan等[49]发现,植物雌激素能抑制DU145和HL细胞的增殖并诱导其凋亡,但对人体正常肝细胞L-O2的影响很小。豌豆、小扁豆、豆角中的三羟基异黄酮(10~70 μg/mL)能抑制前列腺癌细胞PC-3增殖,并可诱导PC-3细胞凋亡[50]。
2.4 其 他
动物试验表明,食用多酚类含量高的食物对人体的健康有很多益处,有些可食用植物还具有抗炎和调节肥胖症等功效[42]。绿豆中的黄酮类化合物可与有机磷农药中的汞、砷、铅结合形成沉淀,使这些重金属元素的含量减少或失去毒性,并可以减少胃肠道对重金属的吸收[7]。
3 小 结
我国杂豆种植区域广,种类和品种繁多,不同种类的杂豆研究水平还存在一定的差距。杂豆中含有丰富的蛋白质等营养物质及植物化学素,具有降低慢性疾病发病率等潜在功能特性,但并未得到很好利用。目前,对我国优势品种杂豆中植物化学素种类、含量及其功能特性的比较研究还较少,需要开展更深入系统的研究,从而为杂豆类功能性食品的开发提供理论基础。此外,加工及烹饪方式对杂豆植物化学素及其功能特性影响的报道也不多见,如何在加工过程中保护植物化学素不被破坏或提高其生物活性,是发挥杂豆植物化学素功能特性的前提,也是科学合理食用杂豆的理论基础。
[1] 唐金华.中国居民慢性非传染性疾病现状及危险因素 [J].中国医药指南,2013,11(17):486-487.
Tang J H.Status and risk factors of non-communicable chronic diseases of Chinese resident [J].Chinese Pharmaceutical Guide,2013,11(17):486-487.(in Chinese)
[2] 葛可佑.中国营养科学全书 [M].北京:人民卫生出版社,2006.
Ge K Y.Chinese nutrition science [M].Beijing:People’s Health Publishing,2006.(in Chinese)
[3] 王立峰.薏米中多酚类物质对抗氧化、抗肿瘤、降血脂作用的评价研究 [D].江苏无锡:江南大学,2012.
Wang L F.Evaluation research of antioxidant,anti-tumor and hypolipidemic effect of polyphenols from adlay [D].Wuxi,Jiangsu:Jiangnan University,2012.(in Chinese)
[4] 顾景范.食物中植物化学素的抗氧化作用 [J].营养健康新观察,2003(19):5-10.
Gu J F.Antioxidant effects of phytochemicals in foods [J].Nutrition and Health New Observations,2003(19):5-10.(in Chinese)
[5] Lin P Y,Lai H M.Bioactive compounds in legumes and their germinated products [J].Journal of Agricultural and Food Chemistry,2006,54(11):3807-3814.
[6] Amarowicz R,Pegg R B.Legumes as a source of natural antioxidants [J].European Journal of Lipid Science and Technology,2008,110(10):865-878.
[7] 苏冰霞.绿豆种营养素和部分功能性成分在加工过程中变化的研究 [D].南昌:南昌大学,2007.
Su B X.Research of nutrients and some functional composition changes from mung bean during processing [D].Nanchang:Nanchang University,2007.(in Chinese)
[8] Reynoso-Camacho R,Ramos-Gomez M,Loarca-Pina G.Bioactive components in common beans (PhaseolusvulgarisL.) [M]//Guevara-Gonzlez R G,Torres-Pacheco I.Advances in Agricultural and Food Biotechnology.Trivandrum:Research Signpost,2006:217-236.
[9] Sosulski F W,Dabrowski K J.Composition of free and hydrolyzable phenolic acids in the flours and hulls of ten legume species [J].Journal of Agricultural and Food Chemistry,1984,32(1):131-133.
[10] Xu B J,Chang S K C.Phenolic substance characterization and chemical and cell-based antioxidant activities of 11 lentils grown in the Northern United States [J].Journal of Agricultural and Food Chemistry,2010,58(3):1509-1517.
[11] Amarowicz R,Estrella I,HernANdez T,et al.Antioxidant activity of extract of adzuki bean and its fractions [J].Journal of Food Lipids,2008,15(1):119-136.
[13] Duenas M,Fernandez D,Hernandez T,et al.Bioactive phenolic compounds of cowpeas (VignasinensisL.) modifications by fermentation with natural microflora and withLactobacillusplantarumATCC 14917 [J].Journal of the Science of Food and Agriculture,2005,85(2):297-304.
[14] Choung M G,Choi B R,An Y N,et al.Anthocyanin profile of Korean cultivated kidney bean (PhaseolusvulgarisL.) [J].Journal of Agricultural and Food Chemistry,2003,51(24):7040-7043.
[15] Beninger C W,Hosfield G L.Antioxidant activity of extracts,condensed tannin fractions,and pure flavonoids fromPhaseolusvulgarisL. seed coat color genotypes [J].Journal of Agricultural and Food Chemistry,2003,51(27):7879-7883.
[16] Xu B J,Chang S K C.A comparative study on phenolic profiles and antioxidant activities of legumes as affected by extraction solvents [J].Journal of Food Science,2007,72(2):159-166.
[17] Siddhuraju P,Becker K.The antioxidant and free radical scavenging activities of processed cowpea (Vignaunguiculata(L.) Walp.) seed extracts [J].Food Chemistry,2007,101(1):10-19.
[18] Amarowicz R,Troszyńska A,Barylko-pikielna N,et al.Polyp-henolics extracts from legume seeds:Correlations between total antioxidant activity,total phenolics content,tannins content and astringency [J].Journal of Food Lipids,2004,11(4):278-286.
[19] Madhujith T,Shahidi F.Antioxidant potential of pea beans (PhaseolusvulgarisL.) [J].Journal of Food Science,2005,70(1):85-90.
[20] Xu B J,Yuan S H,Chang S K C.Comparative analyses of phenolic composition,antioxidant capacity,and color of cool season legumes and other selected food legumes [J].Journal of Food Science,2007,72(2):167-177.
[21] Lee J H,Jeon J K,Kim S G,et al.Comparative analyses of total phenols,flavonoids,saponins and antioxidant activity in yellow soy beans and mung beans [J].International Journal of Food Science & Technology,2011,46(12):2513-2519.
[22] Xu B J,Chang S K C.Comparative study on antiproliferation properties and cellular antioxidant activities of commonly consumed food legumes against nine human cancer cell lines [J].Food Chemistry,2012,134(3):1287-1296.
[23] Lopez-Amoros M L,Hernandez T,Estrella I.Effect of germination on legume phenolic compounds and their antioxidant activity [J].Journal of Food Composition and Analysis,2006,19(4):277-283.
[24] Ryan E,Galvin K,O’Connor T P,et al.Phytosterol,squalene,tocopherol content and fatty acid profile of selected seeds,grains,and legumes [J].Plant Foods for Human Nutrition,2007,62(3):85-91.
[25] Anwar F,Latif S,Przybylski R,et al.Chemical composition and antioxidant activity of seeds of different cultivars of mung bean [J].Journal of Food Science,2007,72(7):503-510.
[26] Vertuani S,Angusti A,Manfredini S.The antioxidants and pro-antioxidants network:An overview [J].Current Pharmaceutical Design,2004,10(14):1677-1694.
[27] Moriyama M,Oba K.Comparative study on the vitamin C contents of the food legume seeds [J].Journal of Nutritional Science and Vitaminology,2008,54(1): 1-6.
[28] Ozgen M,Reese R N,Tulio A Z,et al.Modified 2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid (ABTS) method to measure antioxidant capacity of selected small fruits and comparison to ferric reducing antioxidant power (FRAP) and 2,2′-diphenyl-1-picrylhydrazyl (DPPH) methods [J].Journal of Agricultural and Food Chemistry,2006,54(4):1151-1157.
[29] Thaipong K,Boonprakob U,Crosby K,et al.Comparison of ABTS,DPPH,FRAP,and ORAC assays for estimating antioxidant activity from guava fruit extracts [J].Journal of Food Composition and Analysis,2006,19(6):669-675.
[30] Dudonne S,Vitrac X,Coutiere P,et al.Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of industrial interest using DPPH,ABTS,FRAP,SOD,and ORAC assays [J].Journal of Agricultural and Food Chemistry,2009,57(5):1768-1774.
[31] Sharma O P,Bhat T K.DPPH antioxidant assay revisited [J].Food Chemistry,2009,113(4):1202-1205.
[32] Wolfe K L,Liu R H.Cellular antioxidant activity (CAA) assay for assessing antioxidants,foods,and dietary supplements [J].Journal of Agricultural and Food Chemistry,2007,55(22):8896-8907.
[33] Boateng J,Verghese M,Walker L T,et al.Effect of processing on antioxidant contents in selected dry beans (Phaseolusspp L.) [J].LWT-Food Science and Technology,2008,41(9):1541-1547.
[34] Xu B J,Chang S K C.Total phenolic,phenolic acid,anthocyanin,flavan-3-ol,and flavonol profiles and antioxidant properties of pinto and black beans (PhaseolusvulgarisL.) as affected by thermal processing [J].Journal of Agricultural and Food Chemistry,2009,57(11):4754-4764.
[35] Gupta U C,Jain G C.Study on hypolipidemic activity of cassia fistula legume in rats [J].Asian J Exp Sci,2009,23(1):241-248.
[36] Cinti S,Mitchell G,Barbatelli G,et al.Adipocyte death defines macrophage localization and function in adipose tissue of obese mice and humans [J].Journal of Lipid Research,2005,46(11):2347-2355.
[37] Venn B J,Mann J I.Cereal grains,legumes and diabetes [J].European Journal of Clinical Nutrition,2004,58(11):1443-1461.
[38] 李 燕,巫冠中,张巨松,等.鹰嘴豆异黄酮提取物对糖尿病小鼠血糖和氧化-抗氧化态的效应 [J].中国组织工程研究与临床康复,2007,11(38):7625-7628.
Li Y,Wu G Z,Zhang J S,et al.Effects of chickpea isoflavone extracts on oxidation and anti-oxidation state and blood glucose in diabetic mice [J].Chinese Tissue Engineering Journal of Clinical and Rehabilitation,2007,11(38):7625-7628.(in Chinese)
[39] Yao Y,Chen F,Wang M,et al.Antidiabetic activity of mung bean extracts in diabetic KK-Ay mice [J].Journal of Agricultural and Food Chemistry,2008,56(19):8869-8873.
[40] Ghattas L A,Hanna L M,Tapozada S T,et al.Some complementary hypoglycemic supplements from grains and legumes for the management of type 2 diabetes mellitus [J].Journal of Medical Sciences,2008,8(2):102-110.
[41] 常 洁,姜宗培,余学清.氧化应激及其在糖尿病肾病中的作用 [J].国际内科学杂志,2007,34(2):105-108.
Chang J,Jiang Z P,Yu X Q.Oxidative stress and its role in diabetic nephropathy [J].International Journal of Internal Medicine,2007,34(2):105-108.(in Chinese)
[42] Sakulnarmrat K.Potential health properties of selected commercially grown native Australian herbs and fruits [D].Sydney,New South Wales:The University of New South Wales,2012.
[43] Hanson M G,Zahradka P,Taylor C G.Lentil-based diets attenuate hypertension and large-artery remodelling in spontaneously hypertensive rats [J].British Journal of Nutrition,2014,111(4):690-698.
[44] Huisamen B,George C,Dietrich D,et al.Cardioprotective and anti-hypertensive effects of prosopis glandulosa in rat models of pre-diabetes:Cardiovascular topics [J].Cardiovascular Journal of Africa,2013,24(2):10-16.
[45] 庞广昌,陈庆森,胡志和.食品非营养成分发挥生物学作用的信号通路 [J].食品科学,2010,31(17):1-20.
Pang G C,Chen Q S,Hu Z H.Non-nutrients in food play a biological role of signaling pathways [J].Food Science,2010,31(17):1-20.(in Chinese)
[46] Boue S M,Wiese T E,Nehls S,et al.Evaluation of the estrogenic effects of legume extracts containing phytoestrogens [J].Journal of Agricultural and Food Chemistry,2003,51(8):2193-2199.
[47] Khan N,Adhami V M,Mukhtar H.Apoptosis by dietary agents for prevention and treatment of prostate cancer [J].Endocrine-related Cancer,2010,17(1):39-52.
[48] Martens S,Mithöfer A.Flavones and flavone synthases [J].Phytochemistry,2005,66(20):2399-2407.
[49] Fan Y J,Huang N S,Xia L.Genistein synergizes with RNA interference inhibiting survivin for inducing DU-145 of prostate cancer cells to apoptosis [J].Cancer Letters,2009,284(2):189-197.
[50] Kumi-Diaka J,Saddler-Shawnette S,Aller A,et al.Potential mechanism of phytochemical-induced apoptosis in human prostate adenocarcinoma cells:Therapeutic synergy in genist-ein and beta-lapachone combination treatment [J].Cancer Cell Int,2004,4(5):1-9.
Research progress in phytochemicals from legumes
LIANG Ya-jing1,2,HAN Fei1,LI Ai-ke1,DI Wen-long1,LIANG Ying2,LIN Qin-lu2
(1AcademyofStateAdministrationofGrain,Beijing100032,China;2FoodScienceandEngineeringCollege,CentralSouthUniversityofForestryandTechnology,Changsha,Hunan410004,China)
Legumes are rich in phytochemicals.Studies have indicated that some of these natural substances have great biological activities,especially in the prevention of chronic diseases.This paper reviewed phytochemicals from various legumes,including the categories,antioxidant abilities,and prevention of metabolic syndromes and cancers,to provide scientific basis for development and utilization of legumes.
legumes;phytochemicals;biological activity;utilization of legumes
时间:2015-09-09 15:41
10.13207/j.cnki.jnwafu.2015.10.005
2014-03-10
粮食公益性行业科研专项(201313011-6)
梁亚静(1988-),女,陕西咸阳人,在读硕士,主要从事粮油营养研究。E-mail:765293486@qq.com
韩 飞(1973-),女,内蒙古包头人,副研究员,博士,主要从事粮油营养研究。E-mail:hf@chinagrain.org
S52;S509.9
A
1671-9387(2015)10-0027-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150909.1541.010.html
