硫酸化发酵灵芝胞外多糖的组成与结构
2015-01-06刘昱均夏咏梅
张 珏, 沈 洁, 刘昱均, 夏咏梅
(1.江苏省原子医学研究所,卫生部核医学重点实验室,江苏 无锡214063;2.食品科学与技术国家重点实验室,江南大学,江苏 无锡214122)
硫酸化发酵灵芝胞外多糖的组成与结构
张 珏1,2, 沈 洁2, 刘昱均2, 夏咏梅2
(1.江苏省原子医学研究所,卫生部核医学重点实验室,江苏 无锡214063;2.食品科学与技术国家重点实验室,江南大学,江苏 无锡214122)
从灵芝深层发酵液中获得的灵芝胞外多糖,经硫酸化后其抑癌活性大幅提升。硫酸化后,灵芝胞外多糖的结构和构象都发生一定的变化。经单糖组成分析和光谱初步解析,硫酸化灵芝胞外多糖的单糖组成为鼠李糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖,其摩尔比为9∶3∶2∶4∶48;其主链可能是以α-D-Gal(1→6)为主或混杂有α-D-Gal,Rha,α-D-Glc,α-D-Man以及Ara为侧链,其硫酸基团可能接在C-3、C-4、C-6位上。硫酸化前灵芝多糖的构象主要为单螺旋结构,而修饰后呈三维螺旋结构,x-衍射亦证实其结构的有序变化。
灵芝;多糖;硫酸化;多糖硫酸酯;发酵
化学疗法、辐射疗法等在杀死肿瘤、癌细胞的同时,也带来极大的毒副作用。而肿瘤免疫疗法主要是通过刺激机体的免疫系统如淋巴系统等使机体免疫力得到恢复和提高,再由机体本身的抵抗力去杀死肿瘤细胞,毒副作用小。真菌多糖如灵芝多糖是一类免疫疗法的保健品[1-8],是毒副作用小、安全、疗效高的抗肿瘤免疫调节剂,在肿瘤免疫治疗方面有良好的应用前景,但往往活性不高。硫酸化修饰真菌多糖则是提升多糖抑癌作用的重要手段[2-9]。多糖抗肿瘤、提高机体免疫活性的功能与其分子组成、相对分子质量、溶解度、支化度、黏度等因素有关外,还与其立体构型密切相关;因此多糖经过硫酸化修饰后,其结构、相对分子质量、溶解度会有所变化,进而可能引起其生物活性的变化,甚至可以为多糖带来新的活性和功能。前期实验表明,从灵芝深层发酵液中获得的灵芝胞外多糖,经硫酸化后其抑癌活性大幅提升[10]。目前对子实体多糖或其硫酸化衍生物的结构研究较多[11-17],而子实体多糖本身因其产地不同而差异较大。发酵灵芝的胞内多糖与子实体多糖组成相对较为类似,但是其胞内外多糖的组成可控性远远超过子实体多糖,因而发酵灵芝多糖是定向生产灵芝多糖的有效途径。其中,发酵灵芝的胞外多糖活性相对较低,更有必要通过硫酸化而改善其生物活性;但目前对硫酸化发酵灵芝胞外多糖的结构组成还缺乏应有的认识。
1 材料与方法
1.1 材料
硫酸化发酵灵芝胞外多糖(GLPs):作者所在实验室自制;化学试剂:均为分析纯,购自中国医药集团上海化学试剂公司;透析袋(截流相对分子质量3 500):购自华美生物工程公司上海分公司。
1.2 仪器
紫外光谱仪:HitachiU-3000;红外光谱仪:ThermoNicoletNexus;核磁共振仪:BrukerARX400;X-衍射仪:BrukerD8AXS。
1.3 方法
1.3.1 硫酸化发酵灵芝胞外多糖(GLPs)的制备作者所在研究室保藏的灵芝菌种,30℃下150 r/min液体深层二级培养11 d,即得灵芝发酵液。将灵芝发酵液离心后取其上清液,适当浓缩后在4℃下用4倍体积醇沉,经脱蛋白后冻干则得到发酵灵芝胞外粗多糖。所得多糖用氨基磺酸-吡啶混合试剂进行硫酸化,反应至取代度不再上升后停止反应,经碳酸氢钠溶液中和、醇沉、乙醇洗涤和去离子水透析,冻干得到硫酸化灵芝胞外多糖。改变多糖与氨基磺酸的比例可以得到不同取代度的GLPs。然后,用DEAE纤维素柱(2.6 cm×30 cm)分离上述GLPs水溶液,以H2O和0.2、1.0、1.5 mol/L NaCl溶液进行梯度洗脱(洗脱速度48 mL/h,3 mL/管;上样量为4 mL)。将上述收集到的多糖组分透析,4℃下先用蒸馏水透析48 h,再用超纯水透析48 h,中途每8小时换水一次。然后减压浓缩,再以SephadexG75凝胶柱(2.6 cm×100 cm)进行分离,以H2O进行洗脱(流速36 mL/h,5 mL/管;上样量为10 mL)。最后冻干得到GLPs供分析用。
1.3.2 GLPs的单糖组分分析
1)多糖的水解:15 mg多糖溶液中加入2 mol/L的硫酸溶液2 mL,封管,120℃下水解5 h。用碳酸钠中和水液,过滤,冷冻干燥。蒸干后的残留物在60℃下真空干燥8 h,然后置干燥瓶中冷却备用。
2)多糖的衍生化:10 mg多糖的水解物或标准单糖经干燥后,置于10 mL反应管中,加10 mg盐酸羟胺和0.5 mg吡啶,在90℃水浴中反应30 min,取出冷却至室温,再加入0.5 mL醋酸酐,90℃水浴中继续反应30 min。将反应液减压蒸干,用0.5 mL重蒸氯仿提取,取氯仿层用于气相色谱分析。
3)气相色谱分析条件:Shimadzu,弹性石英毛细管柱 (0 V1701,30 m,I.D.0.32 mm,液膜厚度1.05 μm);程序升温,185℃保持3 min,3℃/min至240℃,维持25 min。汽化室温度260℃,FID检测温度260℃,载气压力(N2)0.6 MPa,氢气0.65 MPa,空气0.5 MPa,分流比30∶1。
4)相对分子质量测定:采用HPLC凝胶过滤法。Water 600 Controller,2410RefractiveIndex检测器,WatersUltrahydrogelTMLinear7.8 mm×300 mm柱;流动相为0.1 mol/L NaNO3;流速0.9 mL/min,进样量10 μL。
2 结果与讨论
2.1 硫酸化灵芝胞外多糖的分离及其主要组分的相对分子质量
灵芝多糖经硫酸化修饰后分子中含阴离子基团,而未修饰的多糖分子仍呈电中性,经过DEAE-纤维素阴离子交换柱后,因彼此的电性不同而被先后洗脱下来,洗脱结果见图1、表1。从图1可知,随着取代度的提高,水洗脱组分收率降低,盐组分收率增加,尤其是1.0 mol/L NaCl洗脱组分的收率大大提高,因而使得硫酸化后灵芝多糖的相对分子质量分布变窄,见图2。
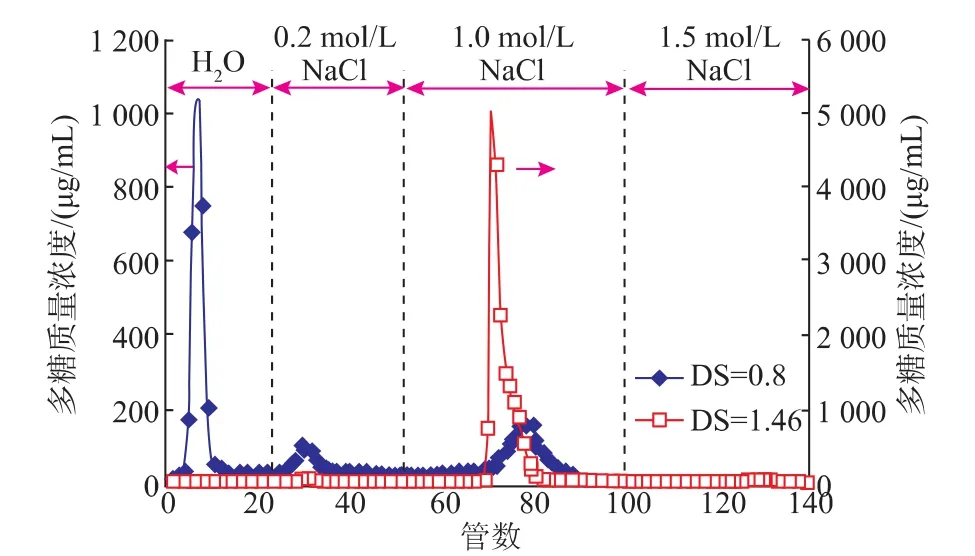
图1 硫酸化GLPs在DEAE上的洗脱曲线Fig.1 ElutioncurvesofsulfatedGLPsonDEAE-cellulosecolumneluted by H2O and saline
收集硫酸化灵芝胞外多糖1.0 mol/L NaCl洗脱组分,对其进行透析,浓缩。以SephadexG75凝胶柱对进行分离,水洗脱,隔管检测,有两个吸收峰,但以其中一个组分为主,收集其主要部分组分进行透析、浓缩、冷冻干燥以进行后续的结构分析。所得样品经琼脂糖电泳、HPLC分析见图2。结果表明,其组成相对分布较窄。由于采用的是碱性琼脂糖电泳系统和甲苯胺蓝显色剂,只有酸性多糖才能泳动和染色,由此可以说明,灵芝胞外多糖GLP已被硫酸酯化,HPLC凝胶过滤结果为单一峰。
采用凝胶排阻色谱法,以葡聚糖标准品作标准曲线(R2=0.999 2)。经测定发酵灵芝胞外多糖的相对分子质量为10 967,相对分子质量分布为16.56,GLPs的相对分子质量为18 944,相对分子质量分布为4.34。硫酸化后灵芝多糖的相对分子质量分布均变窄,发酵灵芝胞外多糖的相对分子质量也接近于子实体多糖[17]。
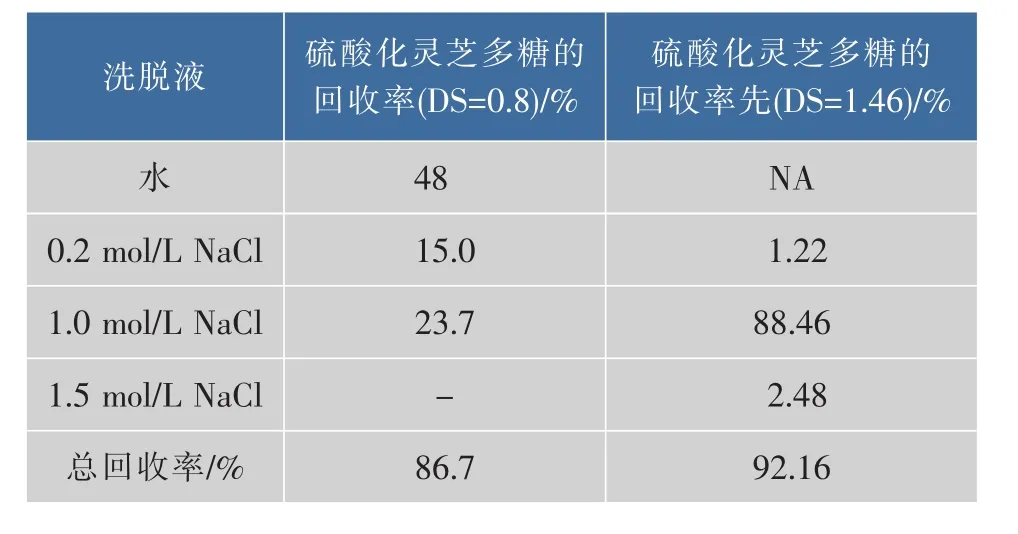
表1 硫酸化GLPs在DEAE上的分离结果Table 1 Separation results of sulfated GLPs on DEAE-cellulose
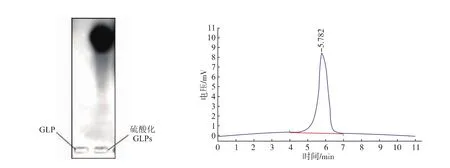
图2 GLP(左条带)与硫酸化GLPs(右条带)琼脂糖凝胶电泳图谱及硫酸化GLPsHPLC图Fig.2 Agaroseelectrophoresis of GLP(left lane)and sulfated GLPs(right lane)and HPLC profile of sulfated GLPs
2.2 硫酸化灵芝胞外多糖的结构分析
灵芝胞外多糖硫酸化后未出现新的紫外吸收(图3a),而红外光谱(图3b)表明,GLPs除了多糖母体特征吸收峰得以保留外,还增加了1 266 cm-1左右S=O的伸缩振动峰;C—O—S的拉伸振动多在810~830 cm-1,多糖母体832.57 cm-1为α-型差向异构体的C—H平伏键吸收峰(是α-D-甘露吡喃糖、半乳吡喃糖或α-D-葡萄吡喃糖的特征吸收峰),因而GLPs在832.37 cm-1的吸收峰变宽,比多糖母体832.57 cm-1的吸收峰略向低波数移动。同时,在3 600~3 200 cm-1之间为一组较宽的糖O—H的伸缩振动特征吸收峰,GLP的峰值偏近3 412 cm-1,说明分子间氢键数量较分子内氢键数量占优势;而经过硫酸酯化修饰后,GLPs在此处的羟基伸缩振动吸收峰偏向高波数并且峰形变窄,这是因为酯化后,SO的引入使得分子内氢键数量增加而分子间氢键相应减少,所以硫酸化后多糖水溶性得到改善。此外,2 938.58 cm-1和2 929.77 cm-1的亚甲基C-H伸缩振动峰为糖单元C6的特征吸收峰,酯化后其吸收峰减弱;因为C6位上的羟基空间位阻较小,所以一般硫酸酯化容易在C6发生。

图3 GLP与硫酸化GLPs紫外和红外图谱Fig.3 UV and IR Spectrum of GLP and sulfated GLPs
硫酸化灵芝胞外多糖GLPs的核磁共振碳谱见图4。由于多步分离,GLPs多糖分子链组成比硫酸化前相对简单。
糖链中未发生取代的C6通常位于δ60~64,若发生取代则通常移至 δ67~70;GLPs的13C谱在δ69.118左右出现信号,由此进一步推测硫酸基在C-6位发生了取代。通常糖链中未取代C-2、C-3和C-4的化学位移在δ70~77,取代后则共振位移至δ77~85。GLP在此区域无信号,说明糖链中可能以1-6链接为主;GLPs出现δ79.475的信号,因而在此三个位置中发生了硫酸基取代。由于在δ100区域,异头碳为一组峰,因而我们推测在C-3、C-4的可能性比较大。
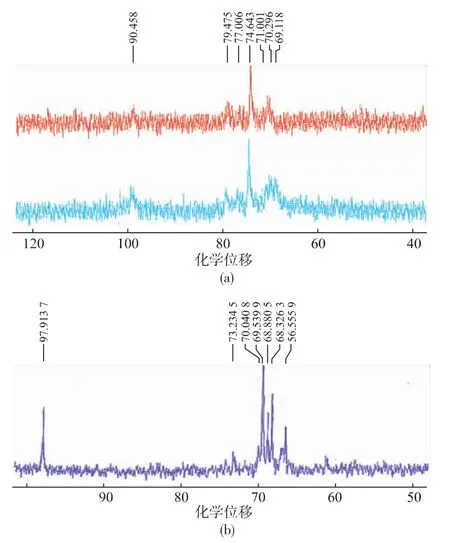
图4 GLPs(a)与硫酸化GLP(b)核磁共振碳谱Fig.413C NMR spectrum of sulfated GLPs(a)and GLP(b)
2.3 硫酸化灵芝胞外多糖单糖组成
硫酸化灵芝胞外多糖GLPs水解成单糖后的气相色谱见图5。GLPs由鼠李糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖组成,糖组成比较简单。经计算得出的单糖组成摩尔比为鼠李糖∶阿拉伯糖∶甘露糖∶葡萄糖∶半乳糖=9∶3∶2∶4∶48。
已有文献报道的灵芝多糖的单糖组成以葡萄糖为主,半乳糖虽然也是发现的主要单糖组成之一,但其含量一般不高[13,18-20]。本研究的发酵灵芝胞外多糖组成中半乳糖近半,糖链组成以半乳糖为主,这种多糖组成与作者所在实验室类似研究结果相近,且为作者所在实验室首次发现和报道[21]。这可能是由于灵芝菌有着强大的酶系且酶活力强,可以对纤维、糖类、蛋白质等多种物质加以利用并产生丰富的次生代谢产物,因此发酵过程的细微差异,如灵芝菌株的不同、培养基基质的不同、发酵条件等诸多因素,都会引起多糖产物代谢的不同响应。目前,有关高等真菌多糖合成代谢方面的信息知之甚少,对灵芝多糖的生物合成途径也是少有研究和报道,对于影响灵芝多糖种类和单糖构成的关键酶及这些多糖的单糖糖元的后期聚合途径仍然不了解,这些都需要今后进一步深入研究,以对灵芝多糖定向发酵调控提供借鉴。
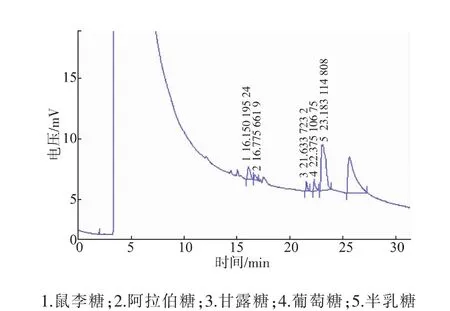
图5 硫酸化GLP水解产物气相色谱Fig.5 GC chromato graphy of hydrolyzed GLP sulfates
根据其单糖组成分析,结合红外光谱分析中多糖母体有832.57 cm-1的吸收峰,此为α-型差向异构体的C-H取平伏键的吸收峰,是α-D-甘露吡喃糖、α-D-半乳吡喃糖或α-D-葡萄吡喃糖的特征吸收峰[17],结合NMR谱的结果推测:灵芝多糖为杂多糖,其主链可能以α-D-Gal(1→6)为主或混杂有α-D-Gal,Rha,α-D-Glc,α-D-Man以及Ara为侧链,其硫酸酯中硫酸基团可能接在C-6、C-3、C-4位上。
2.4 硫酸化灵芝胞外多糖的构象分析
灵芝多糖硫酸化前后与刚果红形成的复合物在不同浓度的NaOH溶液中其最大吸收波长的变化见图6,未修饰的GLP的构象为单螺旋结构[21]。
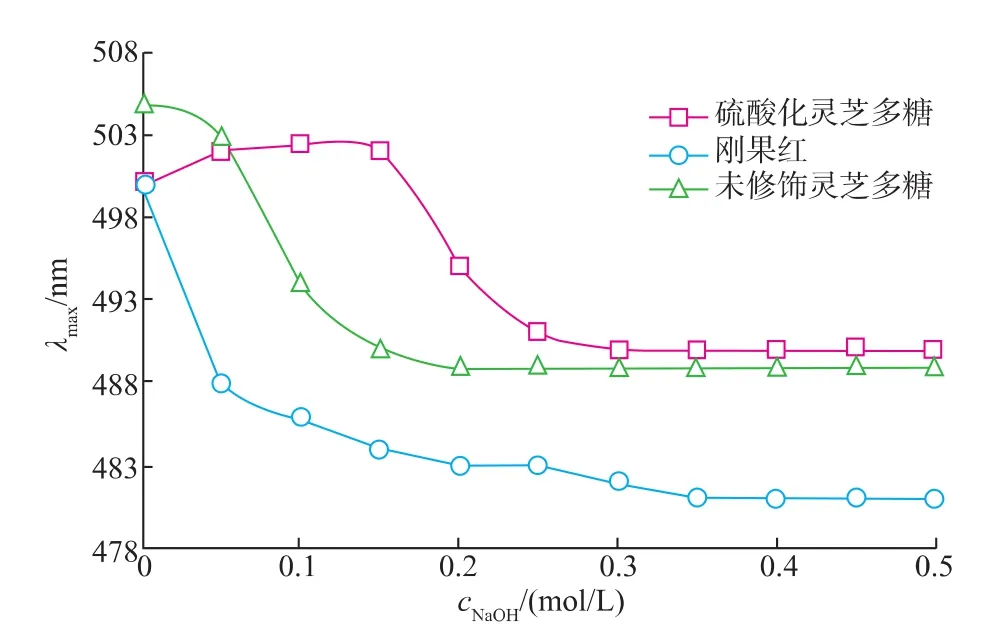
图6 硫酸化前后GLP与刚果红复合物λmax变化Fig.6 Changes in the absorption maximum (λmax)of the Congored-GLP/sulfated GLP complex
GLPs与刚果红形成的复合物的最大吸收波长(λmax)在NaOH浓度为0.05~0.15 mol/L时,λmax有一稳定区;当NaOH浓度大于0.25 mol/L后,λmax急剧下降到与GLP相同。以上结果表明,GLPs在中性至弱碱性范围内是一有序的多股螺旋,在中等碱性条件下(0.15~0.3 mol/L NaOH溶液)发生构象转变,在强碱性条件下则有序螺旋结构发生解体,x-衍射图见图7。可以看出,修饰前后灵芝胞外多糖的糖链分子由较为宽泛的松散无定形结构变为一定的有序结构。许多糖单位的羟基被—NH2、—SO3等基团后,糖环构象可能扭曲或转变并利于形成非共价键,而且带同性电荷基团间的相互排斥作用导致卷曲构象呈伸展和刚性状态[22-23]。当多糖环被硫酸基修饰,这些阴离子基团间的排斥作用使糖链链段伸长;而且部分硫酸基可能会和糖环上的羟基形成氢键,因而在糖链局部可能形成了螺旋结构,呈有活性的高级构象,且有序性增大。

图7 GLPX-衍射图Fig.7 X-ray diffraction of GLP and sulfated GLP
3 结语
目前多糖硫酸化修饰的研究多集中于子实体多糖[24],对发酵(灵芝)多糖硫酸化的报道相对较少;硫酸酯化的方法的报道多集中在氯磺酸-吡啶法[25]和三氧化硫-吡啶法[26]。前者反应活性大但副反应多,后者反应较温和,但试剂的价格过于昂贵;高取代度的硫酸酯化(灵芝)多糖获取难度大,一般均低于1.5[27-28],这也是有关硫酸化(灵芝)多糖的活性和取代度的对应关系报道仍然不多的原因之一;针对氨基磺酸为硫酸酯化试剂的多糖衍生化研究也不多见。作者对采用氨基磺酸法制备的不同取代度的硫酸化灵芝胞外多糖进行了分离纯化,并对发酵灵芝胞外多糖经修饰后其结构组成、硫酸基团引入后的结构及构象变化进行了研究。结果发现,随着多糖硫酸基取代度的提高,糖链分子电性增加,水洗脱的中性多糖回收率下降,盐洗脱组分的收率上升,其中1.0 mol/L NaCl次脱组分的回收率提高显著。红外光谱中亚甲基(—CH2—)的C—H伸缩振动峰减弱,说明硫酸酯化可能在C6发生取代。硫酸化灵芝胞外多糖单糖组成为鼠李糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖,比例为9∶3∶2∶4∶48;其主链可能是以α-D-Gal(1→6)为主或混杂有α-D-Gal,Rha,α-D-Glc,α-D-Man以及Ara为侧链,其硫酸基团可能接在C-6、C-3、C-4位上。比旋光度、构象、X-衍射分析结果表明,经硫酸化后,灵芝胞外多糖的一级结构和高级结构都发生一定变化,修饰前其构象为单螺旋结构,修饰后呈三维螺旋结构,由此引起其抗肿瘤活性的增加[10]。
[1]Saltarelli R,Ceccaroli P,Iotti M,et al.Biochemical characterization and antioxidant activity of mycelium of Ganoderma lucidum from central italy[J].Food Chemistry,2009,116(1):143-151.
[2]Bussing A,Hubner J.Asiatische Heilpilze[J].Der Onkologe,2009,15(5):519-525.
[3]Sadava D,Still D W,Mudry R R,et al.Effect of Ganoderma on drug-sensitive and multidrug-resistant small-cell lung carcinoma cells[J].Cancer Letters,2009,277(2):182-189.
[4]Liu Y W,Gao J L,Guan J,et al.Evaluation of antiproliferative activities and action mechanisms of extracts from two species of Ganoderma on tumor cell lines[J].Journal of Agricultural and Food Chemistry,2009,57(8):3087-3093.
[5]Liu J,Shiono J,Shimizu K,et al.Ganoderic acid DM:anti-androgenic osteoclastogenesis inhibitor[J].Bioorganic&Medicinal Chemistry Letters,2009,19(8):2154-2157.
[6]Chiu J,Yau T,Epstein R.Complications of traditional Chinese/herbal medicines(TCM)-a guide for perplexed oncologists and other cancer caregiver[J].Supportive Carein Cancer,2009,17(3):231-240.
[7]Harhaji L,Mijatovic S,Maksimov-Ivanic D,et al.Anti-tumor effect of coriolusversicolor methanol extract against mouse B16 melanoma cells:in vitro and in vivo study[J].Foodand Chemical Toxicology,2008,46(5):1825-1833.
[8]Rubel R,Santa H S D,Fernandes L C,et al.High immunomodulatory and preventive effects againstsarcoma 180 in mice fed with Ling Zhi or Reishi mushroom Ganoderma lucidum(W.Curt.:Fr.)P.Karst.(Aphyllophoro mycetideae)mycelium[J].International Journal of Medicinal Mushrooms,2008,10(1):37-48.
[9]Ye L B,Zhang J S,Zhou S A,et al.Preparation of a novel sulfated glycopeptide complex and inhibiting L1210 cell lines property in vitro[J].Carbohydrate Polymers,2009,77(2):276-279.
[10]Zhang J,Liu Y J,Park H S,et al.Antitumor activity of sulfated extracellular polysaccharides of Ganoderma lucidum from the submerged fermentation broth[J].Carbohydrate Polymers,2012,87(2):1539-1544.
[11]Zhou Z Y,Tang Y P,Xiang J,et al.Neuroprotective effects of water-soluble Ganoderma lucidum polysaccharides on cerebral ischemic injury in rats[J].Journal of Ethnopharmacology,2010,131(1):154-164.
[12]Liu W,Wang H Y,Yao W B,et al.Effects of sulfation on the physicochemical and functional properties of a water-insoluble polysaccharide preparation from Ganoderma lucidum[J].Journal of Agricultural and Food Chemistry,2010,58(6):3336-3341.
[13]He J Z,Shao P,Ni H D,et al.Study on the structure and constituents of polysaccharide from Ganoderma lucidum[J]. Spectroscopy and Spectral Analysis,2010,30(1):123-127.
[14]Feng Y L,Li W Q,Wu X Q,et al.Rapid and efficient microwave-assisted sulfate modification of lentinan and its antioxidant and antiproliferative activities in vitro[J].Carbohydrate Polymers,2010,82(3):605-612.
[15]Chen X Y,Zhang L N,Cheung P C K.Immunopotentiation and anti-tumor activity of carboxymethylated-sulfated beta-(11→3)-d-glucan from Poriacocos[J].International Immunopharmacology,2010,10(4):398-405.
[16]Wang J G,Zhang L N,Yu Y H,et al.Enhancement of antitumor activities in sulfated and carboxymethylated polysaccharides of Ganoderma lucidum[J].Journal of Agricultural and Food Chemistry,2009,57(22):10565-10572.
[17]张惟杰.糖复合物生化研究技术(第二版)[M].杭州:浙江大学出版社,1994.
[18]孙冬平,潘锋,史小丽,等.灵芝菌发酵培养基的优化及灵芝胞外多糖的分离[J].中草药,2000,12(31):941-943.
SUN Dongping,PAN Feng,SHI Xiaoli,et al.Selection of optimal medium and extraction and purification of Ganoderma lucidum extracellular polysaccharide[J].Chinese Traditional and Herbal Drugs,2000,12(31):941-943.(in Chinese)
[19]黄静涵,艾斯卡尔·艾拉提,毛健.灵芝多糖的分离纯化及结构鉴定[J].食品科学,2011,32(12):301-304.
HUANG Jinghan,Aisikaer-Ailati,MAO Jian.Purification and structural characterization of polysaccharides of Ganoderma lucidum[J].Food Science,2011,32(12):301-304.(in Chinese)
[20]赵桂梅,张丽霞,于庭敏,等.灵芝孢子粉水溶性多糖分离、纯化及结构分析[J].天然产物研究与开发,2005,17(2):182-185.
ZHAO Guimei,ZHANG Lixia,YU Tingmin,et al.Chemical study on the water soluble polysaccharide from spores of Ganoderma lucidum[J].Natural Product Research and Development,2005,17(2):182-185.(in Chinese)
[21]Li Y Q.Study on the fermentation of traditional Chinese medicines by ganodermalucidum and anti-Hepatitis B effects of the fermentation products[J].Doctoral dissertation of Jiangnan University,2004.
[22]Yamamoto I,Takayama K,Honma K,et al.Synthesis,structure and antiviral activity of cellulose and its branched derivatives[J]. Carbohydrate Polymers,1991,14(1):53-63.
[23]Xu S Q,Xu X J,Zhang L N,et al.Branching structure and chain conformation of water-soluble glucan extracted from Auriculariaauricula-judae[J].Journal of Agricultural and Food Chemistry,2012,60(13):3498-3506.
[24]黄小燕,孔祥峰,王德云.多糖硫酸化修饰和多糖硫酸酯的研究进展[J].天然产物研究与开发,2007,19(2):328-332.
HUANG Xiaoyan,KONG Xiangfeng,WANG Deyun.Research progress on sulfating modification of polysaccharides and sulfated polysaccharides[J].Natural Product Research and Development,2007,19(2):328-332.(in Chinese)
[25]Alban S,Schauerte A,Franz G.Anticoagulant sulfatedpolysaccharides:Part I.Synthesis and structure-activity relationships of new pullulan sulfates[J].Carbohydrate Polymers,2002,47:267-276.
[26]Wu S J,Chun M W,Shin,K H,et al.Chemical sulfonation and anticoagulant activity ofacharan sulfate[J].Thrombosis Research,1998,92:273-281.
[27]Zhu Z Y,Liu Y,Si C L,et al.Sulfated modification of the polysaccharide from Cordyceps gunnii mycelia and its biological activities[J].Carbohydrate Polymers,2013,92(1):872-876.
[28]Wei D F,Wei Y X,Cheng W D,et al.Sulfated modification,characterization and antitumor activities of Radix hedysari polysaccharide[J].International Journalof Biology Macromolecule,2012,51(4):471-476.
Constituents and Structures of Sulfated Extracellular Polysaccharides from Ganoderma lucidum Fermentation Broth
ZHANG Jue1,2, SHEN Jie2, LIU Yujun2, XIA Yongmei2
(1.Key Laboratory of Nuclear Medicine of Ministry of Health,Jiangsu Institute of Nuclear Medicine,Wuxi 214063,China;2.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
The sulfation of extracellular polysaccharides of Ganoderma lucidum (GLP)from the submerged fermentation broth can dramatically enhance their antitumor activity.The structure and conformation of GLP might change due to the sulfation.The structure of the sulfated GLP was analysized with glycosyl residual composition analysis,IR,UV and NMR.The polysaccharide consists of rhamnose,arabinose,mannose,glucose and galactose with a molar ratio of 9∶3∶2∶4∶48.The main chain of the polysaccharide may consist of the unit of α-D-Glc(1→6)or the side chain is mixed of α-D-Glc,Rha,α-D-Man,and Ara.The sulfate groups may be connected to C-3,C-4,and C-6 of the sugar unit.Meanwhile,the sulfated polysaccharides present very different conformation comparing to the native polysaccharides.The sulfated polysaccharides possessed a triple helix whereas the native polysaccharide preferred the single helical,which was also confirmed by x-ray diffraction.
Ganoderm lucidum,polysaccharide,sulfation,polysaccharide sulfate,fermentation
O 657.3
A
1673—1689(2015)05—0547—07
2014-03-19
食品科学与技术国家重点实验室自由探索基金资助项目(SKLF-ZZB-201504)。
张 珏(1969—),女,上海人,工学博士,副研究员,主要从事天然产物活性和免疫学方面的研究。E-mail:zhangjue@jsinm.org
