机械活化酿酒酵母葡聚糖改善其水溶性
2015-01-06石纪奎李永富
石纪奎, 李永富, 史 锋*
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡214122)
机械活化酿酒酵母葡聚糖改善其水溶性
石纪奎1, 李永富2, 史 锋1*
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡214122)
酿酒酵母葡聚糖是一种良好的免疫效应应答剂,但是不溶于水,这严重影响了它在食品、医药等行业中的应用。对酿酒酵母葡聚糖进行机械改性,显著提高了它的溶解性。随着机械强度和活化时间的增加,葡聚糖的溶解率从11%提高到37%。活化之后的葡聚糖的粒径明显变小,比表面积增大;微观形态结构规整性降低,表面呈现粗糙状。红外光谱分析证实,活化之后葡聚糖的主体化学结构没有改变,但羟基吸收峰位置向低频方向发生较大偏移,氢键键能降低,氢键相互作用减弱。这些变化有利于葡聚糖分子与水分子相互作用,提高酵母葡聚糖的溶解性。由此制备的水溶性葡聚糖具有良好的免疫活性,可以显著刺激巨噬细胞产生TNF-α、IL-6、NO,它们的分泌量分别是阴性对照组的29.3、28.3、5.6倍。因此机械活化是一种提高酿酒酵母葡聚糖溶解性的高效、简便、环保方法。
酿酒酵母葡聚糖;机械活化;水溶性
酿酒酵母是啤酒行业的主要微生物,每年因酿酒会产生大量的废弃酿酒酵母。酿酒酵母细胞壁含有丰富的多糖,其中40%-60%是β-D-葡聚糖[1]。研究表明,酿酒酵母葡聚糖是一种良好的生物效应应答剂,具有增强免疫力、激活免疫细胞、抗肿瘤、抗感染、抗氧化等功能[2]。但是酿酒酵母葡聚糖通过分子间氢键相互作用,形成致密的螺旋结构,致使葡聚糖分子难以溶于水,这严重影响了酿酒酵母葡聚糖在食品、保健品、医药等领域上的应用[3]。为了提高酿酒酵母葡聚糖的水溶性,国内外学者对其进行了修饰和改性研究,主要方法包括化学方法和物理方法。化学修饰方法主要是通过在葡聚糖分子上引入亲水性基团而增加其水溶性,主要的修饰方法有硫酸化、羧甲基化、磷酸化修饰[4]。但是这类修饰通常在有机相体系以及强酸、强碱中进行,不仅成本高、污染严重,而且葡聚糖的损失严重。物理方法主要是通过超声波解聚,来降低葡聚糖的相对分子质量,从而增加其水溶性,但是超声解聚只能降低葡聚糖的相对分子质量到一个极限恒定值,促进葡聚糖溶解的效果不佳[5]。因此急需一种环保、简单、高效的方法促进酿酒酵母葡聚糖的水溶性。
机械活化主要通过机械力的摩擦、剪切、冲击等作用,使固体颗粒物质的结构及物化性能发生改变,将部分机械能转化为物质内能,从而增加固体颗粒物质的化学活性。许多研究表明,机械活化可以显著改变多糖的结晶结构、相对分子质量分布、分子链排列,从而提高多糖的化学反应和酶解反应活性[6-8]。通过机械活化对多糖进行改性,具有简单、方便、无污染、成本低的优点。作者利用一种行星球磨机活化酿酒酵母葡聚糖,以葡聚糖在水中的溶解率为评价指标,考察了机械力强度和作用时间对葡聚糖水溶性的影响。利用粒度分析仪、扫描电子显微镜和红外光谱分析仪表征了机械活化前后酿酒酵母葡聚糖微观形态和化学结构的变化,探讨机械活化提高葡聚糖水溶性的原因。最后分析了水溶性的酿酒酵母葡聚糖对小鼠巨噬细胞RAW264.7分泌肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和NO的刺激作用,了解其免疫性能。
1 材料与方法
1.1 材料与设备
酿酒酵母葡聚糖:上海杰康诺生物技术有限公司;小鼠巨噬细胞RAW264.7:浙江大学生命科学学院;脂多糖(LPS):美国Sigma公司;葡萄糖、蒽酮、溴化钾、亚硝酸钠、磺胺、N-(1-萘基)乙二胺二盐酸盐:国药集团化学试剂有限公司,分析纯。TNF-α、IL-6检测试剂盒:美国eBioscience公司;DMEM完全培养基、0.25%胰酶:美国Gbico公司;胎牛血清(FBS):浙江杭州四季青生物工程材料有限公司。
XXM行星球磨机:浙江嘉兴中俄科技转化中心;L-535R离心机:湖南长沙湘仪离心机仪器有限公司;Freezone冷冻干燥机:美国LABCONCO公司;S3500激光粒度分析仪:美国 Microtrac公司;NEXUS傅里叶红外光谱分析仪:美国Nicolet公司;Quanta 200扫描电子显微镜:荷兰FEI公司;Series 8000WJ二氧化碳培养箱:美国Thermo Scientific公司;ELX800酶标仪:美国BioTek公司。
1.2 实验方法
1.2.1 酵母葡聚糖的机械活化处理将15 g酿酒酵母葡聚糖与150 g直径为3 mm的磨球混匀后,一起放入行星球磨罐内。调节电机转速和运转时间,得到不同的酿酒酵母葡聚糖处理样品。用30目不锈钢筛将磨球和葡聚糖分离,活化的葡聚糖密封保存,及时分析。
1.2.2溶解率的测定及水溶性酿酒酵母葡聚糖的制备取0.5 g活化的酿酒酵母葡聚糖样品,加入20 mL去离子水,搅拌30 min促进溶解,之后4 000 r/min离心20 min。收集上清液定容至25 mL,利用蒽酮法测定上清液中总糖的含量。

将上述酿酒酵母葡聚糖的上清液经冷冻干燥得到固体水溶性酿酒酵母葡聚糖样品。
1.2.3 粒度分布分析利用S3500激光粒度分析仪测定活化前后酿酒酵母葡聚糖的粒度分布。
1.2.4 红外光谱分析将样品与KBr按1∶50的比例混合研磨制成薄片,利用NEXUS傅里叶红外光谱分析仪进行扫描测试,范围为4 000~400 cm-1。
1.2.5 扫描电镜分析利用Quanta 200扫描电子显微镜分析活化前后酿酒酵母葡聚糖的微观形态。
1.2.6 水溶性酿酒酵母葡聚糖的免疫活性分析取小鼠巨噬细胞系RAW264.7,用DMEM完全培养液 (添加10%FBS,100 U/mL青霉素和100 μg/mL链霉素)在37℃、5%CO2条件下培养,48 h之后用0.25%胰酶消化细胞,离心后收集细胞计数备用。
调整细胞浓度至5×105个/mL,接种于96孔板中,于37℃、5%CO2下培养12 h,加入水溶性酿酒酵母葡聚糖,至终质量浓度分别为50、100、500 μg/mL,以10、100、1 000 ng/mL LPS为阳性对照,以培养基为阴性对照。继续培养24 h之后取上清液,利用ELISA检测试剂盒测定其中的细胞因子TNF-α、IL-6含量;继续培养48 h之后取上清液,按照文献[9]测定NO含量。使用SPSS软件处理数据,所有数据均以平均值±标准差表示,同时检验实验组和对照组之间的差异性,*P<0.05表示显著差异,**P<0.01表示极显著差异。
2 结果与分析
2.1 酿酒酵母葡聚糖的溶解率
通过调节行星球磨机的电机转速,改变机械力的输出强度,考察了球磨机转速和作用时间对活化的酿酒酵母葡聚糖在水中溶解率的影响,结果见图1。
当行星球磨机的转速在837 r/min时,随着球磨时间由0 min增加到20 min,葡聚糖的溶解率从11%逐渐增加到30%。同时当转速调整为1 116 r/min时,葡聚糖的溶解率从11%增加到37%。考虑到实验操作的安全性以及样品的损失率,最终将转速确定为1 116 r/min,时间定为20 min,以此对酿酒酵母葡聚糖进行机械活化,以制备水溶性的葡聚糖。由此可知,在强烈的摩擦、剪切、挤压、冲击等机械力的作用下,酿酒酵母葡聚糖的溶解率显著增加。为了了解机械活化提高酿酒酵母葡聚糖水溶性的原因,对活化前后的葡聚糖进行粒度分布分析、微观形态结构分析和化学结构分析。

图1 不同活化条件下酿酒酵母葡聚糖的溶解率Fig.1 Water-solubility of Saccharomyces cerevisiae β-D-glucan after mechanical activation
2.2 酿酒酵母葡聚糖的粒度分布
酿酒酵母葡聚糖机械活化前后的粒度分布见图2。未经过活化的酿酒酵母葡聚糖颗粒粒度集中在40~100 μm,并且分布狭窄(图2a)。经过1 116 r/min机械活化20 min之后,酿酒酵母葡聚糖的粒度明显变小,集中在0.5~10 μm(图2b)。这说明酿酒酵母葡聚糖颗粒在机械活化过程中,受到了剪切力、挤压力、摩擦力、冲击力等机械力的作用,强烈的机械力作用破坏了葡聚糖分子的致密结构,致使葡聚糖颗粒的粒度变小。而葡聚糖颗粒粒度的降低和比表面积增加,有利于水分子与葡聚糖分子相互作用,增加活化之后葡聚糖的水溶性。

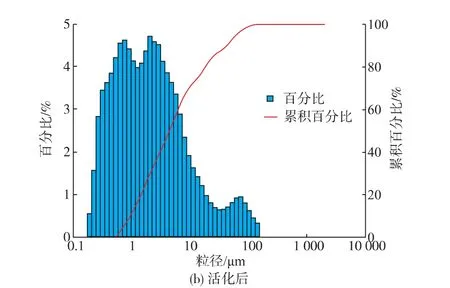
图2 机械活化前后酿酒酵母葡聚糖粒度分布Fig.2 Particle size distribution of Saccharomyces cerevisiae β -D-glucan before and after mechanical activation
2.3 酿酒酵母葡聚糖的微观形态
采用扫描电子显微镜分析活化前后酿酒酵母葡聚糖的微观形态,结果见图3。表明经过机械活化之后的酿酒酵母葡聚糖颗粒微观形态发生了明显的变化。未经活化的酿酒酵母葡聚糖颗粒呈现出干瘪的小球状,颗粒的表面比较光滑,经过机械活化之后的酵母葡聚糖颗粒显著变小,颗粒变得杂乱无章,表面变得粗糙,呈现无规则状。说明机械活化可以破坏酵母葡聚糖的高级结构,增大比表面积,从而有利于水分子与酵母葡聚糖相互作用,增强酿酒酵母葡聚糖的水溶性。

图3 机械活化前后酿酒酵母葡聚糖的扫描电镜图Fig.3 SEM of Saccharomyces cerevisiae β-D-glucan before and after mechanical activation
2.4 酿酒酵母葡聚糖红外光谱
红外光谱分析方法是多糖研究中检测化学结构常用的方法。图4是活化前后酿酒酵母葡聚糖的红外光谱图。3 430 cm-1是多糖的-OH吸收峰,2 923 cm-1和1 422 cm-1是多糖中C—H键的吸收峰。比较活化前后葡聚糖红外图谱,没有出现新的红外吸收峰,说明活化过程中酿酒酵母葡聚糖始终保持原有的基本化学结构。但羟基吸收峰的位置向低波长移动,根据公式ΔE=hc(v1-v2)(其中ΔE为氢键能量变化,h为普朗克常数,c为光速,v1、v2分别为机械活化前后羟基的伸缩振动峰波数)可计算出与羟基相关的氢键平均键能变化[10]。在1 116 r/min活化20 min后,酿酒酵母葡聚糖羟基氢键能量降低了5.52×10-3eV,表明经过机械活化处理降低了氢键键能,减弱葡聚糖分子氢键的相互作用,有利于水分子进入到葡聚糖颗粒内部,从而提高葡聚糖的水溶性。
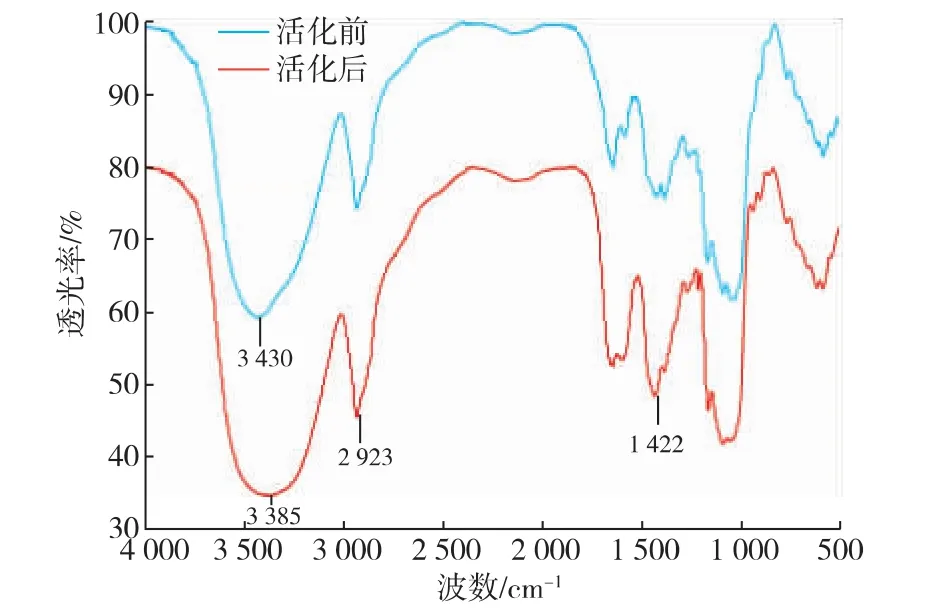
图4 机械活化前后酿酒酵母葡聚糖的红外光谱图Fig.4 FTIR of Saccharomyces cerevisiae β-D-glucan before and after mechanical activation
2.5 水溶性酿酒酵母葡聚糖的免疫活性
巨噬细胞在人的免疫系统中发挥着重要的作用。巨噬细胞可以分泌TNF-α、IL-6、NO等来介导、调节免疫反应和炎症反应。因此作者利用巨噬细胞RAW 264.7探讨机械活化后形成的水溶性酿酒酵母葡聚糖(SG)对巨噬细胞产生TNF-α、IL-6、NO量的变化。水溶性酿酒酵母葡聚糖是将酿酒酵母葡聚糖经过1 116 r/min机械活化20 min之后,离心取上清液,最后经冷冻干燥制备而得。
2.5.1 水溶性葡聚糖对巨噬细胞分泌NO的刺激作用图5显示了在水溶性葡聚糖刺激24 h之后,巨噬细胞RAW 264.7产生的NO含量。随着葡聚糖质量浓度的提高,NO含量随之增加,呈现浓度依懒性。当G40-20质量浓度为500 μg/mL时,产生的NO浓度达到36.5 μmol/mL,而阴性对照组仅为6.5 μmol/mL。实验组与对照组相比表现出极显著的差异,说明水溶性葡聚糖可以极显著的刺激巨噬细胞产生NO。

图5 巨噬细胞分泌的NO浓度Fig.5 Amount of NO secreted by macrophage
2.5.2 水溶性葡聚糖对巨噬细胞分泌TNF-α和IL-6的刺激作用利用ELISA检测试剂盒测定了经水溶性葡聚糖刺激后巨噬细胞分泌的细胞因子含量,结果见图6-7。经水溶性葡聚糖刺激24 h之后,巨噬细胞RAW 264.7分泌细胞因子TNF-α和IL-6的质量浓度极显著提高。水溶性葡聚糖在低质量浓度下已经呈现出良好的刺激作用,质量浓度越高刺激作用越明显。当SG质量浓度为500 μg/mL时,巨噬细胞分泌TNF-α和IL-6的量分别达到142.22 ng/mL和1.70 ng/mL,而阴性对照组仅为4.85 ng/mL和0.06 ng/mL。这说明水溶性的葡聚糖可以极显著性的刺激巨噬细胞分泌TNF-α和IL-6。
3 结语
酿酒酵母葡聚糖是酿酒酵母细胞壁重要的组成成分,具有良好的免疫应答调节作用,但由于其特殊的化学结构而不溶于水。作者在固相状态下利用一种行星球磨机活化酿酒酵母葡聚糖,以提高其溶解性。经过机械活化之后酿酒酵母葡聚糖在水中的溶解率明显提高,最高达到37%。进一步研究发现,活化的酿酒酵母葡聚糖颗粒粒度显著降低;利用扫描电镜观察颗粒的微观形态结构的变化,发现酿酒酵母葡聚糖颗粒在机械力的作用下,微观形态发生了明显的变化,颗粒细化,表面粗糙不规整。红外光谱分析发现活化的酵母葡聚糖的基本化学结构没有发生变化,但是氢键键能降低,葡聚糖氢键相互作用减弱。表明经过机械活化之后,酿酒酵母葡聚糖的结构发生了明显的变化,致密的螺旋结构受到一定的破坏,这些结构的变化有助于葡聚糖分子与水分子进一步相互作用,增加酿酒酵母葡聚糖的溶解性。通过检测小鼠巨噬细胞RAW 264.7受水溶性葡聚糖刺激之后产生TNF-α、IL-6以及NO的质量浓度变化,表明水溶性酿酒酵母葡聚糖可以极显著地刺激巨噬细胞分泌细胞因子TNF-α、IL-6以及NO,这说明通过机械活化制备的水溶性葡聚糖具有良好的免疫活性。因此机械活化是一种简单、高效、绿色环保的酿酒酵母葡聚糖的改性方法。
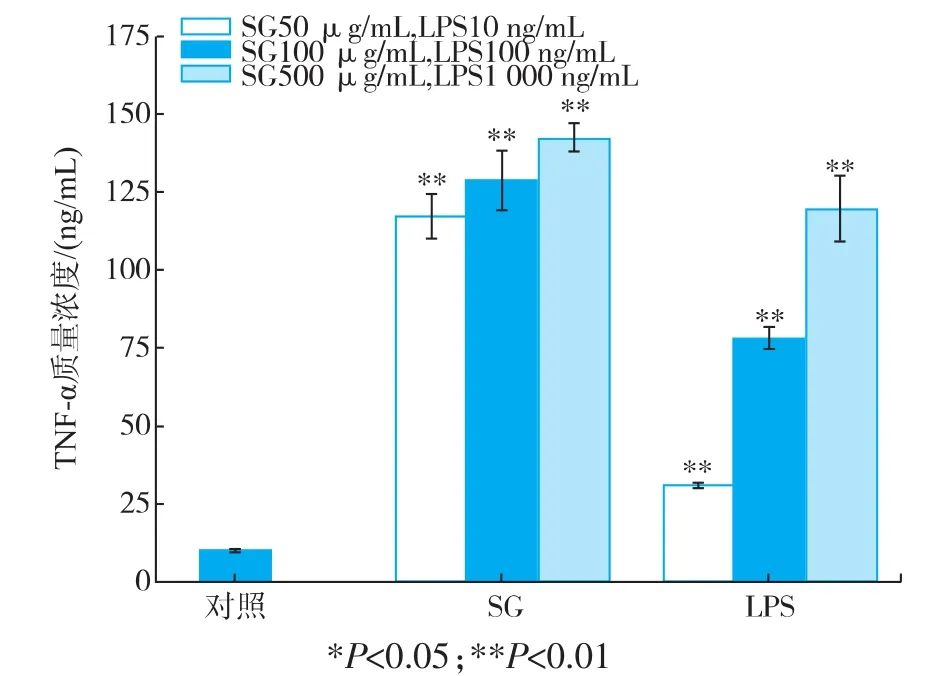
图6 巨噬细胞分泌TNF-α的质量浓度Fig.6 Amount of TNF-α secreted by macrophage

图7 巨噬细胞产生IL-6的质量浓度Fig.7 Amount of IL-6 secreted by macrophage
参考文献:
[1]Aimanianda V,Clavaud C,Simenel C,Fontaine T,et al.Cell wall β-(1,6)-glucan of Saccharomyces cerevisiae:structural characterization and in situ synthesis[J].Journal of Biological Chemistry,2009,20(284):13401-13412.
[2]Kim H S,Hong J T,Han S B,et al.Stimulatory effect of β-glucans on immune cells[J].Immune Network,2001,11(4):191-195.
[3]杨天骄,孙英峰,王英珍,等.啤酒酵母葡聚糖免疫调节作用及应用研究进展[J].动物医学进展,2008,29(11):92-95.
YANG Tianjiao,SUN Yingfeng,WANG Yingzhen,et al.Progress on immunological modulatory functions and applying prospects of glucan from beer yeast[J].Progress in Veterinary Medicine,2008,29(11):92-95.(in Chinese)
[4]Ding J,Wang Y,Xiong,S,et al.Optimised methodology for carboxymethylation of(1-3)-β-D-glucan from yeast(Saccharomyces cerevisiae)andpromotion of mechanical activation[J].International Journal of Food Science and Technology,2013,2(48):253-259.
[5]Tabata K,Ito W,Kojima T,et al.Ultrosonic degradation of schizophyllan,an antitumor polysaccharide produced by Schizophyllan communefries[J].Carbohydrate Research,1981,89(1):121-135.
[6]Diop C I K,Li H L,Xie B J,Shi J,et al.Combinatorial effects of mechanical activation and chemical stimulation on the microwave assisted acetylation of corn(Zea mays)starch[J].Starch-Starke,2011,63(2):96-105.
[7]Zhang Y,Huang Z,Yang C,et al.Material properties of partially pregelatinized cassava starch prepared by mechanical activation [J].Starch-Starke,2013,65(5-6):461-468.
[8]Huang Z,Lu J,Li X,et al.Effect of mechanical activation on physico-chemical properties and structure of cassava starch[J]. Carbohydrate Polymers,2007,68(1):128-135.
[9]Jiang Z,Okimura T,Yamaguchi K,et al.The potent activity of sulfated polysaccharide,ascophyllan,isolated from Ascophyllum nodosum to induce nitric oxide and cytokine production from mouse macrophage RAW264.7 cells:comparison between ascophyllan and fucoidan[J].Nitric Oxide,2011,4(25):407-415.
[10]Liao Z,Huang Z,Hu H,et al.Microscopic structure and properties changes of cassava stillage residue pretreated by mechanical activation[J].Bioresource Technology,2011,102(17):7953-7955.
Improve Water-Solubility of β-D-Glucan from Saccharomyces cerevisiae by Mechanical Activation
SHI Jikui1, LI Yongfu2, SHI Feng1*
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.National Engineering Laboratory for Cereal Fermention Technology,Jiangnan University,Wuxi 214122,China)
The β-D-glucan from Saccharomyces cerevisiae is a potent biological response modifier. But it is insoluble in water.This is the major obstacle for its application in the food and medical fields.In order to improve the water-solubility of β-D-glucan from S.cerevisiae,mechanical activation was performed here in the solid state by using a planetary ball miller.The water-solubility of β-D-glucan increased sharply from 11%to 37%,as the mechanical force and activation time increased.After mechanical activation,the particle size of β-D-glucan decreased obviously and its morphological structure became to be irregular and rough.The basic chemical structure of β-D-glucan was not destroyed based on FTIR analysis,but the energy of hydrogen bond decreased.These changes would be benefit for β-D-glucan to interact with water molecule and therefore to increase its solubility.Most importantly,the soluble β-D-glucan prepared by this method could significantly stimulate the macrophage cells to secrete TNF-α,IL-6 and NO.Their concentrations were 29.3-,28.3-and 5.6-folds that of the controls,respectively.These results indicate that mechanical activation is a simple,environmentally friendly and efficient method to improve water-solubility of β-D-glucan.
β-D-glucan from Saccharomyces cerevisiae,mechanical activation,water-solubility
TS 261.9
A
1673—1689(2015)05—0536—06
2014-02-11
江苏省科技支撑计划项目(BE2012428)。
*通信作者:史 峰(1970—),女,新疆乌鲁木齐人,工学博士,副教授,硕士研究生导师,主要从事微生物代谢工程方面的研究。
E-mail:shifeng@jiangnan.edu.cn
