植物染色体制片效果影响因素的解析
2015-01-06吴益梅辜金花田玉肖
刘 丹,夏 雪,吴益梅,辜金花,田玉肖,孙 勃
(四川农业大学园艺学院,四川雅安 625014)
植物染色体制片效果影响因素的解析
刘 丹,夏 雪,吴益梅,辜金花,田玉肖,孙 勃*
(四川农业大学园艺学院,四川雅安 625014)
高质量的染色体制片是后续研究工作的基础,在实际操作中要获得理想的制片并不容易。本文综述取材时间与根尖长度、预处理、解离、染液的选择和制片方法等5项压片法中影响植物染色体制片效果的主要因素,其中预处理为关键环节。
植物;染色体;制片;影响因素;压片法
植物染色体制片技术是遗传学经典实验之一,也是从事细胞学研究的一项基本实验技能。该项技术是进行染色体计数、核型分析和原位杂交等研究的基础,广泛地应用于植物倍性鉴定、植物分类与亲缘关系研究,在植物遗传育种中具有重要作用[1]。高质量的染色体制片是保证核型分析和原位杂交等后续工作顺利进行的首要条件[2]。一张好的制片,首先应具有较多的分裂相,特别是中期分裂相;其次应具有较好的制片效果,具体表现为染色体分散性好,收缩适中,形态良好,着丝粒清晰可见等。
常用的染色体制片方法包括压片法和去壁低渗法[2],与去壁低渗法相比,压片法步骤较少,操作简便,时间快速,节省材料,容易掌握,效果也较好,在植物特别是农作物和园艺作物的染色体制片中被广泛使用[3-7];而去壁低渗法则多用于动物和染色体数目多而小的植物中。压片法的基本步骤包括取材、预处理、固定、保存、解离、染色制片和镜检观察。虽然压片法制备染色体技术并不复杂,但在实际操作中要获得理想的制片并不容易,主要原因是不同物种最优的处理条件往往存在明显差异。近年来关于各类植物染色体制片的报道已有很多(表1),但对影响制片效果因素的系统探讨与分析却鲜有报道。结合已有文献和作者的研究结果,本文将着重解析压片法中影响植物染色体制片效果的各项关键因素,以期为植物染色体制片提供参考。
1 取材时间与根尖长度
高等植物有丝分裂主要发生在根尖、茎尖生长点和幼叶等的分生组织,理论上所有发生有丝分裂的组织、愈伤组织和细胞悬浮液等均可用于染色体的制备,但实际操作中染色体制片常用根尖作为材料,通常只有根尖不易获得时才会选取茎尖或幼叶等组织。其主要原因如下,根尖的分生组织有丝分裂旺盛且细胞壁薄,如葡萄根尖有丝分裂中期的细胞数目显著高于卷须、茎尖和幼叶组织[8-16];与茎尖等其他分生组织相比,根尖取材容易,操作和鉴定简便;在实验室内可在可控环境条件下采用种子萌发的形式获得大量的新鲜幼嫩根尖,不受生长季节和外界环境的影响和限制;对于一些稀少珍贵的材料,取用根尖对材料的伤害要远远小于取用茎尖等组织;另外,绝大多数的植物在剪取根尖后仍可继续正常生长,并不断萌发新根,因此不会影响后续研究[1]。
制片要获得较多的分裂相,需要保证植物细胞处于旺盛的有丝分裂期,因此取材时间就显得非常关键(表1)。一天中植物分裂旺盛期一般出现在8:00—11:00,但不同物种的细胞分裂期长短及分裂旺盛的时间点存在一定差异。如黄瓜取材时间在8:40—9:10,中期分裂相较多,制片成功率也较高[3];而同为瓜类的甜瓜根尖则在8:00左右为最佳取样时期[4]。笔者所在课题组对黄花芥蓝的取材时间进行研究发现,9:00左右效果最好。同时需要注意的是,并不是所有物种都适合在上午取材,如天南星科植物白掌和观音莲12:00—14:00取材时分裂相细胞较多,而8:00—10:00分裂相细胞较少,这与大多数植物的常规取材时间有所不同[10]。另一方面,根尖长度对分裂相的多少也有明显影响。研究表明,春石斛组培苗根尖长度为10 mm时中期分裂相较多[11];青花菜的根尖长度在13~15 mm时,中期分裂相数量最多[5];不结球白菜的根尖长度为10~20 mm时,获得的分裂相比例最多[6]。因此,在进行植物制片条件优化时,可参考这些时间点尝试从8:00—11:00设置梯度以求最快找到最佳取材时间点,同时控制根尖长度为10~20 mm,以便获取更多的中期分裂相,制出成功的染色体制片。
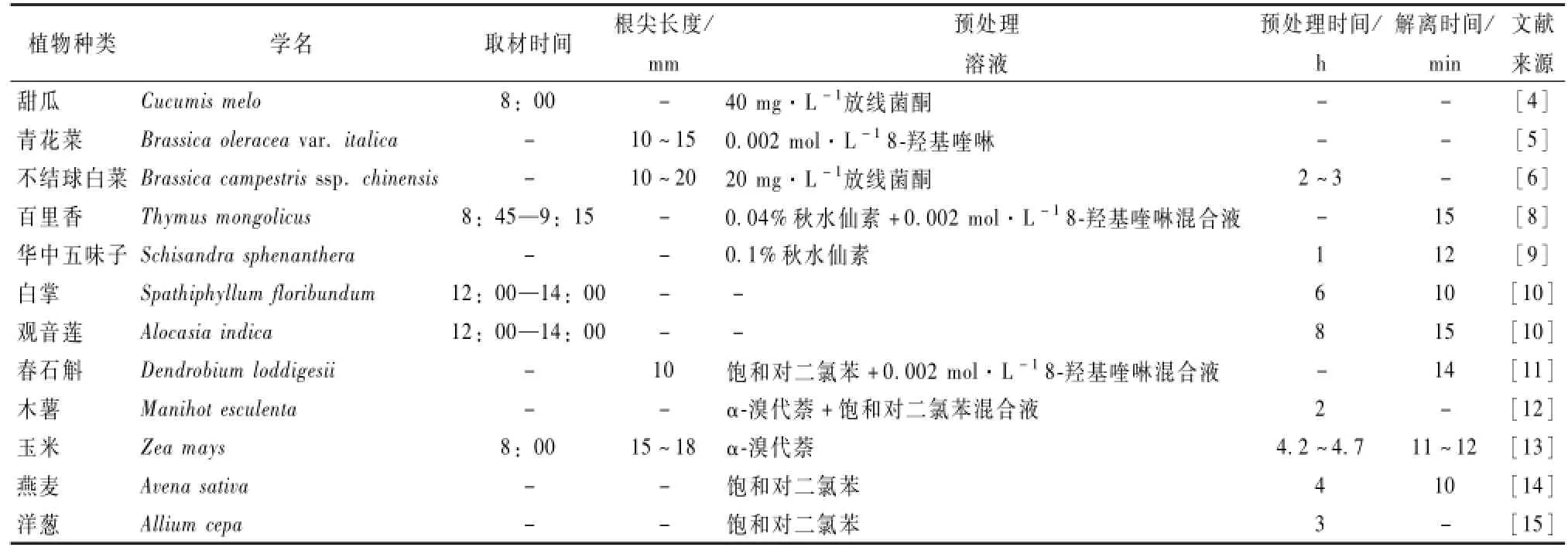
表1 不同植物染色体制片影响因素及最佳条件
2 预处理
预处理的主要目的就是通过阻断、抑制和破坏纺锤丝的形成使细胞分裂停滞在中期,进而获得更多的中期分裂相细胞;同时预处理还能改变细胞质的黏度,促使染色体分散和收缩,以便于压片和观察。因此,预处理是染色体制片中的关键环节。常用的预处理方法有物理法、化学法和混合处理法[1]。
预处理对制片效果的影响主要表现在处理试剂和处理时间两方面。常用的预处理试剂包括冰水、对二氯苯、8-羟基喹啉、秋水仙素、α-溴萘及混合试剂组合。有研究表明,对二氯苯处理染色体分散较好[14];8-羟基喹啉处理能使染色体及缢痕和次缢痕清晰,显示效果良好,适合染色体较大的植物[14];秋水仙素处理能高效积累中期分裂相,通常效果较好[8];α-溴萘适用于禾本科植物(如玉米)和水生植物材料[13];但以上结论在不同植物中可能会有所不同[5]。当单一试剂效果不佳时,可考虑采用不同预处理剂的组合。如百里香染色体制片中以0.04%秋水仙素和0.002 mol·L-18-羟基喹啉等体积混合溶液预处理根尖2~3 h,累积的中期分裂相最多[8];木薯根尖采用α-溴萘与饱和对二氯苯的混合液预处理效果最好[12],均优于单一试剂处理。处理时间方面,笔者所在课题组以黄花芥蓝为材料进行了研究,结果表明,预处理时间不够会导致染色体聚缩程度不到位,染色体拖尾,呈小蝌蚪状且边缘不整齐(图1中A),这样的染色体很难进行核型分析等后续研究;而预处理时间过长,则导致染色体聚缩过度呈现豆状或点状,形态不佳,且无法识别着丝粒位置(图1中B),不利于后续分析,而条件合适的染色体无论聚缩程度还是形态均较理想(图1中E),类似的结果在油菜、水稻和芝麻等植物上也被报道[17]。同时还应注意的是,不同预处理试剂对应的处理浓度和处理时间也不尽相同。如8-羟基喹啉的浓度多为0.002 mol·L-1,秋水仙素一般为0.01%~0.10%,而对二氯苯则为饱和状态。处理时间方面,洋葱以冰水处理,一般需处理2~3 d[18],而在饱和对二氯苯溶液中的预处理只需3 h[15]。总之,不同植物适用的预处理试剂和时间具有一定差异,需根据具体情况进行选取。
3 解离
解离的目的在于软化和分解细胞壁,使细胞间易于分离;同时解离还可以清除部分细胞质,使细胞质背景近于透明化,便于染色体的观察[1]。常用的解离方法包括酸解法和酶解法。酸解法步骤简便,容易掌握,经过酸解和压片后,根尖分生组织多呈现单细胞状态,但分裂细胞的染色体仍包裹在细胞壁中。因此,酸解法广泛应用于染色体计数、核型分析和染色体畸变的观察与分析。酶解法使用纤维素酶和果胶酶,经过酶解和压片后,分生细胞的原生质体从细胞壁中脱离出来,使得染色体周围不带细胞质或仅有少量细胞质,从而得到细胞背景干净、染色体分散较好的制片,该方法适合染色体数目多、形态小的植物[2],如部分果树染色体。因此,酸解法常用于染色体显带技术或姊妹染色单体交换研究[1]。
在实际操作中,酸解法通常采用1 mol·L-1的盐酸在60℃下解离若干分钟,解离时间的长短因物种不同而有所差别。解离时间过短,会导致细胞壁不够软化,细胞不容易分散,并且染色体和细胞质均被明显染色,不易区分;若解离时间过长,染色体和细胞质的着色都变得困难,且分辨度模糊[8],笔者对黄花芥蓝解离时间优化的结果也验证了这些结论(图1中C,D,E)。针对特定物种的制片条件进行优化时,酸解法和酶解法还可结合使用。如燕麦属牧草先用1 mol·L-1的盐酸在60℃下酸解10 min,再用20 g·L-1的纤维素酶溶液在25℃下酶解处理20 min,染色体即分散良好且没有细胞壁覆盖,制片效果清晰可见[14]。
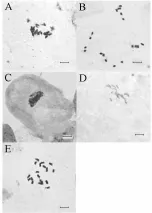
图1 不同预处理时间和解离时间对芥蓝染色体的影响
4 染液选择
在光学显微镜下对染色体形态和结构进行观察时,须先对根尖材料进行染色,通常采用染色体染色效果好而细胞质着色少的染液。可用于植物染色体制片的染液种类较多,如改良卡宝品红、醋酸洋红、醋酸地衣红、铁矾-苏木精和孚尔根试剂等,不同染液的特点也不尽相同。通常改良卡宝品红染液适合大多数植物的染色,且仅使染色体着色而细胞质几乎不着色,进而提高染色体与背景的对比度。而1%醋酸洋红染液只作临时镜检观察。田秋元等[15]发现,采用醋酸洋红对洋葱根尖细胞染色制片时,细胞质和染色体对比度小,且染色体模糊不清,不能用于核型分析,而用卡宝品红染液染色的制片则效果良好。醋酸地衣红易溶于乙醇,因此操作时需先将70%乙醇保存的材料充分洗净后再浸入45%冰乙酸溶液中进行染色。经过铁矾-苏木精染色后,染色体能染为深蓝色,而且细胞壁和细胞质也均能一定程度地着色,染色体在压片后容易分散但较为坚硬,因此必须用45%冰乙酸溶液处理,以使细胞质褪色,染色体变软,这种染液染色深、反差大、分色清晰,利于制片标本的长期保存。孚尔根试剂仅对细胞核和染色体中的DNA显色,且颜色均一清晰,细胞软化效果好,但压片时较长的染色体容易相互缠绕且不易分散。使用孚尔根试剂染色时需注意必须采用酸解法进行解离,且前处理要求较高,解离时间过长,会导致染色效果消退,消退程度与固定液种类有关,一般认为采用FAA固定液效果要优于常用的卡诺固定液。因此,在具体操作中研究人员需根据试验需求选取合适的染液[1]。
5 制片方法
常用的制片方法包括敲片法、压片法、涂布法、玻棒擀片法、醋酸烘烤压片法等[7,19]。制片中出现的常见问题有染色体不够分散存在重叠;染色体不在同一平面;背景中有较多杂质;染色不均匀;制片中出现较多气泡等等。这些问题均可通过不断练习制片方法来解决。其中,敲片法是最传统的方法,适用性广,一般不会在操作过程中产生气泡,但操作时间较长;在酒精灯上烘烤可以加深染色,但烘烤过程中温度过高会产生很多杂质,因此烤片时要注意受热均匀且时间不宜过长;同时,几种方法可叠加使用。在操作中还需注意,无论采用哪种制片方法,都不要使盖玻片被搓动,以便使材料分散压平,便于观察。在平时的实验操作中需要反复练习,这样才能较好地掌握制片技术,获得理想的效果。
综上可知,影响制片优劣的主要因素中预处理是关键环节。染色体制片的目标就是获得高质量的制片,为后续的核型分析和原位杂交等研究提供先决条件。不同植物染色体制片的各项关键因素最佳参数各异,因此,在正式开始研究前,需针对以上各因素进行染色体制片的条件优化试验,从而获得针对目标植物最优且稳定的制片条件,以便后续研究可以正常有序地开展。同时,染色体制片中还存在耗时过长和部分预处理试剂毒性较大的问题,如何缩短实验时间及筛选无毒或低毒的预处理试剂也是未来制片技术发展的重要方向。
[1] 帅素容.普通遗传学实验教程[M].成都:四川科学技术出版社,2003:4-12.
[2] 李懋学,张杶方.植物染色体研究技术[M].哈尔滨:东北林业大学出版社,1991:l-20.
[3] 韩毅科,杜胜利,王鸣.黄瓜染色体制片及倍性研究[J].华北农学报,2003,18(1):72-74.
[4] 张永兵,陈劲枫,伊鸿平,等.甜瓜有丝分裂染色体制片技术及核型分析[J].西北植物学报,2005,25(9):1735-1739.
[5] 张红梅,张蜀宁,孔艳娥,等.青花菜染色体制片技术及核型分析[J].南京农业大学学报,2009,32(4):33-36.
[6] 郑金双,张蜀宁,孙成振,等.不结球白菜根尖体细胞染色体制片及其二倍体和四倍体有丝分裂过程观察[J].植物资源与环境学报,201 l,20(4):58-63.
[7] 杜培,张新友,李丽娜,等.高质量花生根尖细胞染色体制片方法研究[J].河南农业科学,2013,42(3):31-35.
[8] 杨宁,谈永霞,李巧峡,等.百里香染色体制片优化及核型分析[J].草业学报,2012,21(1):184-189.
[9] 顾蔚,卜海东,张成艳,等.华中五味子染色体制片优化及核型分析[J].西北植物学报,2008,28(2):262-266.
[10] 李庆玲,陈荣,杨跃生,等.两种天南星科植物根尖组织染色体观察方法的优化[J].北方园艺,2012,2:134-136.
[11] 姚睿,廉美兰,于晓坤,等.春石斛根端染色体制片技术的优化[J].延边大学农学学报,2012,34(2):99-102.
[12] 王超,王婧菲,庄南生,等.木薯根尖染色体制片方法的优化[J].热带作物学报,2012,33(4):627-630.
[13] 姚启伦.玉米染色体常规制片技术中关键因子处理效应及优化[J].湖南农业大学学报,2007,33(4):419-422.
[14] 陈是宇,方程,孙彦,等.燕麦属牧草根尖组织染色体观察方法的优化研究[J].草原与草坪,2008(2):23-26.
[15] 田秋元,杨约田.洋葱核型分析及有关制片方法的探讨[J].安徽农业科学,2009,37(25):12341-12343.
[16] 王小利.葡萄染色体制片技术优化[J].实验室研究与探索,2012,31(10):7-10.
[17] 张羽,王勇,陈雪燕.植物染色体制片中疑难问题的解析[J].安徽农业科学,2010,38(35):19901-19903.
[18] 齐志广,秘彩莉,柏峰,等.不同预处理对有丝分裂的影响[J].河北师范大学学报,2003,27(1):88-91.
[19] 陈高,孙航,孙卫邦.改进的植物染色体制片方法[J].植物生理学通讯,2007,43(4):759-760.
(责任编辑:张瑞麟)
S 184
:A
:0528-9017(2015)10-1654-04
文献著录格式:刘丹,夏雪,吴益梅,等.植物染色体制片效果影响因素的解析[J].浙江农业科学,2015,56(10):1654-1657.
10.16178/j.issn.0528-9017.20151044
2015-05-10
四川省教育厅重点项目(14ZA0016);四川省省级大学生创新训练计划项目(201410626036);四川农业大学本科质量工程项目(04052109)
刘 丹(1996-),女,四川内江人,本科生,从事蔬菜细胞遗传学研究工作。E-mail:liudan618419@163.com。
孙 勃。E-mail:14099@sicau.edu.cn。
