油茶组培苗生根过程中生理生化指标的变化
2015-01-05陈永忠王湘南彭邵锋杨小胡陈隆升
王 瑞 ,陈永忠 ,王湘南 ,彭邵锋 ,杨小胡 ,陈隆升 ,马 力
(1.中南林业科技大学,湖南 长沙 410004;2.湖南省林业科学院,湖南 长沙 410004;3.国家油茶工程技术研究中心,湖南 长沙 410004)
油茶组培苗生根过程中生理生化指标的变化
王 瑞1-3,陈永忠2,3,王湘南2,3,彭邵锋2,3,杨小胡2,3,陈隆升2,3,马 力2,3
(1.中南林业科技大学,湖南 长沙 410004;2.湖南省林业科学院,湖南 长沙 410004;3.国家油茶工程技术研究中心,湖南 长沙 410004)
为了探明油茶组培苗生根机理,提高油茶组培苗生根率,以“湘林1号”油茶无性系组培苗为材料,对其生根过程中营养物质、酶活性及内源激素变化规律开展了研究。结果表明:油茶组培苗属皮部生根类型;油茶组培苗生根过程中可溶性蛋白含量一直下降,可溶性糖含量呈现“升高—降低—升高”的趋势;POD活性在根原基诱导和表达期较低,而在不定根诱导和表达期迅速升高,PPO活性呈现先升高后降低的趋势;内源IAA含量呈“M”型变化,总体呈上升趋势,内源ABA含量呈现“W”型变化趋势,ZR含量呈先上升,后下降,再上升的变化趋势,GA含量呈现“上升—下降—上升”的趋势,整体呈现上升趋势。
油茶;组培苗;生根;营养物质;酶活性;内源激素
油茶Camellia oleifera为山茶科Theacae山茶属Camellia植物,与油棕Elaeis guineensisJacq.、油橄榄Olea europaeaL.和椰子Cocos nucifera并称为世界四大木本食用油料植物。油茶常规育种周期很长,并且受到远缘杂交不亲和等条件的限制,无性繁殖成为油茶良种推广的重要途径[1]。油茶无性繁殖以芽苗砧嫁接为主,辅以少量扦插苗,芽苗砧嫁接和扦插苗存在操作繁琐、繁殖系数低、纯度难以控制等问题。植物组织培养已在快繁、脱毒、育种和种质资源保存等方面发挥了巨大的作用,目前关于油茶组织培养的研究不多,多集中在愈伤组织的诱导及芽诱导阶段[2-5],关于油茶植株再生的研究较少[6-9]。油茶组织培养生根困难、移栽成活率低、繁殖系数低,致使良种苗木供不应求。探索油茶组培苗生根机理,提高生根率,加快组培快繁技术在生产中的应用,具有重要的理论价值和实践意义。
许多研究表明,过氧化物酶(POD)和多酚氧化酶(PPO)与植物不定根的发生和发展有着密切的关系[10-11]。另外,植物内源激素变化也是诱导不定根发生的重要因素[12-13]。目前,有关组培苗生根机理的报道较少,辜云杰等研究了植物组培苗生根过程中酶及内源激素活性的变化[14-17]。本试验中分析了油茶组培苗生根过程中可溶性糖含量、可溶性蛋白含量、氧化酶活性和4种内源激素含量的变化,旨在探讨油茶组培生根过程中这些生理生化指标与组培生根的关系,为提高油茶组培苗生根率提供理论基础。
1 材料与方法
1.1 试验材料
供试材料为“XL1”油茶继代试管苗,选择3~4 cm高的油茶组培苗用1×10-3IBA浸泡10 s,然后接种于生根培养基中。
1.2 试验方法
接种后第0天开始取样,每隔7 d取样1次,共取样7次。可溶性蛋白含量的测定采用考马斯亮蓝法;可溶性糖含量的测定采用蒽酮比色法;过氧化物酶(POD)活性的测定采用愈创木酚法;PPO活性的测定采用邻苯二酚法;内源激素(IAA、ABA、ZR、GA)活性的测定采用酶联免疫吸附测定法(ELISA)。
1.3 数据处理
数据分析使用EXCEL2003。内源激素含量采用logit曲线方法进行计算。
2 结果与分析
2.1 油茶组培苗生根特性
研究发现:油茶XL1组培苗经IBA处理后第21天开始形成不定根(见图1)。接种后第42天生根调查结果显示:XL1组培苗生根率为86.7%,平均根数3.5条,平均根长0.71 cm(见表1)。经观察根系均从皮部产生,不是通过愈伤组织产生的,因此,油茶XL1组培苗为皮部生根类型。性蛋白的含量从第0天的20.53 mg/g降低到第42天的11.25 mg/g,降低了45.2%。可见不定根诱导期、

表 1 油茶组培苗生根特性Table 1 Rooting characteristics of C. oleifera tissue culture seedlings

图 1 油茶组培苗生根情况Fig. 1 Rooting situation of C. oleifera tissue culture seedlings
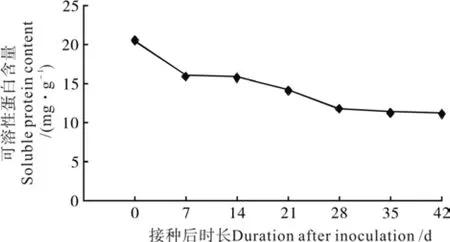
图 2 油茶组培苗生根过程中可溶性蛋白含量变化Fig. 2 Change of soluble protein content in C. oleifera tissue culture seedlings during rooting
2.2 油茶组培苗生根过程中营养物质的变化
2.2.1 可溶性蛋白含量变化
油茶组培苗生根过程中可溶性蛋白含量变化如图2所示。由图2可见,生根过程中可溶性蛋白含量一直下降,从接种后第28~42天下降平缓,到第42天时达到最低值。在整个生根过程中,可溶形成期和伸长期的可溶性蛋白含量一直处于降低趋势。说明在生根过程中,根原基的发育及不定根的形成与伸长与可溶性蛋白的不断消耗有密切关系。
2.2.2 可溶性糖含量变化
油茶组培苗生根过程中可溶性糖含量变化如图3所示。由图3可见,油茶组培苗生根过程中可溶性糖含量呈现“升高—降低—升高”的变化趋势。可溶性糖是启动不定根形成所需能量的主要来源,第0~14天可溶性糖含量在不定根根原基诱导期随培养时间延长而上升,可溶性糖含量在不定根形成期(第14~28天)降低,在不定根伸长期(第28~42天)又呈上升趋势。在生根的不同天数内可溶性糖含量变化明显,说明不定根的形成需要消耗大量的营养物质,糖的消耗对生根有明显促进作用,油茶组培苗生根与可溶性糖含量有极密切的关系。
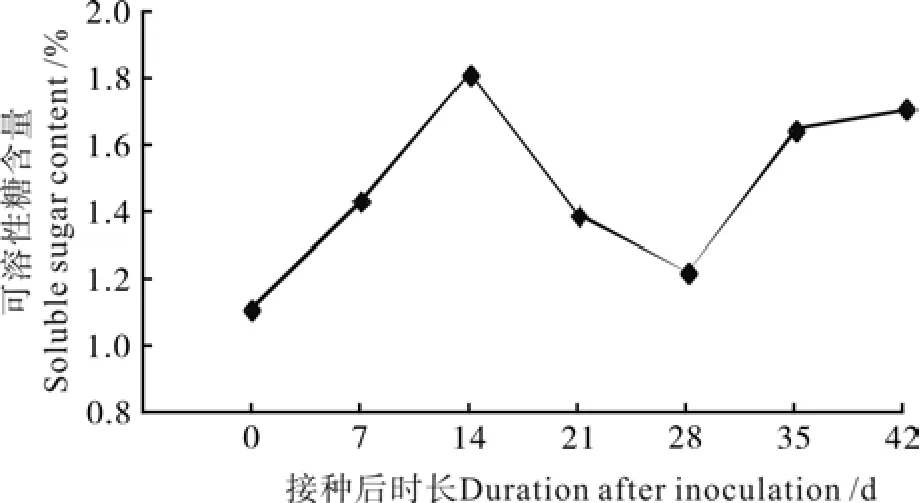
图 3 油茶组培苗生根过程中可溶性糖含量变化Fig. 3 Change of soluble sugar content in C. oleifera tissue culture seedlings during rooting
2.3 油茶组培苗生根过程中酶活性变化
2.3.1 过氧化物酶(POD)活性变化
油茶组培苗生根过程中POD活性变化如图4所示。由图4可见,油茶组培苗生根过程中,POD活性呈现有规律的变化,第0~21天过氧化物酶活性变化不大,且保持在较低水平,第21天后迅速上升,一致保持较高的水平,第35天时达到最高点。
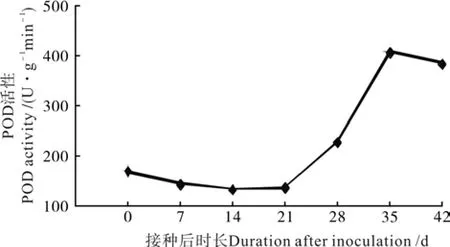
图 4 油茶组培苗生根过程中POD活性变化Fig. 4 Change of POD activity in C. oleifera tissue culture seedlings during rooting
POD是通过调节植物体内IAA水平影响生根的,在不定根诱导期和表达期,POD活性升高是有生根能力的标志[18-19]。同时,外源的生长素也会诱导、调节POD活性。第0~21天POD活性较低,为不定根根原基感知生长素信号的时期,对内源IAA的降解能力较弱,有利于根原基的诱导和表达;第21天以后,不定根处于表达和伸长的活跃时期,POD活性迅速升高,促进了不定根的伸长和根系的发育。
2.3.2 多酚氧化酶(PPO)活性变化
油茶组培苗生根过程中PPO活性变化如图5所示。由图5可见,PPO活性在油茶组培苗生根过程中呈现先升高后降低的趋势。第0~28天逐渐上升,在第28天达到了高峰,然后迅速下降。IBA诱导后使PPO活性上升,从而促进了根原基的发育和不定根的诱导、形成。第28天后,在不定根伸长期,PPO活性下降。由此可见,PPO对油茶组培苗不定根的发生和发展起着极其重要的作用。
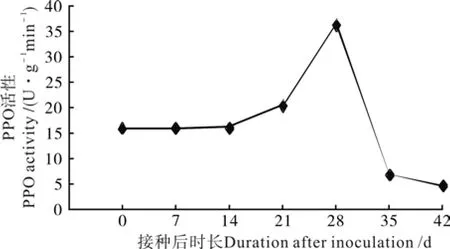
图 5 油茶组培苗生根过程中PPO活性变化Fig. 5 Change of PPO activity in C. oleifera tissue culture seedlings during rooting
2.4 油茶组培苗生根过程中内源激素变化
2.4.1 生长素(IAA)含量变化
生长素对根原基的诱导、生长和发育均起着重要的作用[20]。油茶组培苗生根过程中IAA含量变化如图6所示。由图6可知,在生根过程中,内源IAA呈“M”型变化,即呈现先升高,后下降,然后迅速升高,最后下降的变化趋势,但总体呈上升趋势。在整个过程中出现2个高峰,在第14天和第35天各出现1个,第2个高峰值(第35天)IAA含量(810.83 ng/g)是第1个高峰值(第14天)IAA含量(546.06 ng/g)的1.48倍。第1个峰值的出现与根原基形成有关,第2个峰值的出现与根的伸长生长有关。以上结果表明,在根系启动和根原基形成时外源IBA提供较高浓度的IAA,根原基分化时需要IAA的含量较低,根的伸长生长时所需IAA含量上升,这与梁伯璠等的研究结果相同[21-24]。

图 6 油茶组培苗生根过程中IAA含量变化Fig. 6 Change of IAA content in C. oleifera tissue culture seedlings during rooting
2.4.2 脱落酸(ABA)含量变化
油茶组培苗生根过程中ABA含量变化如图7所示。由图7可知,在生根过程中,ABA含量呈现“W”型变化,在第0天、第21天和第35天出现峰值,峰值分别为:240.67、233.57、259.45 ng/g。接种后ABA含量缓慢下降,在第14天达到最低点(209.43 ng/g)。外源IBA抑制内源ABA,使其含量大幅度下降,利于植株内淀粉水解转化为糖,同时也有利于IAA受体的形成,有利于根原基的诱导,说明根系的启动阶段需要的ABA少或ABA不利于根系的启动;第28天后ABA含量一直缓慢上升,在42天达到最高值,说明此阶段对IAA运输的抑制作用最强,若此时能够降低ABA含量,可能更有利于油茶组培苗根系的生长。
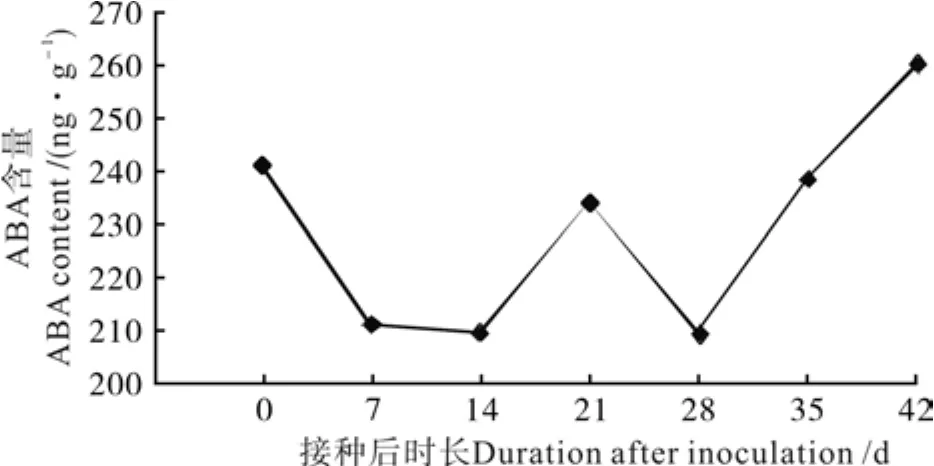
图 7 油茶组培苗生根过程中ABA含量变化Fig. 7 Change of ABA content in C. oleifera tissue culture seedlings during rooting
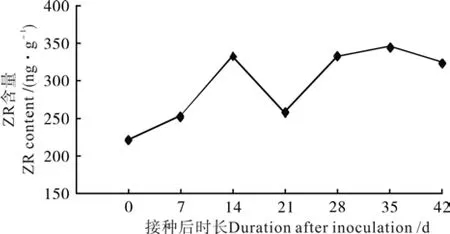
图 8 油茶组培苗生根过程中ZR含量变化Fig. 8 Change of ZR content in C. oleifera tissue culture seedlings during rooting
2.4.3 细胞分裂素(ZR)含量变化
油茶组培苗生根过程中ZR含量变化如图8所示。由图8可知,细胞分裂素ZR在油茶组培苗生根过程中呈先上升,后下降,再上升的变化趋势,最后ZR含量基本趋于稳定。在第14天和第28天出现2个高峰。在第0~14天,即外源IBA诱导不定根根原基分化形成前,ZR含量呈上升趋势,此时高浓度的ZR含量有利于根原基的形成,这与Feito等的研究结果一致[25]。第14~21天,随着不定根分化的进行,ZR的消耗利用正常进行,使其含量逐渐下降,第21天达到谷值。第21天后,自身启动了ZR的合成,ZR含量随着生根时间的推移而不断增加。
2.4.4 赤霉素(GA)含量变化
油茶组培苗生根过程中GA含量变化如图9所示。由图9可知,在油茶组培苗生根过程中,赤霉素GA含量呈现“N”型变化趋势,即“上升—下降—上升”,整体呈现上升趋势。赤霉素含量在第0天时最低,为667.18 ng/g,第0~14天,IBA诱导赤霉素的合成使赤霉素含量不断升高,此时正是不定根根原基的诱导生根时期;第14~21天在不定根形成期赤霉素的消耗使其含量逐渐下降,在第21天不定根形成时出现谷值(738.44 ng/g)。随后不定根自身合成的激素促使赤霉素的合成,使其含量增加。第42天时达到最高值(873.76 ng/g)。说明油茶组培苗不定根在根原基诱导形成和分化的时期,GA起很重要的作用。

图 9 油茶组培苗生根过程中GA含量变化Fig. 9 Change of GA content in C. oleifera tissue culture seedlings during rooting
3 结论与讨论
(1)油茶组培苗生根过程中(第0~42天)可溶性蛋白含量一直处于下降的趋势。可能是由于生根过程中需要激活生长素等内源激素的表达,从而诱导不定根根原基的形成、表达和伸长,这一系列的反应过程均需要消耗可溶性蛋白等营养物质提供的能量。可溶性糖含量变化呈现“升高—降低—升高”的趋势,也说明在不定根形成期需要消耗大量的营养物质,说明可溶性糖是启动不定根形成所需能量的主要来源。可溶性蛋白和可溶性糖的消耗对组培苗不定根的形成与发育提供能量。
(2)在本试验中,在生根过程中的愈伤组织诱导阶段,POD、PPO活性上升,在不定根形成和伸长期,各种酶活性上升速度放慢,甚至稍有下降。这充分揭示了油茶不定根的发生和发展与这2种氧化酶的密切联系。本研究中,油茶属于难生根植物,POD活性高,降解IAA的作用强,向下输送的IAA含量较少,对诱导生根不利;同时,油茶组培苗生根前期PPO活性较低,催化形成的生根辅助因子也较少,也不利于生根。所以,在生根前可以利用外源生长素处理油茶组培苗,提供足够的IAA,来诱导、促使油茶不定根的形成。
(3)油茶组培苗生根过程中,内源激素(IAA、ABA、ZR与GA)含量与不定根形成与生长密切相关。高浓度的内源IAA及低浓度的内源ABA有利于不定根根原基的诱导分化和生长发育,高浓度的内源GA抑制了油茶不定根的形成,外源IBA对内源IAA的合成有促进作用,可抑制组培苗中内源ABA含量。所以,采用IBA速蘸组培苗基部可促进其生根。
本试验中结果表明赤霉素GA含量变化在生根过程中呈现“上升—下降—上升”的趋势,原因可能是外源IBA诱导赤霉素的合成使赤霉素含量升高。随着培养时间的延长,内源生长素、乙烯、细胞分裂素等通过抑制调节内源赤霉素的水平,促进油茶不定根的形成和发育。这充分说明了在油茶不定根根原基形成和分化时期,GA起着重要的作用。
[1]闻 丽,张日清,李建安,等.油茶种质改良现状及其花药培养技术的应用前景[J].经济林研究,2004,22(4):73-77.
[2]李建安,张日清,石明旺,等.油茶两物种花药培养愈伤组织诱导试验[J].经济林研究,2003,21(3):36-38.
[3]王 瑞,陈永忠,王湘南,等.油茶优良无性系叶片愈伤组织诱导研究[J].经济林研究,2009,27(2):35-39.
[4]黄莉雅,张日清,马锦林,等.不同培养条件对油茶愈伤组织和芽诱导的影响[J].安徽农业科学,2010,38(4) :1718-1719.[5]黄莉雅,张日清,马锦林,等.油茶愈伤组织和芽诱导培养条件的筛选[J].经济林研究,2010,28(1):30-34.
[6]蔡冬元.“0.618黄金杯”和不同基质对油茶组培苗生根的影响[J].经济林研究,2015,33(1):123-126.
[7]毕方铖,谭晓风,张智俊,等.油茶离体培养诱导再生植株的研究[J].经济林研究,2004,22(2):5-9.
[8]张智俊,罗淑萍,李亚玲,等.油茶优良无性系子叶体细胞胚植株再生[J].植物学通报,2005,22(增刊):43-49.
[9]陈 春.油茶优良无性系组织培养与植株再生[J].防护林科技,2012,107(2):24-26.
[10]Haissig B E. Influences of auxins and auxin synergists on adventitious primordium initiation and development[J]. N Z J for Sci,1974,(4):311-323.
[11]Bhatt acharya N C. Enzyme activities during adventitious rooting[C]//MDavis T D, Haissig B E, Sankhla N. Adventitious root formation on cutting. Portland: Dioscorides, 1989:88-101.
[12]郑均宝,刘玉军,裴保华,等.几种木本植物插穗生根与内源IAA,ABA的关系[J].植物生理学报,1991,17(3):313-316.
[13]马振华,王吉斌,李才文,等. 四倍体刺槐硬枝扦插生根过程中内源激素的变化[J].中南林业科技大学学报, 2013, 33(6):36-32.
[14]辜云杰,邓小敏,张建康.IBA及NAA对山杜英组培苗生根过程中POD、PPO活性的影响[J].亚热带植物科学,2004,(2):8-9.
[15]秦新民,梁倩华.白花泡桐不定根发生过程中内源激素和RNA的变化[J].热带亚热带植物学报,1995,4(1):52-56.
[16]韦素玲.白花泡桐根分化过程中过氧化物酶、IAA氧化酶和过氧化氢酶的变化[J].广西科学,2001,(2):135-137.
[17]于雪飞,白 卉,王洪星.4种内源激素在中美山杨组培生根过程中的变化[J].林业科技,2009,34(2):5-7.
[18]Moncousin C H, Gaspar T. Peroxidase as a marker for rooting improvement inCynara scolymusL cultivated in vitro[J].Biochem Physiol P fl anzen, 1983, 178: 263-271.
[19]Nordstrom A C, El iasson J. Levels of endogenous indole-3-acetic acid and indole-3-acetylaspartic acid during adventitious root formation in pea cuttings[J]. Physiol Plant,1991,82:599-605.
[20]李小方,汤章城,何玉科.不定根的形态发生与调节机制[J].细胞生物学杂志,2001,23(3):130-136.
[21]韩锦峰.植物生理生化[M].北京:高等教育出版社,1991:117-122, 189-215.
[22]曹仪植,宋占午.植物生理学[M].兰州:兰州大学出版社,1998: 267,305.
[23]梁伯璠,周毓君,朱宝成.不同光质对黄瓜离体根形态建成的影响[J].河北大学学报,1998,18(3):260-262.
[24]王 忠.植物生理学[M].北京:中国农业出版社,2001:356.
[25]Feito I, Gea MA, Fernandez B,et al.Endogenous plant growth regulators and rooting capacity of different walnut tissues[J].Plant Growth Regul,1996,19(2):101-108.
Changes of physiological and biochemical indexes during tissue culture seedlings rooting inCamellia oleifera
WANG Rui1-3, CHEN Yong-zhong2,3, WANG Xiang-nan2,3, PENG Shao-feng2,3, YANG Xiao-hu2,3, CHEN Long-sheng2,3, MA Li2,3
(1. Central South University of Forestry & Technology, Changsha 410004, Hunan, China;2.Hunan Academy of Forestry, Changsha 410004, Hunan, China;3. National Oil-Tea Camellia Engineering & Technology Research Center, Changsha 410004, Hunan, China)
In order to determine the rooting mechanism of tissue culture seedling inCamellia oleiferaand promote rooting rate of tissue culture seedling, taking tissue culture seedlings inC. oleiferaXL1 as materials, change regulations of nutrient substance, enzyme activity and endogenous hormones were studied during rooting. The results showed that roots inC.oleiferatissue culture seedling was derived from the callus. During tissue culture seedlings rooting, the content of soluble proteins was decreased, while the content of soluble sugar was increased fi rstly, decreased later, and then increased rapidly.POD activity was very low during induction and expression of root primordium, while POD activity was increased rapidly during induction and expression of adventitious roots. PPO activity was fi rstly increased and then decreased. Additionally,the content of endogenous IAA, ZR and GA were all increased fi rstly, decreased later, and then increased, and they showed an increasing tendency as a whole, while the content of endogenous ABA showed “W” type of trend.
Camellia oleifera; tissue culture seedling; rooting; nutrient substance; enzyme activity; endogenous hormones
S601;S794.4
A
1003—8981(2015)02—0068—05
2015-01-15
湖南省科技重大专项“油茶良种繁育与生态高效培育关键技术研究与示范”(2013FJ1006)。
王 瑞,助理研究员,博士研究生。E-mail:wangrui102@163.com 通讯作者:陈永忠,研究员,博士。
王 瑞,陈永忠,王湘南,等.油茶组培苗生根过程中生理生化指标的变化[J].经济林研究,2015,33(2):68-72.
10.14067/j.cnki.1003-8981.2015.02.012
http: //qks.csuft.edu.cn
[本文编校:闻 丽]
