牛角瓜花粉离体萌发研究
2015-01-05张太奎王连春叶维雁刘惠民
刘 鹏,张太奎,王连春,郑 元,叶维雁,刘惠民
(西南林业大学林学院,云南 昆明 650224)
牛角瓜花粉离体萌发研究
刘 鹏,张太奎,王连春,郑 元,叶维雁,刘惠民
(西南林业大学林学院,云南 昆明 650224)
为了探讨牛角瓜花粉离体萌发的最适条件及培养基成分,以2年生牛角瓜新鲜花粉为试材,研究了不同溶液对牛角瓜花粉块壁解离效果的影响情况;还采用离体培养法,研究了不同培养温度和培养时间、不同培养基组分对牛角瓜花粉萌发率和花粉管生长的影响情况。结果显示:以10% 的NaOH溶液将牛角瓜花粉块处理10 min的解离效果最好;牛角瓜花粉离体萌发的最适温度为30 ℃,在此温度条件下培养6 h后其花粉萌发率基本稳定,培养12 h后其花粉管生长最好;蔗糖对牛角瓜花粉萌发率及花粉管长度的影响均较大,硼酸对花粉萌发率及花粉管长度的影响均较小;牛角瓜花粉萌发和花粉管生长的最适培养基为20%蔗糖+0.1%硼酸+5 mg/L氯化钙+15 mg/L 6-BA,在此培养基上并在30 ℃的温度条件下培养6 h,其花粉萌发率达到94.77%,花粉管长度为11.07 mm。
牛角瓜;花粉块壁;花粉萌发;花粉管生长;离体培养
牛角瓜为萝藦科Asclepiadaceae牛角瓜属Calotropis常绿灌木或小乔木,有哮喘树、羊浸树、断肠草、五狗卧花等别名,在我国产于云南、四川、广西和广东等南方省区,有很高的经济和药用价值[1-5]。其茎皮纤维可用以造纸、制绳索及生产人造棉,也可用以织麻布、麻袋,其种毛可用作丝绒原料及填充物,是一种很有开发潜力的纤维经济作物,也是一种生态环保的新型纤维材料;牛角瓜还是一种药用植物,其茎、叶的乳汁含牛角瓜甙等种强心甙和牛角瓜碱,可用来治疗皮肤癣、痢疾、风湿等疾病。萝藦科植物的花粉与兰科植物相似,是由一层薄膜包裹而形成的花粉块。牛角瓜的两性花具有花粉块这一特殊结构,其花粉成熟后,不会散开,直至传粉成功后,花粉粒一般也不散出,在花粉块内直接萌发,因此有必要找到一种化学试剂以解除这层包裹着花粉粒的薄膜,从而为其后期花粉离体萌发试验做好准备。迄今为止,有关牛角瓜的研究报道较少,尚未见到有关牛角瓜花粉离体萌发的相关研究报道。有关研究者在对其野外调查中发现,牛角瓜自然坐果率低,这极大地制约了牛角瓜栽培生产的发展。杂交育种是提高其产量、改良其品质的重要手段,而杂交亲本花粉生活力的高低直接影响到育种的成败[6],因为花粉具有萌发活力,这是完成受精的必要条件,也是决定其坐果率的前提[7]。牛角瓜的花粉活力与其自然坐果率直接相关,而花粉萌发率和花粉管长度是鉴定花粉活力的两个基本指标。因此,文中以2年生牛角瓜新鲜花粉为试验材料,研究了不同溶液对牛角瓜花粉块壁解离程度的影响情况,还采用离体培养法,研究了不同培养温度、培养时间、培养基组分对牛角瓜花粉萌发率及花粉管生长的影响情况,旨在寻求最适合牛角瓜花粉萌发的培养配方及最适培养条件,从而为其人工辅助授粉、育种工作,为牛角瓜生殖生物学、种质资源保存等方面的研究提供基础资料。
1 材料与方法
1.1 材 料
试验以云南省元江县林业局种苗站内牛角瓜基地(东经 101°58′12.8″、北纬 23°36′5.7″)的 2 年生牛角瓜为材料,采摘当天开放的花朵,放入自封袋中迅速带回实验室,用解剖针小心地将每朵花的5个花粉块取出,以备花粉块壁解离试验与花粉离体萌发试验使用。
1.2 试验方法
1.2.1 花粉块壁解离试验方法
将牛角瓜花粉块放入凹形载玻片中,用6种不同溶液(蒸馏水,5%、10%、20%的NaOH溶液,5%、10%、20%的HCl溶液,5%、10%的次氯酸钠溶液,二甲苯溶液,乙酸异戊酯溶液)分别浸泡5、10、20 min;然后将以每种方法处理后的花粉块各用蒸馏水清洗2遍,再在解剖镜下进行人工剥离,去除花粉块壁,以判断溶液处理后花粉块壁的分离程度[8]。每个处理5个花粉块,重复3次。
1.2.2 花粉离体培养方法
将花粉块置于凹形载玻片中,加入已配好的100 μL液体培养基,放入铺有湿滤纸的培养皿中进行保湿培养。培养结束后,用解剖针小心取出已萌发的花粉块,将其置于花粉块壁解离试验效果最佳的溶液中进行处理,然后放在普通载破片上,加盖破片小心挤压,再置于Nikon光学显微镜下观察,每个视野观察的花粉数不少于50个,以花粉管长度大于花粉粒直径视为萌发,并选取50个花粉测定其花粉管长度。各处理均重复3次。
1.2.3 最佳培养条件的选择试验
采用10%蔗糖+0.1%硼酸+5 mg/L氯化钙+15 mg/L 6-BA的培养基;在培养温度分别为25、30、35和40 ℃,培养时间分别为1、2、3、6、12 h的条件下,对牛角瓜花粉进行离体培养试验,以确定其萌发和花粉管生长的最适条件。每个处理5个花粉块,重复3次。
1.2.4 不同培养基的选择试验
以5 mg/L的氯化钙和15 mg/L的6-BA为基本培养基,采用L9(34)的正交试验设计,以培养基中的蔗糖(A)、硼酸(B)两个成分作为试验因素,就其各个试验水平对牛角瓜花粉离体萌发的影响情况进行正交试验,试验因素与水平详见表1。每个处理5个花粉块,重复3次。

表 1 不同培养基对牛角瓜花粉离体萌发影响的正交试验因素与水平Table 1 Factors and levels of the orthogonal test of the effectof differentmedia on germination in vitro of C.gigantean pollens %
1.3 数据分析
采用SPSS 19.0软件对试验结果进行多重比较及显著性分析。
2 结果与分析
2.1 不同溶液处理对花粉块壁解离效果的影响
萌发后的花粉仍被蜡质薄膜所包裹(如图1A所示),为了计算牛角瓜花粉的萌发率及测量花粉管的长度,有必要解离这层薄膜以释放出花粉粒来。本研究选取了不同浓度的NaOH、HCl及NaClO溶液和蒸馏水、二甲苯、乙酸异戊酯这六种溶液对牛角瓜花粉块壁进行解离试验。不同浓度的溶液处理对牛角瓜花粉块壁解离程度的影响情况见表2。由表2可知,在处理5 min时,20%的NaOH溶液对牛角瓜花粉块壁的分离效果最好,其次分别为5%、10%的 NaOH溶液,而蒸馏水、乙酸异戊酯溶液对牛角瓜花粉块壁均无解离作用。在处理10 min时,10% 和20%的NaOH溶液对牛角瓜花粉块壁的解离效果同时达到最佳,5%的HCl、5%的NaOH溶液与5%、10%的NaClO溶液次之,而蒸馏水、乙酸异戊酯溶液对牛角瓜花粉块壁均没有解离作用。在处理20 min时,10%和20%的NaOH溶液对牛角瓜花粉块壁的解离效果都是最好的,5%的NaOH溶液次之,5% 的HCl 及 5%、10%的NaClO溶液的解离效果均较好,而蒸馏水、乙酸异戊酯溶液对牛角瓜花粉块壁仍然没有解离作用。因此,以10% 的NaOH溶液对牛角瓜花粉块壁处理10 min的解离效果的最好。

表 2 不同浓度溶液对牛角瓜花粉块壁的解离效果†Table 2 Dissociation degrees of C. gigantean pollinia block in different concentrations of solutions
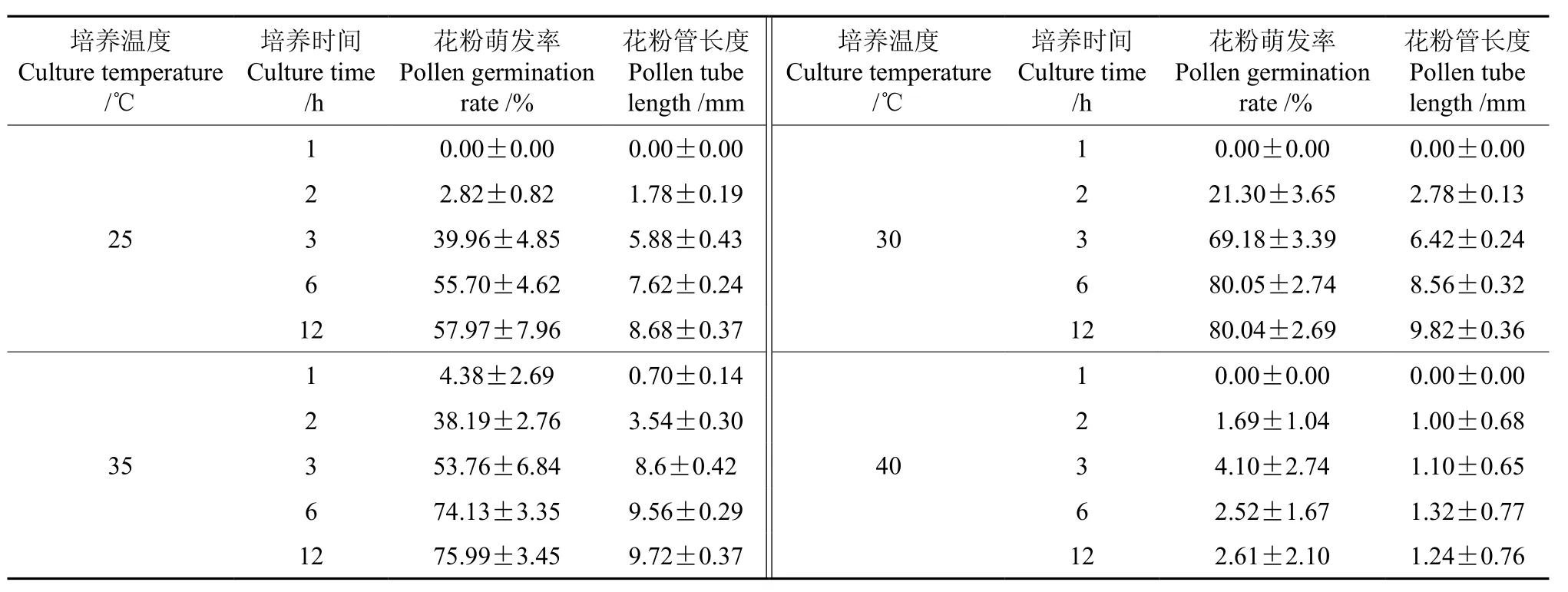
表 3 不同培养温度与培养时间对牛角瓜花粉萌发率及花粉管长度的影响†Table 3 Effect of different culture temperature and time on pollen germination rate and pollen tube length in C. gigantean
2.2 不同培养条件对牛角瓜花粉萌发和花粉管生长的影响
采用10%蔗糖+0.1%硼酸+5 mg/L氯化钙+15 mg/L 6-BA的培养基,在不同温度(25、30、35、40 ℃)下分别培养 1、2、3、6、12 h,就不同培养温度与培养时间对牛角瓜花粉萌发率及花粉管长度的影响情况进行了试验,结果如表3。表3表明:当培养温度为25 ℃时,花粉生长较为缓慢,培养0~12 h花粉的萌发率一直处于升高状态,花粉管长度也一直处于增加状态,但萌发率及花粉管长度均较低,培养12 h花粉的萌发率为57.97%,花粉管长度为8.68 mm。当培养温度为30 ℃时,花粉生长良好,培养0~6 h花粉萌发率显著升高,花粉管长度也增长得很快,培养6 h和培养12 h的花粉萌发率基本一致,说明花粉在培养温度为30 ℃、培养时间为6 h的萌发率已经达到最高值;花粉管长度在培养6~12 h时的增长速率也显著减缓,在培养12 h时花粉萌发率为80.04%,花粉管长度为9.82 mm。在培养0~6 h这个时间段花粉萌发率升高很快,花粉管长度增加也较快,而培养6~12 h花粉萌发率的升高变得缓慢,花粉管长度的增加也变得缓慢;在培养12 h时花粉萌发率达到75.99%,花粉管长度为9.72 mm,同时有部分花粉的内含物溢出(如图1 C所示)。由此可见,在培养12 h 时,培养温度为35 ℃的花粉萌发率和花粉管长度比培养温度为30 ℃时的都要低,说明35 ℃的培养温度对花粉的生长起到了一定的抑制作用。当培养温度为40 ℃时,花粉生长明显受到抑制,在培养12 h时花粉萌发率为2.61%,花粉管长度为1.24 mm,同时花粉中的内含物溢出,40 ℃的培养温度已超过促使牛角瓜花粉萌发的适宜温度,这一培养温度可使花粉失活。由此证明,牛角瓜花粉萌发的最适培养温度为30 ℃。
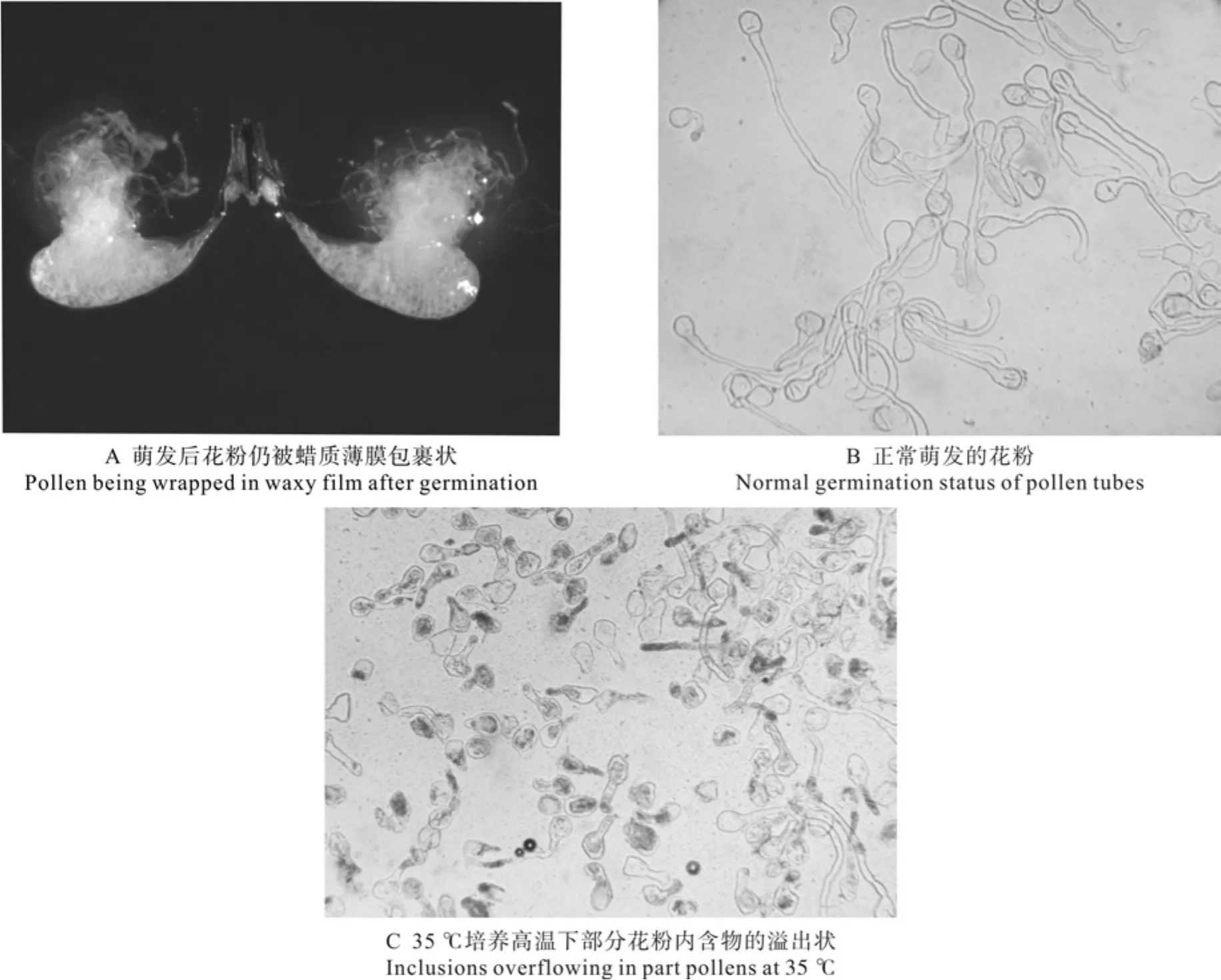
图 1 牛角瓜花粉离体萌发状态Fig. 1 Germination in vitro status of C. gigantean pollens

图2 不同培养温度与培养时间下牛角瓜花粉萌发率和花粉管长度的变化曲线Fig. 2 Change curves of pollen germination rate and pollen tube length in C. gigantean at different culture temperatures and time
不同培养温度与培养时间下牛角瓜花粉萌发率和花粉管长度的变化曲线如图2所示。由图2可知,在培养1~2 h内,35 ℃下花粉萌发率的升高最快,且花粉管长度的增长速率最快;在培养2~3 h内,30 ℃下花粉萌发率的升高速度最快,35 ℃下花粉管长度的增长速率最快;在培养3~6、6~12 h这两个时间段内,25、30、35 ℃下牛角瓜的花粉萌发率和花粉管长度的增长速度都显著降低,40 ℃时牛角瓜的花粉大部分失活,花粉萌发率及花粉管长度都显著低于其它温度条件下的。在25、30、35 ℃下,花粉萌发的持续时间分别为12、6、12 h,其最高萌发率分别为57.97%、80.05%、75.99%,花粉管长度最大值均出现在培养12 h时,分别为8.68、9.82、9.72 mm。花粉在30、35℃的温度条件下培养6 h后其萌发率趋于稳定,花粉管长度比较适中,已能表现出牛角瓜花粉萌发的状态,因此,牛角瓜花粉萌发的最佳培养温度为30 ℃,最佳培养时间为6 h。
2.3 不同培养基对牛角瓜花粉萌发率和花粉管长度的影响
将装有花粉块的培养基在30℃的条件下暗培养6 h后置于光学显微镜下观察计数,不同培养基处理组合下牛角瓜花粉的平均萌发率及花粉管长度见表4。由表4可知,A3B2处理组合的花粉萌发率最高,达到94.77%,与其它各处理组合间的差异极显著;A3B3处理组合的花粉管长度最长,为11.87 mm,与处理A3B1组合间的差异显著,与其它各处理组合间的差异极显著;而处理A1B3组合的花粉萌发率及花粉管长度均最低,花粉萌发率为12.43%,与其他各处理间呈极显著差异,花粉管长度为6.44 mm,与处理A1B1间呈显著差异,与其他各处理间呈极显著差异。在整个试验过程中,没有发现花粉管生长畸形的现象。

表 4 不同培养基处理组合间牛角瓜花粉萌发率和花粉管长度邓肯多重比较(LSR)†Table 4 Dancun multiple comparisons of pollen germination rates and pollen tube lengthes in C. gigantean between different medium treatment combinations
2.4 蔗糖、硼酸的不同质量浓度对牛角瓜花粉离体萌发的影响
对牛角瓜花粉离体萌发试验结果进行方差分析,结果见表5。由表5 可知,蔗糖浓度不仅对牛角瓜花粉萌发率的影响达到极显著水平,而且对其花粉管长度生长的影响也达到了极显著水平;硼酸质量浓度则只对花粉萌发率的影响达到极显著水平,而对花粉管长度生长的影响却不显著。由此说明,蔗糖和硼酸的质量浓度对花粉萌发率均有重要影响,蔗糖对花粉管生长具有重要影响,而硼酸对花粉管生长的影响却不大。

表 5 牛角瓜花粉离体萌发试验结果的方差分析†Table 5 Variance analysis of germination in vitro result of C. gigantean pollens
对牛角瓜花粉离体萌发试验结果进行极差分析,结果见表6。由表6 可知,参试培养基中的两种元素对牛角瓜花粉萌发率和花粉管长度影响的主次顺序为:蔗糖>硼酸。由此可以看出,培养基中的蔗糖浓度对花粉萌发率和花粉管长度的影响最大,而硼酸质量浓度的影响较小。根据蔗糖和硼酸极差值的大小可以得出,蔗糖浓度水平对牛角瓜花粉萌发率和花粉管长度的影响的大小次序是:K3>K2>K1。硼酸浓度水平对牛角瓜花粉萌发率和花粉管长度的影响的大小次序是:K2>K3>K1。文中的K表示不同浓度水平,K3表示高浓度水平,K2表示中等浓度水平,K1表示低浓度水平。由此得出,最适合牛角瓜花粉萌发的处理组合是A3B2,即20%蔗糖+0.1%硼酸。

表 6 蔗糖和硼酸对牛角瓜花粉离体萌发影响的极差分析†Table 6 Rang analysis of effect result of sucrose and boric acid on germination in vitro of C. gigantean pollens
3 结论与讨论
牛角瓜的花粉是由一层薄膜包裹形成的花粉块,这层薄膜能使花粉块较长时间地保持活力,并能使花粉块扩散到更远的地方,因此,牛角瓜花粉粒外面这层薄膜即花粉块壁在自然条件下有利于花粉的传播,但在牛角瓜花粉离体萌发的试验中,花粉萌发后需要去除花粉块壁以方便统计花粉萌发数以及测量花粉管长度。本研究结果表明,将花粉块壁放在10%的NaOH溶液中处理10 min,这样最容易剥离。
花粉离体萌发需要特定的培养条件,如培养温度、培养时间、培养基及其pH值等。每种植物花粉的萌发和花粉管的生长都有自己最适的温度。如薄壳山核桃[9]花粉离体萌发和花粉管生长的最适温度为25 ℃,光皮桦[10]、桔梗[11]花粉离体萌发最适培养温度为30 ℃,魔芋[12]花粉的适宜培养温度为26~28 ℃。笔者研究结果显示,牛角瓜花粉萌发的最佳温度为30 ℃,最佳培养时间为6 h。可见,对于不同树种而言,其适宜的花粉离体萌发温度存在差异,应根据具体树种选择适宜的培养条件。培养温度和培养时间对牛角瓜花粉离体萌发和花粉管生长均有显著的影响,花粉萌发率和花粉管长度随着培养温度的升高均表现出先增加后降低的变化趋势,这与蒲光兰等人[6]对麻疯树花粉离体萌发的试验结果一致。培养基的pH值对牛角瓜花粉离体萌发的影响还有待于进一步的研究。
花粉离体萌发所需培养基的成分主要是蔗糖和硼酸[13-14]。大多数研究者的研究结果[9,15-16]均表明,蔗糖是许多植物花粉离体培养所必需的重要营养成分。蔗糖不仅能够为花粉萌发和花粉管生长提供营养物质,也能够提供花粉萌发所需的渗透压[17]。研究中发现,蔗糖浓度对牛角瓜的花粉萌发及花粉管生长均有极显著的影响,当其质量浓度达到20% 时,其对牛角瓜花粉萌发的效果最佳。适宜的蔗糖浓度能促进牛角瓜花粉的萌发,随着蔗糖添加量的加大,花粉萌发率逐渐上升,这与李贵荣等人[18]研究的火焰无核葡萄花粉离体萌发试验结果一致。但蔗糖浓度应控制在一定范围内,浓度过低则花粉壁易破裂,而浓度过高又会造成代谢物堆积抑制萌发,王改萍等人[19]在对楸树等4种梓属树种的花粉离体培养中发现,蔗糖浓度过高则对花粉萌发率及花粉管生长均有一定的抑制作用。所以,培养基中蔗糖的质量浓度不能过高,过高会出现质壁分离现象。在本次试验中未发现质壁分离的现象,说明蔗糖的质量浓度设置较合理。
缺硼可以导致花粉管破裂[20]。在自然条件下,花粉中硼素的质量浓度是不足的,这种不足可通过较高质量浓度的柱头和花柱内的硼酸来补偿[21]。而在离体培养条件下,适宜的硼酸处理能有效提高花粉的萌发率,促进花粉管生长[10,22-23]。硼酸的质量浓度对牛角瓜的花粉萌发具有极显著的影响,而其对花粉管生长的影响却不显著,当硼酸的质量浓度为0.1%时,其对牛角瓜花粉萌发的效果最好,花粉萌发率和花粉管长度显著高于其他两个处理水平的;当其质量浓度达到0.2%时,硼酸对牛角瓜花粉萌发产生了一定的抑制作用,但对花粉管生长却最好。这一结果说明,一定质量浓度的硼酸能够促进牛角瓜花粉的萌发和花粉管的生长,超过一定质量浓度反而会起到抑制作用,这与何春燕等人[24]研究的7种油茶花粉萌发的试验结果相一致。
综上所述,牛角瓜花粉萌发和花粉管生长的最适培养基为20%蔗糖+0.1%硼酸+5 mg/L氯化钙+15 mg/L 6-BA。在此培养基上,并在30 ℃的温度条件下培养6 h,其花粉萌发率达到94.77%,花粉管长度为11.07 mm。参考文献:
[1]魏 静,赵元藩,张燕平.牛角瓜的栽培管理技术及应用前景[J].林业调查规划,2013,(2):112-115.
[2]Asbofi A, Bahreini Z. Evaluation of calotropis gigantea as a promising raw material for fi ber-reinforced composite[J].Journal of Composite Materials,2009,43(11):1297-1304.
[3]P Suresh Kumar, A Chezhian, P Senthil Raja,et al.Computational selections of terpenes present in the plantCalotropis giganteaas mosquito larvieide’s by blocking the sterol carrying protein,AeSCP-2[J].Bangladesh J Pharmacol,2012,7: l5.
[4]Kattankulathur, Kancheepuram DT, Tamilnadu. Antimicrobial Activity Of Leaves And Latex Extract Of The Herbal PlantCalotropis Gigantea(Erukku In Tamil)[J].IJBPAS, April, 2012,1(3):261-270.
[5]李 瑞,曾建立,王晓东,等.耐盐碱植物牛角瓜产能成分分析[J].过程工程学报,2007,7(6):1217-1220.
[6]蒲光兰,周兰英,李瑾宵,等.温度、蔗糖和硼酸对麻疯树花粉离体萌发的影响[J].西北林学院学报,2011,6(3):25-58.
[7]Kim O R, Kwon S, Kim K S,et al. Reliable methods for evaluating pollen viability and temperature effect on pollen storability inViola lacti fl ora[J].Journal of the Korean Society for Horticultural Science, 2003,44(1):10-12.
[8]郭 庆,王德斌,翟书华,等.海枫藤花粉块壁剥离与花粉形态探究[J].昆明师范高等专科学校学报, 2007,29(4):82-83.[9]张 瑞,李 洋,梁有旺,等.薄壳山核桃花粉离体萌发和花粉管生长特性研究[J].西北植物学报,2013,33(9):1916-1922.
[10]刘 宝,赵志刚,程 伟,等.光皮桦花粉离体萌发试验[J].广西植物,2009,29(2):264-268.
[11]刘自刚,呼天明,杨亚丽,等.桔梗花粉萌发与花粉管生长研究[J].植物研究,2011,31(3):271-276.
[12]李勇军,王 玲,陈建华,等.魔芋花粉离体萌发及花粉管生长的研究[J].西南农业学报,2011,24(6):2316-2320.
[13]程 伟,张志刚,曾 杰,等.西南桦花粉离体萌发的适宜条件与萌发特性[J].林业科学研究,2007,2(2):209-212.
[14]李志强,刘国峰,罗春丽,等.悬铃木花粉生活力及贮藏力的研究[J].武汉植物研究,2006,24(1):54-57.
[15]龚双姣,马陶武,刘 强.培养基组分及培养条件对蜡梅花粉萌发及花粉管生长的影响[J].西北植物学报, 2012, 32(6):1254-1260.
[16]刘雪莲,李庆玲,秦佳梅,等.不同培养基对紫丁香花粉离体萌发的影响[J].东北林业大学学报,2010,38(7):61-63.
[17]杜纪红,叶正文,苏明申,等.桃花粉离体萌发和花粉管生长特性研究[J].西北植物学报,2011,(1):64-71.
[18]李贵荣,朱自果,李 力,等.火焰无核葡萄花粉离体萌发试验[J].西北林学院学报,2012,27(6):93-97.
[19]王改萍,杨红宁,倪果果,等.楸树等4种梓属树种花粉离体培养条件的研究[J].植物资源与环境学报,2009,18(2):34-42.[20]曾丽霞,艾应伟.硼对花粉生物化学功能影响的研究进展[J].中国土壤与肥料,2008,(3):9-11.
[21]年玉欣,罗凤霞,张 颖,等.测定百合花粉生命力的液体培养基研究[J].园艺学报,2005,(5):157-160.
[22]黄桂华,梁坤南,周再知,等.柚木花粉离体萌发试验[J].林业科学研究,2011,24(4):527-530.
[23]金亚征,忻龙祚,王建民,等.培养基成分对仁用杏花粉离体萌发的影响[J].经济林研究,2014,32(1):101-106.
[24]何春燕,谭晓风,袁德义,等.7种油茶花粉数量及花粉萌发率的测定[J].中南林业科技大学学报,2009,29(1):74-78.
Germinationin vitroofCalotropis giganteanpollens
LIU Peng, ZHANG Tai-kui, WANG Lian-chun, ZHENG Yuan, YE Wei-yan, LIU Hui-min
(Forestry College, Southwest Forestry University, Kunming 650224, Yunnan, China)
In order to research the optimal conditions and medium ingredients for germinationin vitroofCalotropis giganteanpollen, taking fresh pollens in two-year old plants as materials, the effects of different solutions on dissociation degree of pollinia block were studied. The effects of culture temperature, culture time, and medium ingredients on pollen germination rate and pollen tube growth inC. giganteanwere researched by usingin vitroculture method. The results showed that: The best dissociation degree was achieved in the treatment of pollinia soaked in 10% NaOH for 10 minutes.The optimum temperature for pollen germinationin vitrowas 30 ℃, and germination rate was stable after cultured 6 hours and pollen tube grew well after cultured 12 hours at the temperature. The effects of sucrose on pollen germination rate and pollen tube length were greater than boric acid. The pollen germination rate reached 94.77% and the pollen tube length was 11.07 mm after 6 hours cultured on the optimal culture medium supplemented with 20% sucrose, 0.1% boric acid, 5 mg/L calcium chloride and 15 mg/L 6-BA at 30 ℃.
Calotropis gigantean; pollinia block; pollen germination; pollen tube growth;in vitroculture
S661.9
A
1003—8981(2015)02—0142—07
2014-12-15
林业公益性行业科研专项(201304810)。
刘 鹏,硕士研究生。
刘惠民,教授,博士。E-mail:hmliu@swfu.edu.cn
刘 鹏,张太奎,王连春,等.牛角瓜花粉离体萌发研究[J].经济林研究,2015,33(2):142-148.
10.14067/j.cnki.1003-8981.2015.02.025
http: //qks.csuft.edu.cn
[本文编校:伍敏涛]
