HPLC-TOF-MS分析泽泻提取物中三萜类化合物*
2015-01-05邓岳刘阿娜王小明周洪雷李运伦蒋海强
邓岳,刘阿娜,王小明,周洪雷,李运伦,蒋海强
(1. 山东中医药大学,济南 250355; 2. 山东中医药大学附属医院高血压病中医临床研究中心,济南 250011;3. 山东中医药大学实验中心,济南 250355)
HPLC-TOF-MS分析泽泻提取物中三萜类化合物*
邓岳1,刘阿娜1,王小明1,周洪雷1,李运伦2,蒋海强3
(1. 山东中医药大学,济南 250355; 2. 山东中医药大学附属医院高血压病中医临床研究中心,济南 250011;3. 山东中医药大学实验中心,济南 250355)
分析和鉴定泽泻提取物中的化学成分。釆用高效液相色谱与飞行时间质谱联用技术(HPLC-TOF-MS),在正离子检测模式下用全扫描方式获得高分辨质谱数据,结合Agilent Mass Hunter Qualitative Analysis软件、PCDL、数据库和参考文献,总结已知化学成分的质谱裂解规律,对泽泻中的三萜类成分进行定性鉴别。泽泻提取物中共鉴定了22种三萜化合物。实验结果为泽泻的物质基础及质量控制研究提供了理论依据。
泽泻;三萜类;化学成分;高效液相色谱与飞行时间质谱联用技术
泽泻为泽泻科植物泽泻[Alisma orientalis (Sam.) Juzep.]的干燥块茎,性寒味甘,具有利水渗湿、泄热的功效,可用于小便不利、水肿胀满、痰饮眩晕、高脂血等症[1]。现代研究表明其具有利尿[2]、降血脂[3]、抗氧化、保肝[4]的作用。三萜类化合物是泽泻的主要化学成分,如泽泻醇A(alisol A)及其衍生物24-乙酰泽泻醇A等,具有一系列药理活性[5-7]。高效液相色谱与飞行时间质谱联用(HPLC-TOF-MS)法分辨能力强,在全扫描的模式下可保证微量成分不被遗失,从而获得大量、有效的化合物结构鉴定信息,是一种快速有效的化合物鉴定方法[8-9]。
目前对泽泻整体药效机制评价与总体药物化学成分研究较多,但采用HPLC-TOF-MS法对其中的三萜类化合物的系统研究尚不多见。因此为了进一步明确泽泻的药效物质基础,笔者对泽泻的有效成分进行了提取,采用HPLC-TOF-MS法对泽泻提取物中的三萜类化合物进行全面系统的定性鉴定,建立药材质谱指纹图谱,为泽泻的综合利用开发提供理论参考。
1 实验部分
1.1 主要仪器与试剂
高效液相色谱-飞行时间质谱仪:Agilent 1260 LC-6230 TOF-MS型,美国安捷伦公司;
纯水系统:Milli-Q型,美国Millipore公司;
分析天平:CP225D型,德国SARTORIUS公司;
泽泻药材:泽泻的干燥块茎;
24-乙酰泽泻醇A对照品:批号18674-16-3,20 mg/支,纯度不小于98%,色谱纯,北京宝赛希望生物科技有限公司;
23-乙酰泽泻醇B对照品:批号26575-95-1,20 mg/支,纯度不小于98%,北京宝赛希望生物科技有限公司;
乙腈、甲醇:色谱纯,德国Merck公司;
甲酸:色谱纯,美国Fisher公司;
实验用水为超纯水;
实验用其它试剂均为分析纯。
1.2 对照品溶液的制备
取24-乙酰泽泻醇A及23-乙酰泽泻醇B对照品适量,精密称定,加甲醇溶解,定容至25 mL容量瓶中,稀释至所需浓度,经0.45 μm微孔滤膜过滤后备用。
1.3 供试品溶液的制备
将干燥的泽泻药材1.0 kg粉碎,过3号筛。每次准确称取泽泻粗颗粒500 g,加入以10倍药材量的95%乙醇加热回流提取3次,每次1.0 h,合并提取液,回收乙醇。药渣再以10倍量的水加热回流提取3次,每次1 h,合并提取液,蒸发水分。合并提取物并浓缩为浸膏(每mL含有1 g泽泻生药)。将药材浸膏用甲醇溶解、稀释,经0.45 μm微孔滤膜过滤,即得浓度为50 mg/mL的泽泻供试品溶液。
1.4 色谱条件
色 谱 柱:Halo C18柱(100 mm×2.1 mm,2.7 μm,美国AMT公司);柱温:25℃;流动相:0.1%甲酸水溶液(A)-乙腈(B),流速为0.3 mL/min;进样体积:2 μL;梯度洗脱:0~3 min 5% B,3~12 min 5%~12% B,12~29 min 12%~16% B,29~39 min 16%~18% B,39~49 min 18%~21% B,49~53 min 21%~25% B,53~58 min 25%~30% B,58~65 min 30%~36% B,65~73 min 36%~42% B,73~79 min 42%~52% B,79~83 min 52%~65% B,83~98 min 65%~75% B,98~100 min 100% B。
1.5 质谱条件
采用ESI离子源,在正离子模式下进行检测。毛细管电压:4 000 V;干燥气流速:11 L/min;喷雾气压力:241.3 kPa(35 psi);干燥气温度:350℃;碎片电压:90,180,30,360 V;数据采集范围:m/z50~1 000;选取m/z121.050 9,922.009 8的内标离子作参比离子。每次测定样品前,采用调谐液(Turning mixture)校准质量轴。
2 结果与讨论
2.1 药材提取方法的建立
泽泻药材发挥其药理作用的有效成分主要为泽泻三萜类化合物,属于醇溶性物质,大多采用乙醇提取工艺[10-12]。采用10倍量乙醇加热回流提取,为最大限度地避免目标成分的遗失,再对药渣采取10倍量的水加热回流提取,使药材中可能存在的苷类物质也能被提取得到。
2.2 流动相的选择
在流动相的筛选过程中,使用乙腈作为有机相,水相的选择分别对正离子模式下0.1%甲酸溶液,3 mmol/L乙酸铵溶液,3 mmol/L乙酸铵-0.2%乙酸溶液,5 mmol/L乙酸铵-0.1% 氨水(pH 7.0)体系及负离子模式下的0.1%甲酸溶液进行考察。结果表明采用正离子模式下0.1%甲酸溶液可以获得较好的峰形和分离度,质谱响应良好。故选用正离子模式下0.1%甲酸溶液-乙腈作为流动相进行梯度洗脱。
2.3 碎裂电压的选择
在质谱分析过程中同时设置90,180,300,360 V 4个离子源内碎裂电压,使化合物分子吸收能量后产生电离,生成分子离子,之后进一步按照化合物自身特有的碎裂规律分裂,适当增加碎裂电压,减少簇离子的产生,并同时得到一系列典型的与结构相关的碎片离子信息,便于质谱数据的解析。
2.4 定性方法的建立
2.4.1 数据处理软件
泽泻中存在的萜类成分极性较小,在95 min内得到了较好的有效分离,正离子模式下的特征离子主要为[M+H]+和[M+Na]+,通过一级质谱获得了高分辨的质核比,利用Agilent Mass Hunter Qualitative Analysis软件在查找到化合物的精确质量数后,将质谱测量误差设置在±5×10-6范围内,计算出该质荷比所代表的化合物可能的元素组成,筛选最可能的化合物分子式,观察其同位素分布情况并进行验证。
2.4.2 数据库的建立
通过泽泻化学成分研究文献及NCBI,CNKI,CA国内外专业数据库等收集了泽泻[6-7,13-19]中的106个化合物,采用安捷伦PCDL软件建立包括化合物名称、分子式、精确相对分子质量的相应的化学成分数据库。通过检索PCDL化合物数据库以及与文献总结中列出的化学成分再次比对,初步推断泽泻供试品溶液中的化学成分。
2.4.3 标准品比对
采用标准品23-乙酰泽泻醇B及24-乙酰泽泻醇A在相同条件下进行对照试验,通过与对照品的保留时间、分子离子和特征碎片离子比对可以确定,在正离子模式下91.077,84.473 min处分别为23-乙酰泽泻醇B及24-乙酰泽泻醇A。
2.5 成分鉴定结果
泽泻提取物的HPLC-TOF-MS总离子流图见图1。三萜类成分结构母核相同,是一类基本母核由30个碳原子组成的化合物。泽泻中的三萜类成分多为原萜烷型四环三萜[5],其结构具有一定的特征,如C-10位和C-14位上有β-CH3,C-20位上有S构型等,在质谱裂解中呈现一定的规律性。TOF-MS质谱数据及归属见表1,共鉴别出22种化合物。
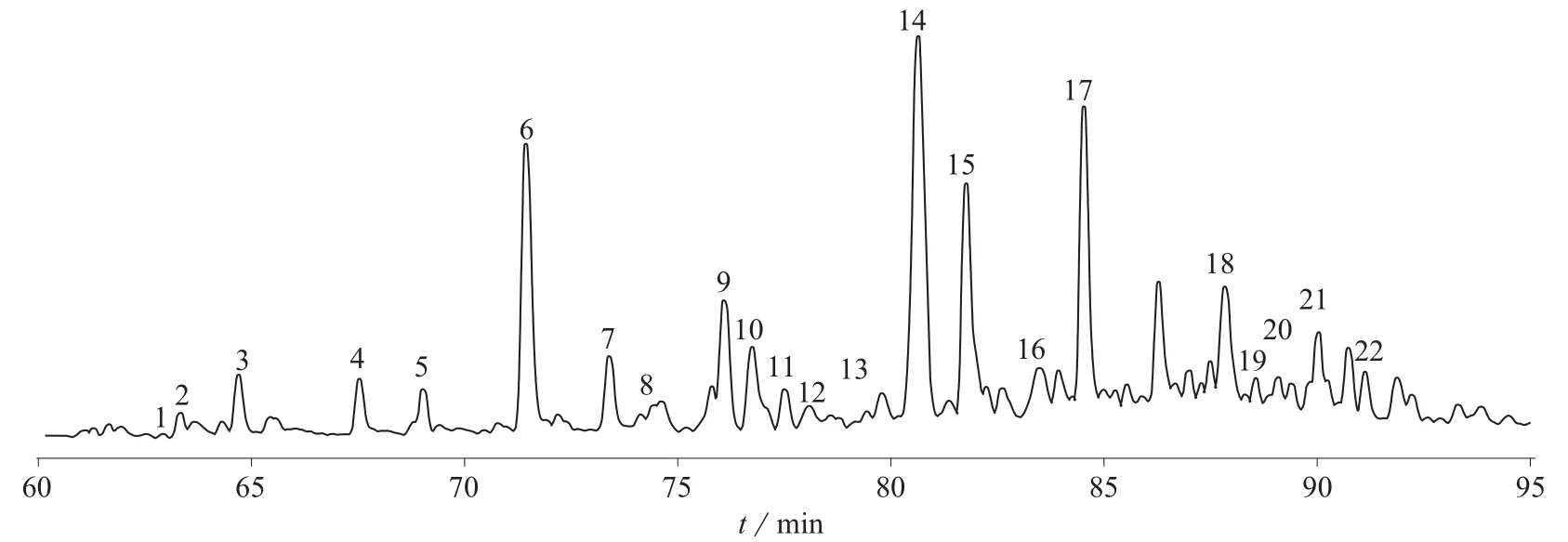
图1 泽泻提取物的HPLC-TOF/MS总离子流图
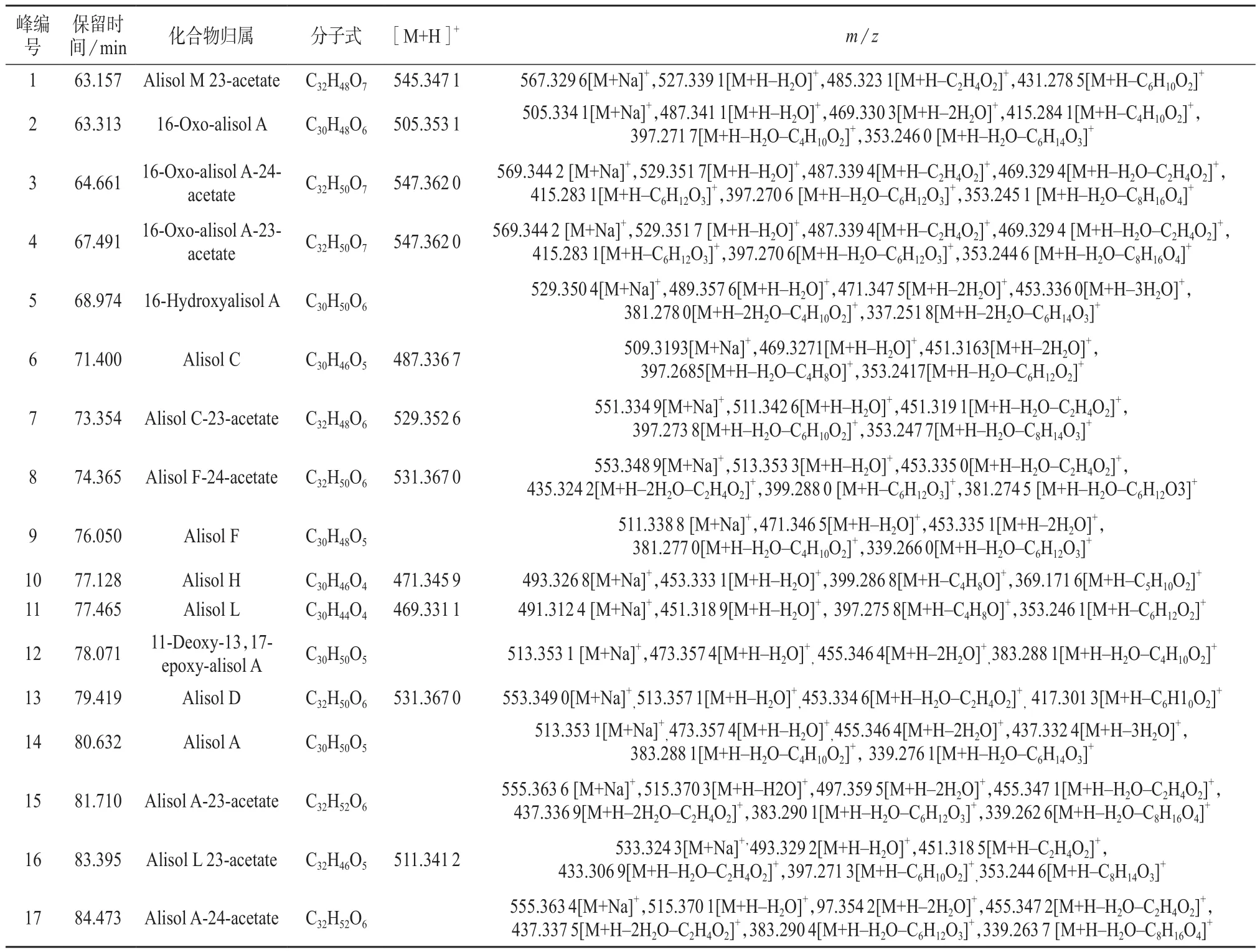
表1 泽泻的化学成分鉴别结果
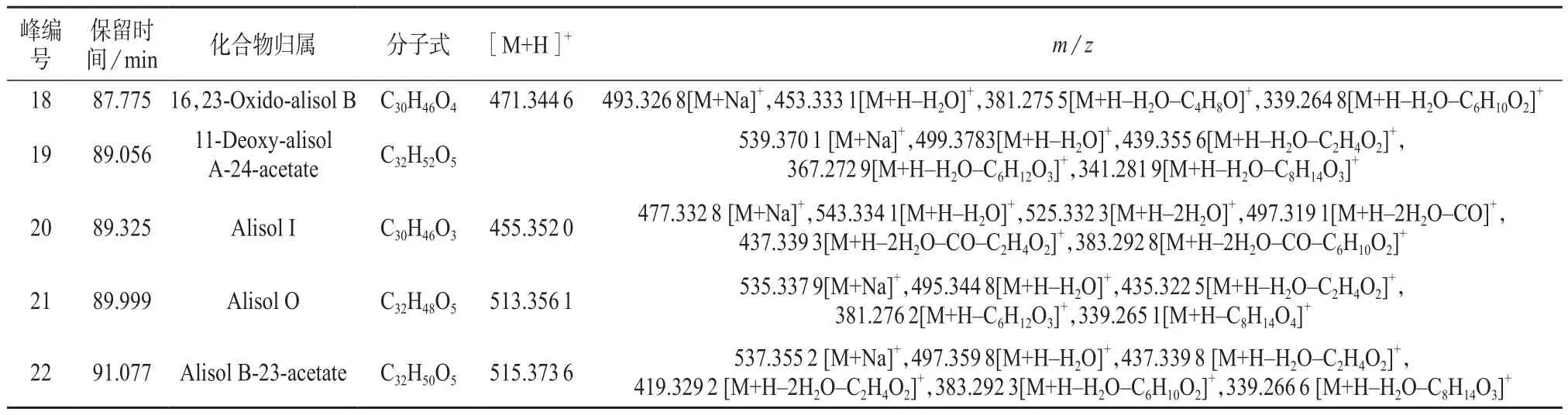
续表1
3 结语
采用HPLC-TOF-MS法对泽泻提取物中的三萜类成分进行了系统的化学成分分析,共计鉴别了22种化合物,初步确定了泽泻提取物中的主要有效成分,为进一步深入研究泽泻的化学成分含量及开发应用提供一定的参考。
[1] 国家药典委员会.中华人民共和国药典:一部[M].北京:化学工业出版社,2010: 212.
[2] 贠洁.猪苓泽泻水煎液对家兔利尿作用的实验研究[J].亚太传统医药,2015,11(1): 4-5.
[3] 郁相云,钟建华,张旭.泽泻降血脂药理作用及物质基础[J].中国中医药现代远程教育,2010,8(11): 250.
[4] 付涛.泽泻汤降血脂、抗氧化及保肝作用有效部位的研究[D].湖北:湖北中医药大学,2012.
[5] 肖飞艳,冯育林,杨世林,等.泽泻化学成分的研究进展[J].中药新药与临床药理,2009,20(5): 491-495.
[6] 朱玉岚,彭国平.泽泻的萜类化学成分研究进展[J].天然产物研究与开发,2006,18: 348-351.
[7] 邱东凤.泽泻化学成分研究[D].甘肃:兰州大学,2009.
[8] 杨希,马葵芬,张幸国.质谱技术在中药成分鉴定中的应用[J].中国医药指南,2012,35(10): 61-62.
[9] 吕狄亚.中药莪术化学成分分析及药代动力学研究[D].上海:第二军医大学,2011.
[10] 王建平,傅旭春,白海波.泽泻降血尿酸乙醇提取物的工艺研究[J].中国中药杂志,2010,35(14): 1 809-1 811.
[11] 周本杰,莫轩辉.泽泻降脂有效部位提取工艺的筛选研究[J].中国药房,2006,17(2): 103-105.
[12] 朱照静,肖廷超,邱宗萌,等.泽泻脂溶性提取物吸收剂的研究[J].中成药,2001,13(1): 13.
[13] 王道武,刘志强,郭明全,等.黄连中小檗碱及其同分异构体的电喷雾质谱研究[J].分析化学,2003,31(9): 1 101-1 104.
[14] 赵新峰,孙毓庆.高效液相色谱-电喷雾-质谱法分析泽泻中的活性成分[J].中成药,2007,29(12): 1 805-1 807.
[15] Liu X,Li SL,Zhou Y,et al. Characterization of protostane triterpenoids in Alisma Orientalis by ultra-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry[ J]. Rapid Commun Mass Spectrom,2010,24: 1 514-1 522.
[16] Yu Y,Li Q,Bi K,et al. A sensitive liquid chromatography-mass spectrometry method for simultaneous determination of alisol A and alisol A 24-acetate from Alisma orientale (Sam.) Juz. in rat plasma[J]. Anal Bioanal Chem 2011,399: 1 363-1 369.
[17] Matsuda H,Kageura T,Toguchida I,et al. Effects of sesquiterpenes and triterpenes from the rhizome of Alisma orientale on nitric oxide production in lipopolysaccharideactivated macrophages: absolute stereostreostructures of alismaketones-B-23-acetate and-C 23-acetate[J]. Bioorg Med Chem Lett, 1999, 21: 3 081-3 086.
[18] 李琴.乌檀和泽泻的药效物质基础研究[D].浙江:浙江大学,2012.
[19] 巩丽萍.泽泻质量评价方法研究[D].山东:山东大学,2006.
中物院近4.5亿元科学仪器向社会开放
为进一步加速军民融合,助力创新创业,不久前,中物院大型科学仪器开放共享平台——中物院理化分析与无损检测协作网在绵阳上线。网站将整合中物院300余台套,总价值近4.5亿元的理化分析与无损检测设备向社会开放共享,为全国科研院所、科技企业提供全方位的分析检测技术服务。
此次对外开放的设备包括分析检测、性能测试、无损检测、计量、环境监测等10余种类,分析检测对象包括金属材料、高分子材料、无机材料、放射性材料、电子材料等多种金属及非金属材料;检测范围涉及生物医药、电子技术、机械加工、食品安全、航空航天、环保技术、汽车制造及新材料等领域。
此前国务院印发《关于国家重大科研基础设施和大型科研仪器向社会开放的意见》。意见指出,近年来,科研设施与仪器规模持续增长,技术水平明显提升。同时,科研设施与仪器利用率和共享水平不高的问题也逐渐凸显出来,闲置浪费现象比较严重。基于上述情况,意见要求,加快推进科研设施与仪器向社会开放,进一步提高科技资源利用效率。
(科学日报)
Analysis of the Triterpenes in the Extract of Alisma Orientalis (Sam.) Juzep by HPLC-TOF-MS
Deng Yue1, Liu Ana1, Wang Xiaoming1, Zhou Honglei1, Li Yunlun2, Jiang Haiqiang3
(1. Pharmacy College of Shandong University of Traditional Chinese Medicine, Jinan 250355, China; 2. Traditional Chinese Medicine Clinical Research Base for Hypertension of Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan 250011,
China; 3. Experimental Center of Shandong University of Traditional Chinese Medicine, Jinan 250355, China)
The chemical constituents of the extract of Alisma orientalis (Sam.) Juzep were analyzed and authenticated. HPLC-TOF-MS technology was applied for high resolution mass spectrometry data operated in positive ion mode in full scan mode. With Agilent Mass Hunter Qualitative Analysis software,PCDL database and references,separating components in Alisma orientalis (Sam.)Juzep,based on the summary of fragmentation regularities of known chemical composition, 22 triterpene compounds were identified. The experimental results further enrich the research content of the chemical composition and provide certain theoretical basis for material basis and quality control of Alisma orientalis (Sam.)Juzep.
Alisma orientalis (Sam.) Juzep; triterpenes; chemical constituent; HPLC-TOF/MS
O657.7
:A
:1008-6145(2015)06-0011-04
10.3969/j.issn.1008-6145.2015.06.003
*国家自然科学基金资助课题(81273700,81102549)
联系人:蒋海强;E-mail: jhq12723@163.com
2015-07-26
