大体积全自动固相萃取气相色谱-质谱法测定水中苯并芘
2015-01-05马小杰
马小杰
(临沂市环境监测站,山东临沂 276001)
大体积全自动固相萃取气相色谱-质谱法测定水中苯并芘
马小杰
(临沂市环境监测站,山东临沂 276001)
建立了全自动固相萃取-气相色谱-质谱联用测定水中苯并芘的方法。优化了全自动固相萃取条件,选择C8固相萃取柱萃取水样品中的苯并芘,样品中加入甲醇以增强苯并芘在萃取柱上的保留能力,采用正压大体积六通道同时进样,进样体积为1 000 mL,进样流量20 mL/min,使用二氯甲烷为洗脱溶剂,浓缩至0.5 mL。水中苯并芘的质量浓度在10~200 μg/L范围内与其质谱响应值线性关系良好,相关系数为0.995,检出限为2 ng/L。在20~200 μg/L加标水平上,苯并芘回收率为85.0%~94.5%,测定结果的相对标准偏差均小于6% (n=6)。该方法操作简单、测定结果准确,可用于水中苯并芘的测定。
全自动固相萃取;气相色谱-质谱联用;苯并芘;正压大体积
苯并芘是由5个苯环构成的多环芳烃,它可损伤DNA,造成细胞癌变,对内脏和神经系统造成损伤[1-7]。通过实验发现,苯并芘对儿童危害严重[8],且可通过母体对胎儿产生影响[9],已引起世界各国卫生组织和环境组织的高度重视。环境中的苯并芘存在于煤炭、石油、煤焦油等不完全燃烧的产物中,并随降雨进入地表水,此外焦化、炼油工业废水中也可能含有苯并芘[10-11]。我国在地表水质量标准[12]和污水的排放标准[13]中对苯并芘做了严格限制,其限值分别为2.8 ng/L和3 ng/L。
苯并芘的检测方法主要有液相色谱法、气相色谱法、色质联用法、荧光分光光度法等[14-17]。荧光分光光度法灵敏度较高,但需要纸层析,步骤烦琐,对于复杂样品分离效果较差。液相色谱法和气相色谱法依靠保留时间定性,可能会产生假阳性的结果。色质联用可获得到化合物的结构信息,定性分析结果较为可靠。由于苯并芘的水溶性较低,需要取大量水样行富集、浓缩,以获得较低的检测下限。苯并芘的提取方法目前主要有液液萃取法和固相萃取法[18-20]。液液萃取法使用大量有机溶剂,操作繁琐,且容易出现乳化现象;而固相萃取技术不仅节约时间,不易乳化,且减少了有机溶剂对实验人员的伤害和环境的污染[21]。固相萃取又分为手工法和全自动仪器法。手工固相萃取很难控制样品和洗脱溶剂通过固相萃取柱的速度,致使回收率的重现性差,全自动固相萃取仪可自动完成活化、上样、淋洗、洗脱、收集等步骤。笔者使用正压大体积六通道固相萃取仪处理水样,上样速度快,可同时处理6个样品,使用气相色谱质谱仪对水中目标化合物定性和定量,避免了液相色谱法使用溶剂转换以及不能准确定性的缺点[22]。
1 实验部分
1.1 主要仪器与试剂
气相色谱质谱仪:Thermo Trace DSQⅡ型,美国Thermo Fisher Scientific公司;
进 样 器:Triplus HS型,美 国Thermo Fisher Scientific公司;
全自动固相萃取仪:Dionex Auto Trace-280型,美国Thermo Fisher Scientific公司;
固相萃取柱:PROELUT C8(500 mg/6 mL),北京迪马欧泰科技发展中心;
固相萃取柱:PROELUT C18(500 mg/6 mL),北京迪马欧泰科技发展中心;
甲醇、二氯甲烷、乙酸乙酯、异丙醇:农残级,美国TEDIA公司;
无水硫酸钠:优级纯,使用前于400℃下加热6 h,上海国药集团;
甲醇中苯并芘标准溶液:100 μg /mL,美国Accu Standard公司;
实验用水为超纯水。
1.2 仪器工作条件
1.2.1 色谱条件
色谱柱:HP-5MS(30 m×0.25 mm,0.25 μm,美国Agilent公司);进样口温度:280℃;传输线温度:270℃;不分流进样;载气:99.999%高纯氦气,流量为1.0 mL/min;升温程序:初始温度80℃保持2 min,以12℃/min升温至270℃,保持10 min;进样体积:1 μL。
1.2.2 质谱条件
EI 源;离子源温度:250℃;电子能量:70 eV;定性方式:全扫描,质量范围为m/z35~450;定量方式:选择离子检测,定量离子为m/z252。
1.3 样品保存与处理
使用棕色玻璃瓶采集样品,水样充满样品瓶。对于含余氯的样品,加入硫代硫酸钠(每1 000 mL水样加80 mg),在不大于4℃条件下冷藏避光保存。在进行固相萃取操作前加入0.5%甲醇。
分别用5 mL乙酸乙酯、5 mL二氯甲烷预洗萃取柱(去除填料中的干扰物),用10 mL甲醇、10 mL水活化萃取柱(使样品与填料表面更好地接触),以20 mL/min的流速使1 000 mL样品通过萃取柱,以10 mL水淋洗柱子(去除水溶性杂质),氮气干燥萃取柱10 min,5 mL二氯甲烷洗脱,洗脱时空气注射流量为5 mL/min,收集洗脱液。洗脱液使用无水硫酸钠干燥,氮吹浓缩至0.5 mL。
1.4 标准曲线绘制
将100 μg/mL的苯并芘标准溶液稀释配制成1 μg/mL的苯并芘标准中间溶液,将中间溶液稀释为10,20,50,100,200 μg/L标准使用液,用二氯甲烷定容。在选择离子扫描模式下,依次从低浓度到高浓度测定,以定量离子m/z252响应值为纵坐标,苯并芘质量浓度为横坐标绘制标准曲线。
2 结果与讨论
2.1 色谱条件的选择
根据苯并芘的结构特点,试验选择弱极性的DB-5MS柱。采用不分流进样模式,可降低方法检出限。苯并芘沸点较高,适当提高进样口温度有利于化合物的汽化,设置进样口温度为280℃。按1.2.1的色谱条件进行全扫描,确定苯并芘的保留时间,选取其特征离子扫描,提高分析灵敏度。图1为苯并芘标准品总离子流图,图2为苯并芘标准溶液质谱图。

图1 苯并芘标准溶液总离子流图
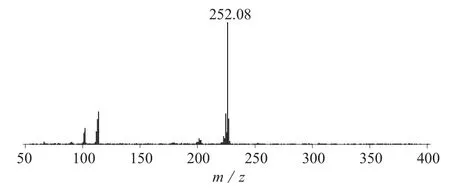
图2 苯并芘标准溶液质谱图
2.2 固相萃取条件优化
2.2.1 固相萃取柱的选择
试验选择C8和C18两种固相萃取小柱,对添加标准溶液的水样(100 ng/L)进行前处理,其它条件不变,使用气相色谱质谱仪测定并计算回收率。结果表明,使用C18填料时苯并芘的回收率为81%,而使用C8填料时回收率在87%左右,故实验选用C8柱。
C8和C18是疏水性最强的硅胶基体吸附剂,对非极性化合物都有较强的保留能力,使用较为广泛。苯并芘为弱极性物质,故选择适合非极性到中等极性物质萃取的C8和C18小柱,C18对极性弱的物质的保留能力强,而C8的碳链较短,保留能力相对弱,目标化合物更易洗脱。
2.2.2 进样流量的选择
进样流量分别设为10,20,30,40 mL/min,其它条件不变,使用气相色谱质谱仪测定并计算回收率。图3为进样流量与回收率的关系。进样流量为10 mL/min和20 mL/min时回收率差别不大;进样流量为30 mL/min和40 mL/min时回收率明显下降,说明过快的进样流量,会降低目标化合物在固相萃取柱上的吸附率,同时为减少样品处理时间,综合考虑采用进样流量为20 mL/min。

图3 进样流量与回收率的关系
2.2.3 有机改性剂的影响
大量的水样进入固相萃取柱,会破坏柱填料的吸附条件,通常在水样中添加有机改性剂来增加化合物在小柱上的保留能力,以提高回收率。在苯并芘质量浓度为50 ng/L的2份水样中分别添加5%的甲醇和5%的异丙醇,按1.2和1.3条件进行处理和分析,试验发现,添加5%的甲醇和5%的异丙醇时样品中苯并芘的回收率分别为87%和83%,说明有机改性剂甲醇优于异丙醇。
2.2.4 洗脱溶剂选择
选择二氯甲烷、乙腈、乙酸乙酯为洗脱溶剂进行试验,其它处理条件不变,对填加标准溶液的水样(100 ng/L)进行预处理,经气质联用仪测定,并计算回收率,结果见表1。由表1可知,二氯甲烷为洗脱剂时回收率最高,这是因为乙腈对苯并芘的溶解能力差,且在反相柱的洗脱能力差,而二氯甲烷极性较小,适合洗脱弱极性的化合物苯并芘,乙酸乙酯极性中等,故洗脱效果介于两者之间。

表1 洗脱溶剂对苯并芘回收率的影响
2.3 校准曲线与检出限
按1.2色谱条件对苯并芘系列标准工作溶液进行测定。结果表明,苯并芘质量浓度(x)在10~200 μg/L范围内与响应值(y)线性关系良好,线性方程为y=138 584x+23 156,相关系数r=0.995。以3倍信噪比计算检出限,结果为2 ng/L。
2.4 方法的精密度和加标回收试验
在沂河水样中分别加入苯并芘标准溶液,使其浓度分别为20,100,200 ng/L,对每个质量浓度水平的加标样品按优化后的分析条件测定6次,结果见表2。由表2可知,方法回收率为85.0%~94.5%,测定结果的相对标准偏差小于6%,表明方法的精密度和准确度较高。

表2 回收率与精密度试验结果(n=6)
3 结语
通过对固相萃取柱种类、洗脱溶剂、上样流量等的考察,建立了大体积全自动固相萃气相色谱质谱联用测定水中苯并芘的方法。采用全自动正压型固相萃取仪,可避免负压型固相萃取装置难以控制上样流速的缺点,提高了分析精密度。一批样品萃取完成后,可调用清洗程序清洗样品流路,减少交叉污染。该方法前处理简单快速,可同时处理6个样品,节省了时间和人力,精密度、准确度符合定量要求,适合地表水和地下水中苯并芘的分析。
[1] Min Lingfeng,He Shuya,Chen Qiong,et al. Comparative proteomic analysis of cellular response of human airway epithelial cells to benzo(a) pyrene[J]. Toxicology Mechanisms and Methods,2011,21(5): 374-382.
[2] Simone Schmitz-Spanke,Albert W Rettenmeier. Protein expression profiling in chemical carcinogenesis: A proteomic-based approach[J]. Proteomics,2011,11 (4): 644-656.
[3] 李永红,金银龙.苯并[a]芘致癌机制研究新进展[J].医学研究杂志,2011,40(8): 152-154.
[4] Chen Yuanhong,Huang Changjiang,BaiChenglian,et al. Benzo[a]pyrene repressed DNA mismatch repair in human breast cancer cells[ J]. Toxicology,2013,33: 167-172.
[5] Xia Yinyin,Cheng Shuqun,He Junlin,et al. Effects of subchronic exposure to benzo[a]pyrene on learning and memory,and neurotransmitters in male Sprague-Dawley rat[J]. Neurotoxicology,2011,32 (2): 188-198.
[6] 陈承志,汤艳,蒋学君,等.苯并[a]芘对大鼠学习记忆及海马神经元影响[J].中国公共卫生,2011,27(5): 608-610.
[7] Szlinder-Richert J,Nermer T,Szatkowska U. PAH metabolites in European eels as indicators of PAH exposure: Different methodological approaches[ J]. Science of The Total Environment,2014,496: 84-91.
[8] Jeanine M Genkinger,Laura Stigter,Wieslaw Jedrychowski,et al. Prenatal polycyclic aromatic hydrocarbon exposure,antioxidant levels and behavioral development of children ages 6-9[ J]. Environmental Research,2015,140: 136-144.
[9] 李永红,程义斌,顾珩,等.宫内苯并(a)芘暴露对胎儿癌症相关基因表达的影响[J].环境卫生学杂志,2012,2(3): 101-104.
[10] 杨威,郎印海,李国梁,等.胶州湾湿地土壤多环芳烃分布及健康风险评价[J].环境化学,2013,32(10): 1 989-1 990.
[11] 吴贤梅,李东.固相萃取-高效液相色谱法测定水中多环芳烃[J].化学分析计量,2008,17(6): 49-51.
[12] GB 3838-2002 地表水环境质量标准[S].
[13] GB 8978-2002 污水综合排放标准[S].
[14] 国家环境保护总局水和废水监测分析方法编委会.水和废水监测分析方法第四版增补版[M].北京:中国环境科学出版社,2002: 661-670.
[15] GB/T 11895-1989 水质苯并(α)芘的测定乙酰化滤纸层析荧光分光光度法[S].
[16] 王浩,杨红梅,郭启雷,等.高效液相色谱-串联质谱法同时测定植物油中苯并芘与黄曲霉毒素B1,B2,G1,G[2J].分析测试学报,2014,33(8): 911-916.
[17] Tranfo G,Paci E. Biological monitoring of subjects exposed to benzene,PAH and nicotine by means of simultaneous determination of the metabolites by HPLC tandem mass spectrometry[ J]. Toxicology Letters,2011,205: 213.
[18] 宋冠群,林金明.环境样品中多环芳烃的前处理技术[J].环境科学学报,2005,25(10): 1 287-1 296.
[19] EPA 8270C Semi volatile organic compounds by gas chromatography/mass spectrometry (GC/MS)[S].
[20] 胡加文,李天宝,王春利,等.固相萃取-液相色谱法测定方便面中苯并芘[J].化学分析计量,2014,23(3): 25-27.
[21] 王梅,张莘民.我国环境中有机污染物分析方法及痕量富集技术的进展[J].环境监测管理与技术,2001,16(1): 13-16.
[22] HJ 478-2009 水质多环芳烃的测定液液萃取和固相萃取高效液相色谱法[S].
赛默飞质谱助您辨别真羊肉、定量肉类掺假比例
赛默飞世尔科技(以下简称赛默飞)近日发布了基于全方位质谱平台的肉类检测解决方案,建立了从掺假发现到定量多肽选择,以及定量实现的完整流程,并对发现的部分多肽进行了掺假实验与定量能力考察。
目前最常用的肉类检测方法:基于核酸的聚合酶链式反应技术(PCR)和基于抗体抗原结合的酶联免疫法(ELISA)。前者受到DNA降解,复杂基质的干扰和样品提取与扩增方法的影响,会对定性和定量的准确性造成干扰;后者往往受制于抗体制备,加工过程中蛋白变性,复杂基质和近亲缘种属之间同源干扰导致的假阳性影响。
随着生物质谱技术的发展,大规模定性和定量研究蛋白表达谱的技术已经成熟。因此利用质谱技术寻找不同肉类样品特征性蛋白或者多肽,并进行定量,能够避免现在常用的PCR技术和ELISA所面临的种种问题,质谱技术不受食品加工的过程影响,因为氨基酸序列比核酸序列在加工过程中更容易保存;同时实现定性与定量,避免假阳性且定量结果更加准确可靠;能够同时监测多种掺假。
赛默飞基于Thermo ScientificTM超高分辨Q Exactive质谱平台,研究了5种常见肉类彼此之间的特征性专属多肽, 各自找到了数百条相对于其它4个物种的特征性多肽。选取其中找到的部分多肽,通过人为将几种不同的肉类进行混合研究,模拟现实中掺假的情况,通过利用Thermo ScientificTM TSQ QuantivaTM三重四极杆质谱仪建立了基于SRM(Selected Reaction Monitoring)的掺假比例定量方法。
基于实验结果,对于每一个物种,为避免假阴性的结果,赛默飞研究人员同时选取鸡和鸭的6条特征性多肽,分别对两种禽类肉掺假进行了监测,并确定了最低的掺假检测限,远远超过了实际检测的需求。
与传统基于PCR和抗体的检测方法相比,质谱具有大致相当的灵敏度,拥有更好的避免假阴性与假阳性结果的能力,且能够避免由于加工所带来的PCR或者抗体相关空间结构破坏所带来的影响。
与上述掺假相比,还有一种相对而言更为严重、性质更恶劣的掺假——病死肉的掺假。基于上述方法,通过进一步系统研究,质谱也能够成为一种监测病死肉的手段,斩断病死肉流上餐桌的魔爪,与全方位的农残筛查与检测手段一起,为食品安全提供全方位的保障。同时,利用该研究方法还能帮助有机肉类产品生产商,提供肉类良种选择依据及肉类质量标准建立的可行性等。
( 中国分析计量网)
Determination of Benzoapyrene in Water by Large Volume Automatic Solid Phase Extraction and Gas Chromatography-Mass Spectrometry
Ma Xiaojie
(Linyi Environmental and Monitoring Station, Linyi 276001, China)
A method for determination of benzoapyrene in water was established by using fully automatic solid phase extraction and gas chromatography-mass spectrometry. Automatic solid phase extraction conditions were optimized. Benzoapyrene in water samples was extracted with C8solid-phase extraction cartridges by adding methanol to enhance benzopyrene retention capacity on solid phase extraction column. The positive pressure big volume six channel sampling at the same time was selected, the sample volume was 1 000 mL with the flow rate of 20 mL/min. Dichloromethane was used as elute solvent which was concentrated to 0.5 mL at last. The result showed that the concentration of benzopyrene in water was linear with its mass response value in the range of 10-200 μg/L,with correlation coefficient of 0.995. The detection limit was 2 ng/L. The relative standard deviation of determination results was less than 6%(n=6). The recovery rate ranged from 85% to 94.5% in the 20-200 μg/L standard addition level. The method is simple,accurate,and it is suitable for the determination of benzopyrene in water.
automatic solid phase extraction; gas chromatography-mass spectrometry; benzopyrene; positive pressure big volume
O657.7
:A
:1008-6145(2015)04-0040-04
10.3969/j.issn.1008-6145.2015.04.012
联系人:马小杰;E-mail: xiaojiema@126.com
2015-05-06
