乳腺腺样囊性癌1例临床病理分析与文献复习
2015-01-05汪满金俸瑞发金美华
汪满金,俸瑞发△,金美华
(桂林医学院附属医院:1.乳腺外科;2.病理科,广西桂林 541001)
乳腺腺样囊性癌1例临床病理分析与文献复习
汪满金1,俸瑞发1△,金美华2
(桂林医学院附属医院:1.乳腺外科;2.病理科,广西桂林 541001)
乳腺腺样囊性癌(ACC)是一种特殊类型的低度浸润性的乳腺浸润性癌亚型。ACC最常发生于涎腺,其次是气管、支气管、鼻腔、上额窦、泪腺、外耳道等处,而原发于乳腺实属罕见,将发生于乳腺的ACC又名癌性腺样肿瘤、腺囊性基底细胞癌、圆柱瘤样癌。有文献报道其发病率约占所有乳腺恶性肿瘤0.1%以下[1],关于其文献报道多为个案或数个病例的回顾性分析。有研究显示,超过50%的乳腺ACC易被误诊为其他类型肿瘤,误诊率高,且目前尚无统一的治疗标准。本文报道1例,并结合相关文献对其进行临床病理分析。
1 临床资料
患者,女,45岁,因“发现右乳肿物半年余”于2014年4月入住桂林医学院附属医院乳腺外科。(1)入院查体。双乳对称,右侧乳房有乳头凹陷,无乳头溢血溢液,乳房表面皮肤无红肿溃烂,未见橘皮征及酒窝征,右乳乳晕下可及直径约3.00 cm大小肿物,边界不清,质硬,偶有轻压痛,活动度稍差,左乳未及明显肿块,双侧腋窝及双侧锁骨上区未触及明显肿大淋巴结。既往1995年行输卵管肿块切除史,1996年行肠粘连手术史,有输血史(具体不详),未婚未育,其母亲因恶性淋巴瘤去世。(2)辅助检查。乳房彩超提示(图1):右乳乳晕下方可探及一低回声团块,大小约1.90 cm×2.00 cm,形态不规则,边界欠清晰,边缘成角,内部回声不均匀,未见点状强回声,后方回声增强,乳腺后间隙未见明显异常。彩色多普勒超声(CDFI):团块及周边可见血流信号,呈条状,血流阻力指数(RI)为0.61,乳腺影像报告数据系统(BI-RADS)为4b级,双侧腋窝未见明显异常肿大淋巴结。乳房钼靶提示:乳腺实质结构较紊乱,纤维腺体组织部分退化,乳晕后区及各象限可见斑片状不均匀密度增高影及杂乱条索状纤维影,右乳中央区可见大小约2.60 cm×2.30 cm类圆形密度增高影,边缘不清,周围血管影明显增粗,未见明显毛刺及异常钙化,符合BI-RADS 4b级。右腋区可见淋巴结显示,形态密度无异常。胸腹部CT(平扫加增强)提示(图2):右乳头后方可见一类圆形密度影,边界欠清,大小约2.20 cm×2.00 cm,增强扫描明显强化,内可见小斑片状稍低密度影;增强扫描右侧乳腺另见多个小结节强化灶,左侧乳腺未见异常密度影及异常强化灶,两侧腋窝未见明显肿大淋巴结,左肺尖、右肺下叶背段可见一小结节状略高密度影,直径约5.00 mm,余肺叶未见异常密度影及异常强化灶。肝脏未见异常密度影集异常强化灶。术前空芯针穿刺活检病理示:右乳乳腺小叶内腺泡上皮增生活跃伴异型,为不典型小叶增生,不排除腺泡型小叶癌。(3)临床诊断:右乳肿物(癌?),性质待定。(4)治疗:在局部麻醉下行右乳肿物切除术,术中见肿物质硬、边界不清、直径约3.00 cm,完整切除肿物及周围约1.00 cm腺体组织,剖开肿物,肉眼观肿物包膜不完整,剖面呈鱼肉状,色灰白,可见大小不等的囊腔,内含黏液样物质。术中送快速冰冻病理回示:浸润性癌,改在气管插管全身麻醉下行右乳癌改良根治术,送常规石蜡病检。标本经10%中性甲醛溶液固定24 h后,由病理医生切片取材,每隔0.50 cm切开,石蜡包埋并切片,进行HE染色及Envision两步法进行雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(Her-2)、Ki67、血管内皮生长因子(VEGF)、P53、CK5/6、SMA、P63等项染色。患者术前胸腹部CT检查怀疑有肺部转移征象,为进一步降低术后复发风险,术后按吡柔比星60 mg/m2加环磷酰胺600 mg/m2×4次,多西他赛100 mg/m2×4次,21 d为1个周期,拟行8个周期化疗并长期随访。(5)结果。①病理检查(图3A~D):肿瘤细胞大部分呈实体型排列,密集排列呈地图状,其内可见筛孔状、小管状和条索状排列。主要由基底细胞样肿瘤细胞组成,包质少,淡粉染,界限不清,细胞核呈颗粒状,腔内可见粉染的黏液样分泌物,另可见形成腺管状结构的腺上皮和肌上皮,后者扁平呈梭形,界限不清,胞质少而淡。病理诊断为右乳ACC。②免疫表型(图3E、F):ER(-)、PR(-)、Her-2(-)、Ki67(+)约30%、VEGF(+)、P53(+)、CK5/6(+)、SMA(+)、P63(+)等项结果考虑为ACC(实性型)。肿瘤周围乳腺组织、乳头及基底切缘均未见癌,(右侧)腋窝淋巴结17枚均未见癌转移。
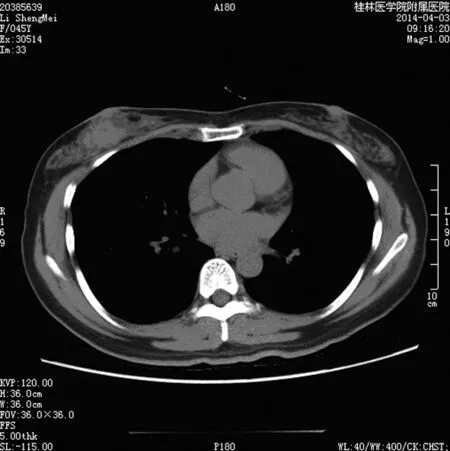
图2 胸部CT图像
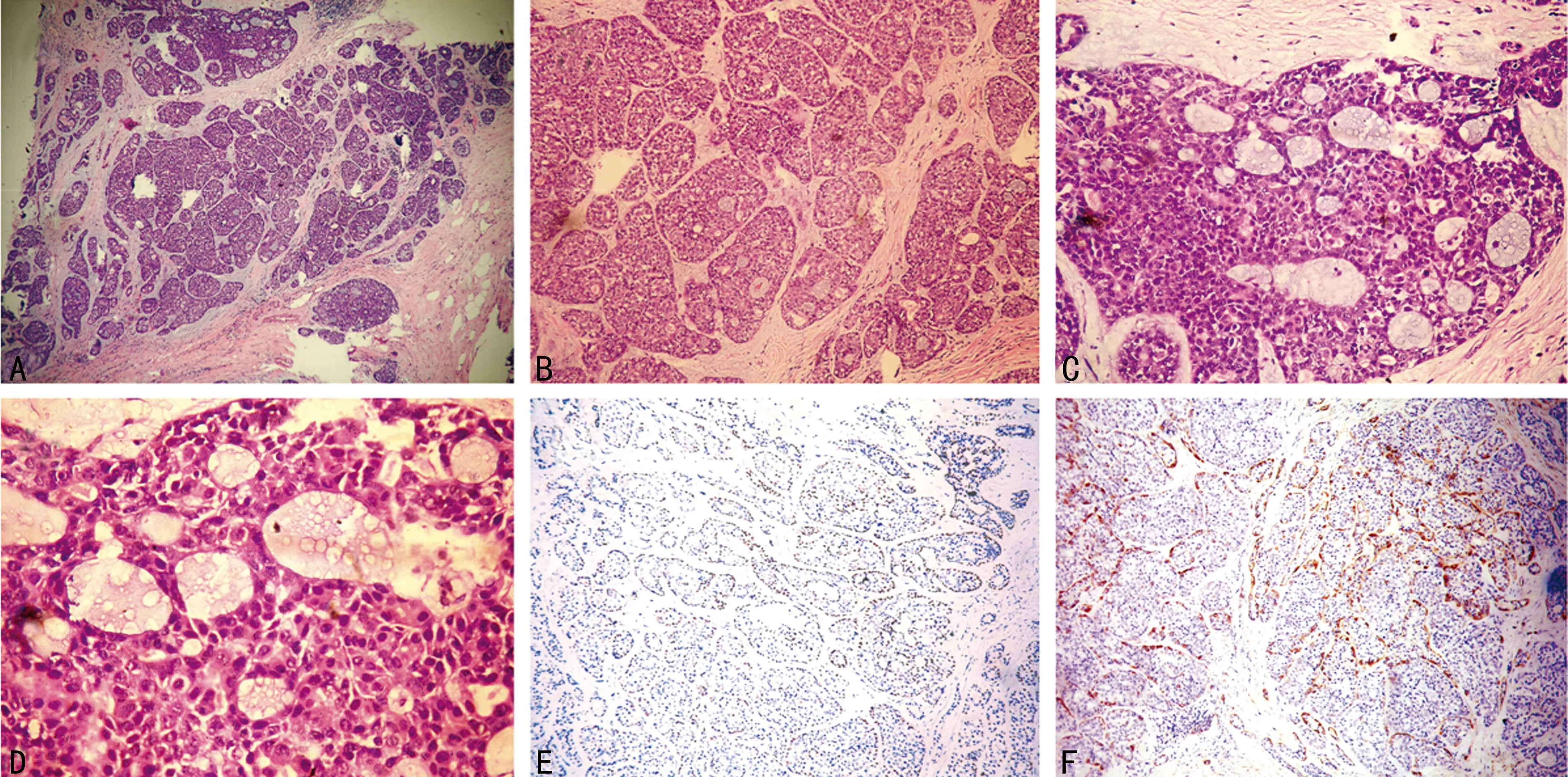
A:肿瘤细胞密集排列成巢(HE,4×10);B:肿瘤细胞巢可见筛状结构(HE,10×10);C:实性肿瘤细胞巢见多个筛状结构腔(HE,20×10);D:肿瘤囊内含黏液性分泌物(HE,40×10);E:肌上皮细胞P63阳性表达(Envision,10×10);F:肌上皮细胞SMA阳性表达(Envision,10×10)。
图3 肿瘤组织病理检查及免疫表型
2 讨 论
2.1临床特征 乳腺ACC患者多为成年女性,好发年龄在30~90岁,罕见有男性的报道[2],临床表现常为单发乳腺肿块,可伴有疼痛或无疼痛,当肿瘤周围神经受侵犯时可有疼痛感,McClenathan等[3]回顾性分析22例病例,发现10例患者主要以疼痛症状为主诉。一般边界较清,好发于乳晕周围区域及乳晕下方,较少出现乳头溢血溢液[4]。少数病例可有皮肤累及,罕见双乳ACC报道,双侧乳腺发生ACC无明显差异,一般X线摄片无特殊性,影像学可表现为边界不清的分叶状肿块或毛刺样病变,有些病变可见微小钙化,有些呈隐匿性,常常易与良性肿瘤混淆。Sheen-Chen等[5]认为术前乳腺钼靶和超声检查不能区别ACC和浸润性导管癌,可能是由于肿瘤边缘组织的破坏和纤维化改变导致。本例患者临床查体可及明显肿块并伴有轻压痛,术前乳腺彩色超声、钼靶、胸腹部CT检查可见明显肿块,怀疑有恶性肿瘤的可能,有手术指征。
2.2病理特征 乳腺ACC的组织形态与涎腺相似,呈筛状,肿瘤边缘常光滑,剖面呈鱼肉状,色灰白,质硬,其内可见大小不等的含黏液的囊腔。肿瘤直径为0.10~14.00 cm,大多数肿瘤直径在1.60~2.00 cm[6]。肿瘤组织呈多样性,(1)细胞种类的多样性:肿瘤成分包括腺上皮、肌上皮、基底样细胞和细胞外基质;(2)其排列结构的多样性:包括筛状型、管状-小梁型、实体型三种生长模式。其中筛状型最具有特征性,也最常见,由假腺管样结构和真性腺腔组成。前者为假性腺腔,多为圆形,管腔大小不一,间质内有胶原化,含阿辛蓝染色阳性的间质黏液物;后者为真性腺腔,数量少且较小,其内含糖原染色(PAS)阳性的中性黏液分泌物。实体型较少见,肿瘤细胞排列成地图状、梁索状或花环样岛状等,主要由基底细胞样肿瘤细胞组成,异型性较其他类型明显,也更易出现坏死。通常乳腺ACC多见于3种组织类型的混合。有研究根据涎腺的ACC分级系统,将实体结构成分在肿瘤中所占的比例将其分为:管状结构伴筛状结构而没有实体结构归为Ⅰ级;只有筛状结构或伴有实体结构成分小于或等于30%归为Ⅱ级;实体结构成分大于30%归为Ⅲ级。组织学为筛状型的预后最佳,实体型预后较差。本例主要由基底细胞样肿瘤细胞组成,密集排列呈地图状,大部分呈实体型排列。
2.3诊断及鉴别诊断 乳腺ACC肿瘤形态特点较特殊,在病理诊断中容易被误诊。肿瘤成分呈浸润性生长,以筛状型结构为特点的多种结构模式(筛状型、管状-小梁型、实体型)合并存在,以其中一种结构模型为主体,肿瘤由腺样、鳞样和皮脂腺分化的上皮、肌上皮、基底样细胞以及无细胞的嗜酸性基底膜样物质按不同比例聚集而成[7]。ACC是具有筛状结构的代表性乳腺病变,常需与浸润性筛状癌(invasive cribriform carcinoma,ICC)、筛状型导管内癌和乳腺良性疾病等病变相鉴别[8]。(1)ICC:ICC肿瘤细胞较小,核无明显多行性,由单层上皮组成,细胞学可见筛状或有孔的细胞岛浸润在间质内,但缺乏肿瘤性肌上皮成分,在HE染色下,ACC的筛状结构与ICC十分相似,但它们的免疫标记谱不同。ACC的导管上皮细胞表达CD117,肌上皮细胞表达p63、SMA,不表达ER、PR。ICC不表达CD117、p63及SMA,总是表达ER、PR[9],易与ACC相鉴别。(2)筛状型导管内癌:虽然筛状型导管内癌存在肌上皮细胞,但它们仅限于病变导管周缘,其浸润性病灶内无肌上皮细胞,而不像ACC中腺上皮于肌上皮的密切混合。筛状型导管内癌表达ER、PR,只有少部分表达CD117,免疫表型有助于二者鉴别。(3)乳腺胶原小球(collagenous spherulosis,CS):CS是一种累及乳腺终末导管小叶单元的局限性非浸润性病变,免疫组化SMA、calponin、CD10和p63染色显示筛状结构周围有完整的肌上皮层[10]。其腺上皮不表达CD117,ACC一般可触及明显肿块,镜下呈浸润性生长,腺上皮成分表达CD117[11]。ACC通常不表达ER、PR,Her-2基因扩增阴性,是一种罕见类型的三阴性特征乳腺癌[12]。ACC的腺上皮成分表达CK7和CK5/6,肌上皮成分表达SMA和P63,基底样细胞不同程度表达CK5/6和P63,如果基底样细胞出现CK5/6和CD117表达,提示其向腺上皮分化,而P63染色阳性则提示向肌上皮分化。因此,ACC是一组由腺上皮、肌上皮和基底样细胞构成的异质性肿瘤,各细胞成分具有不同的免疫表型特点,联合运CK7、CK5/6、p63、SMA和CD117有助于诊断与鉴别诊断[13]。本例免疫表型ER(-)、PR(-)、Her-2(-)、SMA(+)、P63(+),结合病理特征,诊断为ACC。
2.4治疗及预后 乳腺ACC的恶性程度较低,无病生存期和总生存期较长,与常见三阴性乳腺癌预后差的特点正好相反[12],无涎腺ACC的浸润性,也比乳腺浸润性导管癌预后好,Arpino等[7]报道其5年无病生存率为100%,而5年总生存率为85%。而Kulkarni等[14]荟萃分析发现有88%的患者可获得5年总生存率。乳腺ACC表现为一种惰性的临床生物学行为[15],罕见局部或远处淋巴结转移,也罕见有因为乳腺ACC而致死的病例[16]。临床上一般采用肿块的扩大切除辅以术后乳房放射治疗或者单纯乳腺切除不加腋窝淋巴结清扫,除非临床上发现腋窝淋巴结肿大或前哨淋巴结阳性才行腋窝淋巴结清扫[17]。临床上远处转移较少见,文献报道常转移的部位是肺,因此术后随访要注意拍摄胸片或胸部CT检查,肝脏、骨和肾转移少见报道[7]。乳腺ACC患者的预后多良好,术后辅助放疗、化疗治疗的临床意义尚不明确。外科治疗仍是这类患者的标准处理方法,当行保乳手术或肿块较大有淋巴结转移的患者应行术后全乳放射治疗[18],Coates等[19]研究显示,乳房局部切除术后辅助放射治疗可明显改善患者的总生存率。
临床上乳腺ACC发病率极低,至今相关报道较少,对其认识远远不够,需要积累更多的病例进一步总结分析。目前尚无大样本临床资料,治疗没有达成共识,治疗指南尚未确定,虽然乳腺ACC预后相对较好,但远处转移和晚期复发可能会出现。有研究认为,长期随访是必要的[20]。目前仍然难以对不同手术方式和术后辅助治疗方法的效果进行评价,因此,更详细的免疫组化指标检测,更准确的病理诊断,结合临床选择不同的手术方式及术后的辅助治疗,定期随访,尽可能的延长患者的生存期及改善生活质量。
[1]Muslimani AA,Ahluwalia MS,Clark CT,et al.Primary adenoid cystic carcinoma of the breast:case report and review of the literature[J].Int Semin Surg Oncol,2006(3):17.
[2]王玉龙,董海燕,袁凯,等.一例男性乳腺腺样囊性癌[J].中华内分泌外科杂志,2013,7(2):140-143.[3]McClenathan JH,de la Roza G.Adenoid cystic breast cancer[J].Am J Surg,2002,183(6):646-649.
[4]Bhosale SJ,Kshirsagar AY,Patil RK,et al.Adenoid cystic carcinoma of female breast:A case report[J].Int J Surg Case Rep,2013,4(5):480-482.
[5]Sheen-Chen SM,Eng HL,Chen WJ,et al.Adenoid cystic carcinoma of the breast:truly uncommon or easily overlooked[J].Anticancer Res,2005,25(1B):455-458.
[6]Thompson K,Grabowski J,Saltzstein SL,et al.Adenoid cystic breast carcinoma:is axillary staging necessary in all cases? Results from the California Cancer Registry[J].Breast J,2011,17(5):485-489.
[7]Arpino G,Clark GM,Mohsin S,et al.Adenoid cystic carcinoma of the breast:molecular markers,treatment,and clinical outcome[J].Cancer,2002,94(8):2119-2127.
[8]张璋,步宏.起源于腺肌上皮瘤的乳腺腺样囊性癌[J].临床与实验病理学杂志,2014,30(1):61-63.
[9]肖晓岚,解娜,李妹.乳腺腺样囊性癌与浸润性筛状癌的形态及免疫组化比较[J].临床与实验病理学杂志,2010,26(3):293-296.
[10]李静,丁华野.乳腺胶原小体病临床病理分析[J].诊断病理学杂志,2006,13(3):211-213,254.
[11]Rabban JT,Swain RS,Zaloudek CJ,et al.Immunophenotypic overlap between adenoid cystic carcinoma and collagenous spherulosis of the breast:potential diagnostic pitfalls using myoepithelial markers[J].Mod Pathol,2006,19(10):1351-1357.
[12]Vranic S,Bender R,Palazzo J,et al.A review of adenoid cystic carcinoma of the breast with emphasis on its molecular and genetic characteristics[J].Hum Pathol,2013,44(3):301-309.
[13]徐炼,魏兵,步宏,等.乳腺腺样囊性癌18例临床病理分析[J].临床与实验病理学杂志,2012,28(7):717-721.
[14]Kulkarni N,Pezzi CM,Greif JM,et al.Rare breast cancer:933 adenoid cystic carcinomas from the National Cancer Data Base[J].Ann Surg Oncol,2013,20(7):2236-2241.
[15]Wetterskog D,Lopez-Garcia MA,Lambros MB,et al.Adenoid cystic carcinomas constitute a genomically distinct subgroup of triple-negative and basal-like breast cancers[J].J Pathol,2012,226(1):84-96.
[16]Law YM,Quek ST,Tan PH,et al.Adenoid cystic carcinoma of the breast[J].Singapore Med J,2009,50(1):e8-11.
[17]李学瑞,罗东兰,廖宁,等.乳腺腺样囊性癌免疫组化表型与临床特征分析[J].广东医学,2011,32(13):1715-1717.
[18]Kontos M,Karles D,Petrou A,et al.Adenoid cystic carcinoma intermingled with ductal carcinoma of the breast:a case report and review of the literature[J].J Med Case Rep,2011(5):437.
[19]Coates JM,Martinez SR,Bold RJ,et al.Adjuvant radiation therapy is associated with improved survival for adenoid cystic carcinoma of the breast[J].J Surg Oncol,2010,102(4):342-347.
[20]Kim M,Lee DW,Im J,et al.Adenoid cystic carcinoma of the breast:a case series of six patients and literature review[J].Cancer Res Treat,2014,46(1):93-97.
篇及病例报道·
10.3969/j.issn.1671-8348.2015.11.055
广西壮族自治区卫生厅重点科研课题(Z2008263);桂林市科学研究与技术开发计划(20110119-1-9)。
汪满金(1989-),住院医师,硕士研究生,主要从事乳腺外科工作。
△通讯作者,Tel:13635183143;E-mail:c71339@qq.com。
R737.9
C
1671-8348(2015)11-1579-03
2014-10-18
2015-01-10)
