不同剂量的1,25(OH)2D3对大鼠Thy1肾炎系膜细胞凋亡的影响*
2015-03-14李建峰杨晓萍
索 洁,李建峰,赵 瑾,陶 林,杨晓萍△
(新疆石河子大学医学院:1.第一附属医院肾病科;2.病理科,新疆石河子832000)
系膜增生性肾小球肾炎(mesangial proliferative glomerulo nephritis,MsPGN)是中国原发性肾小球疾病中最常见的病理类型[1-2],各种损伤因子引起的系膜细胞(mesangial cell,MC)增生是多种类型肾小球肾炎的共同病理表现,细胞外基质(extracellar matrix,ECM)的集聚是导致肾小球硬化和促使各种肾小球肾炎向终末期肾病(ESRD)转化的中心环节。有研究表明,1,25(OH)2D3可显著抑制体外培养的 MC增殖、诱导其分化、促进其凋亡[3],其作用机制和原理目前尚无定论。本实通过建立大鼠抗胸腺细胞抗体(anti-Thymocyte cell-1,Thy1)肾炎[3],给予不同剂量1,25(OH)2D3干预,用免疫组化法检测肾小球内半胱氨酸天冬氨酸蛋白酶3(Caspase-3)的表达,TUNEL法检测肾小球内细胞凋亡,以探讨1,25(OH)2D3对MsPGN MC凋亡的影响及其可能机制,现将研究结果报道如下。
1 材料与方法
1.1 材料 选择清洁级SD大鼠120只,体质量(185.4±12.7)g,购自新疆地方流行性疾病控制中心。
1.2 方法
1.2.1 建立肾炎模型 将120只大鼠分为空白对照组(A组,n=30)和实验组(n=90)。A组:每只大鼠尾静脉一次性注射生理盐水25μL/100g;实验组每只大鼠尾静脉一次性注射单克隆抗Thy1 25μL/100g后,随机分为肾炎模型组(B组)、低剂量1,25(OH)2D3组(C组)和高剂量1,25(OH)2D3组(D组),每组30只。
1.2.2 1,25(OH)2D3干预 C、D组从注射Thy1后第1天开始分别给予1,25(OH)2D3(罗钙全)0.25、0.50μg/d,溶于1 mL花生油中灌胃,共21d。A、B组大鼠同时给予1mL花生油灌胃,各组大鼠分别于注射后第1、3、7、14、21d各处死6只大鼠,留取肾脏标本待测。
1.2.3 检测1,25(OH)2D3对 MsPGN组织损害的影响 肾组织经HE和PAS染色后在光镜下观察MC和ECM增生情况,并根据病理损害程度进行分级。参照人MsPGN分级标准进行分级。
1.2.4 免疫组化技术检测肾小球中Caspase-3的表达Caspase-3阳性表达为细胞质内出血棕黄色颗粒。高倍镜下(×400)随机选取选5个肾小球,观察染色细胞的面积和强度,计算其平均值。
1.2.5 TUNEL法测肾组织细胞凋亡 TUNEL法检测细胞凋亡的阳性细胞为细胞核呈现棕黄色。高倍镜下(×400)随机选取10个肾小球计数,凋亡细胞占肾小球内有核细胞的比例为阳性率,分别计数各组肾小球内的阳性细胞。
1.3 统计学处理 所以数据采用SPSS19.0统计软件进行处理,数据采用x±s表示,组间和组内比较采用方差分析,其中两两比较用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 1,25(OH)2D3对Thy1肾炎肾小球损害程度及病理损害的影响 A组大鼠肾组织均为正常肾组织,光镜下未见MC和ECM增生;B组在各时间点均可见MC增生,其增生程度随着时间的延续呈加重趋势,并可见毛细血管袢受压严重,出现结节和团块状实性区,部分肾小球出现分叶、硬化和纤维化,至14d时MC增生减轻;与B组比较,C、D组大鼠肾组织在各时间点MC增生程度均显著减轻(P<0.05),镜下可见毛细血管袢轻度受压,系膜宽度未超过毛细血管直径,呈节段性分布;C、D组大鼠肾组织在各时间点 MC增生程度比较,差异无统计学意义(P>0.05),见表1、图1(只比较 A、B、D组病理PAS染色结果,图2、3相同)。

表1 各组不同时间肾组织病变程度积分值比较(x±s,n=6)
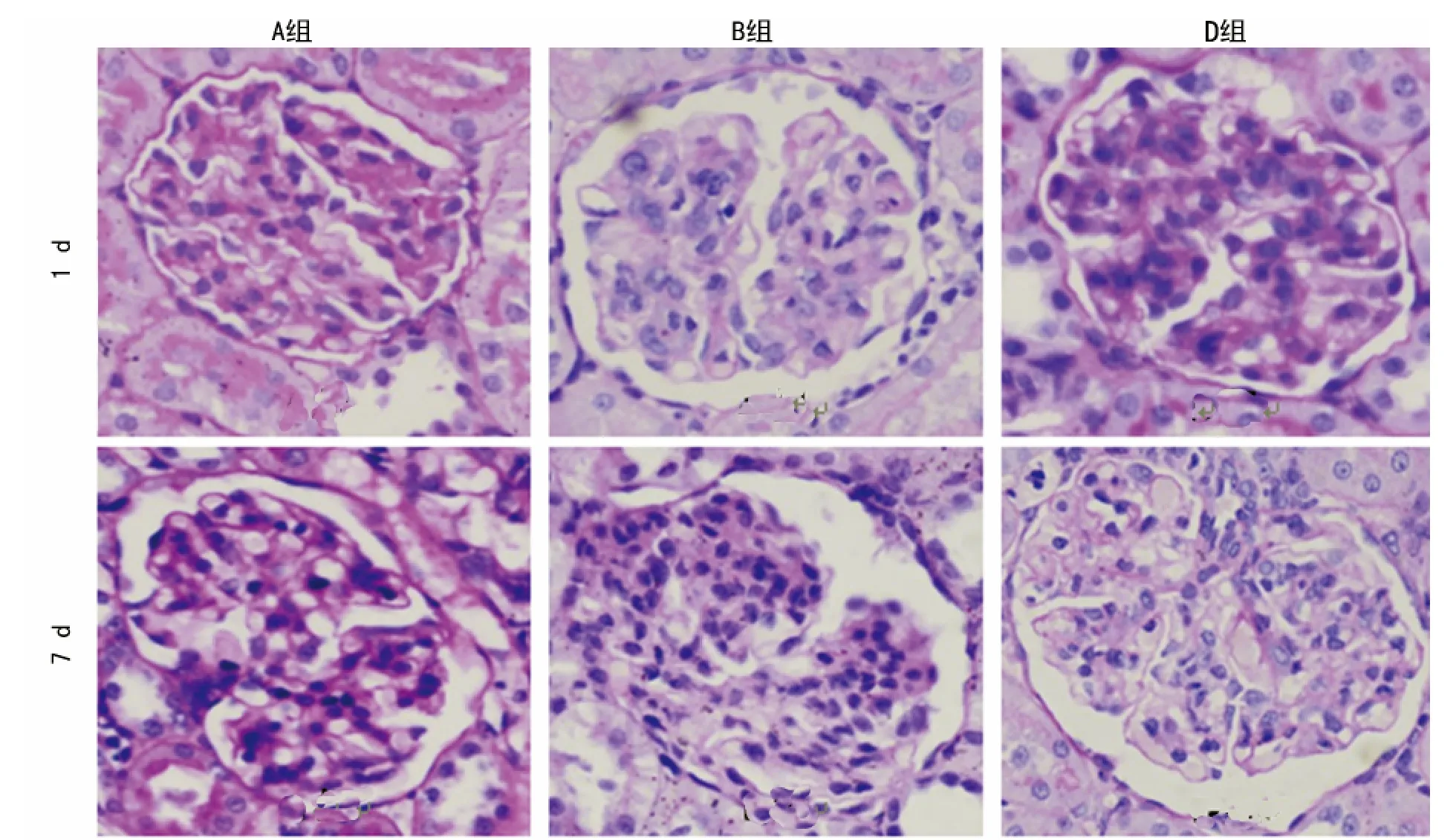
图1 不同时间段、不同组间PAS染色结果(×400)
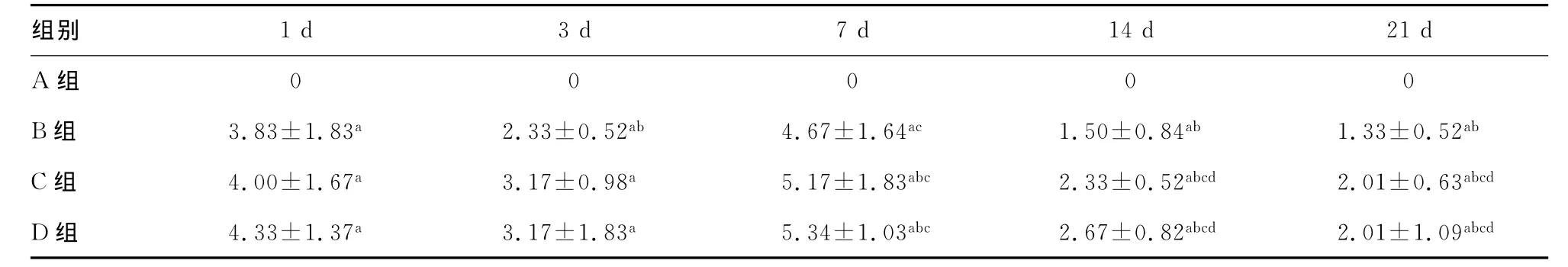
表2 不同时段各组间肾小球内Caspase-3的表达量(x±s,n=6)
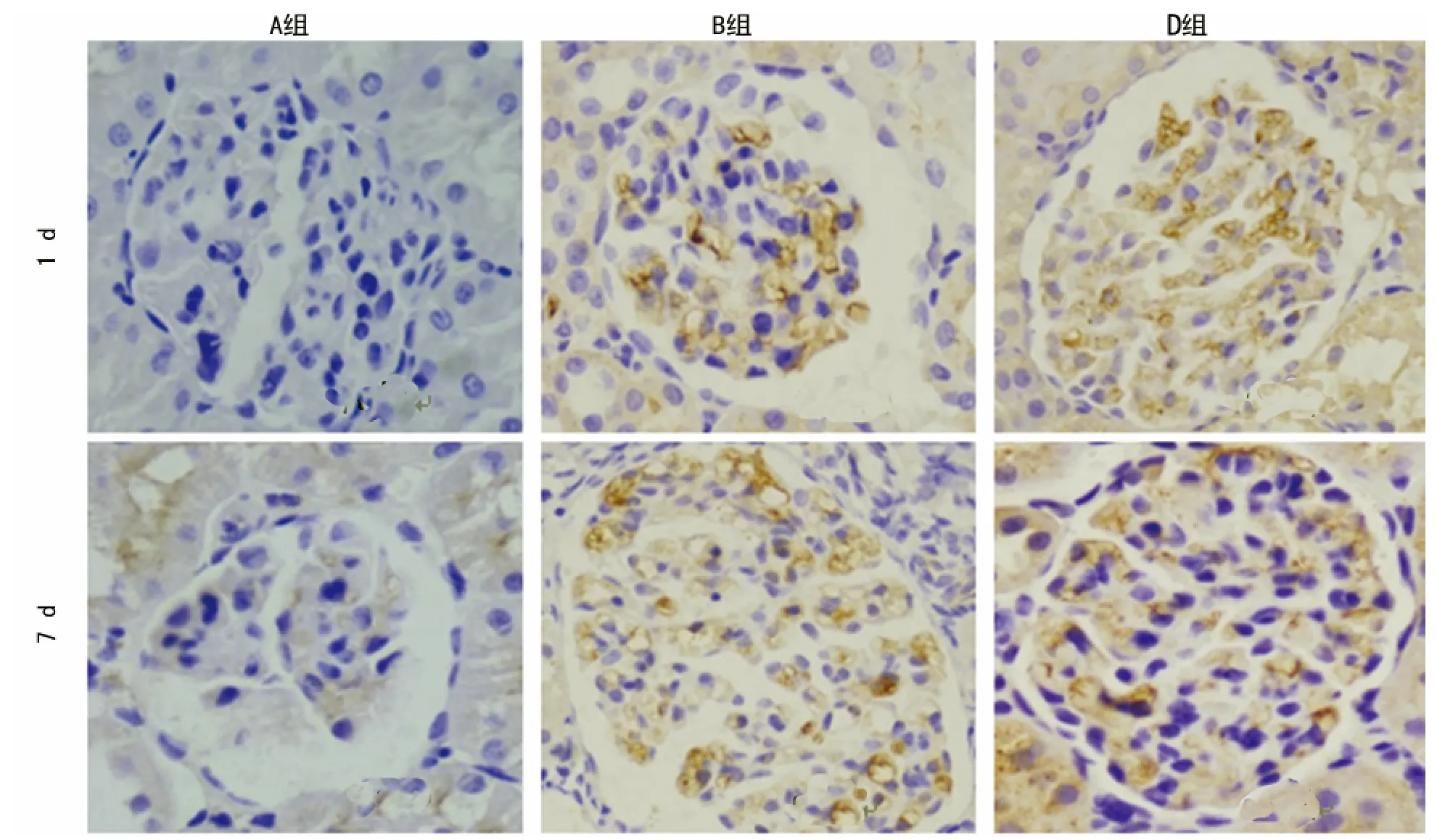
图2 不同时段、不同组间Caspase-3的表达结果
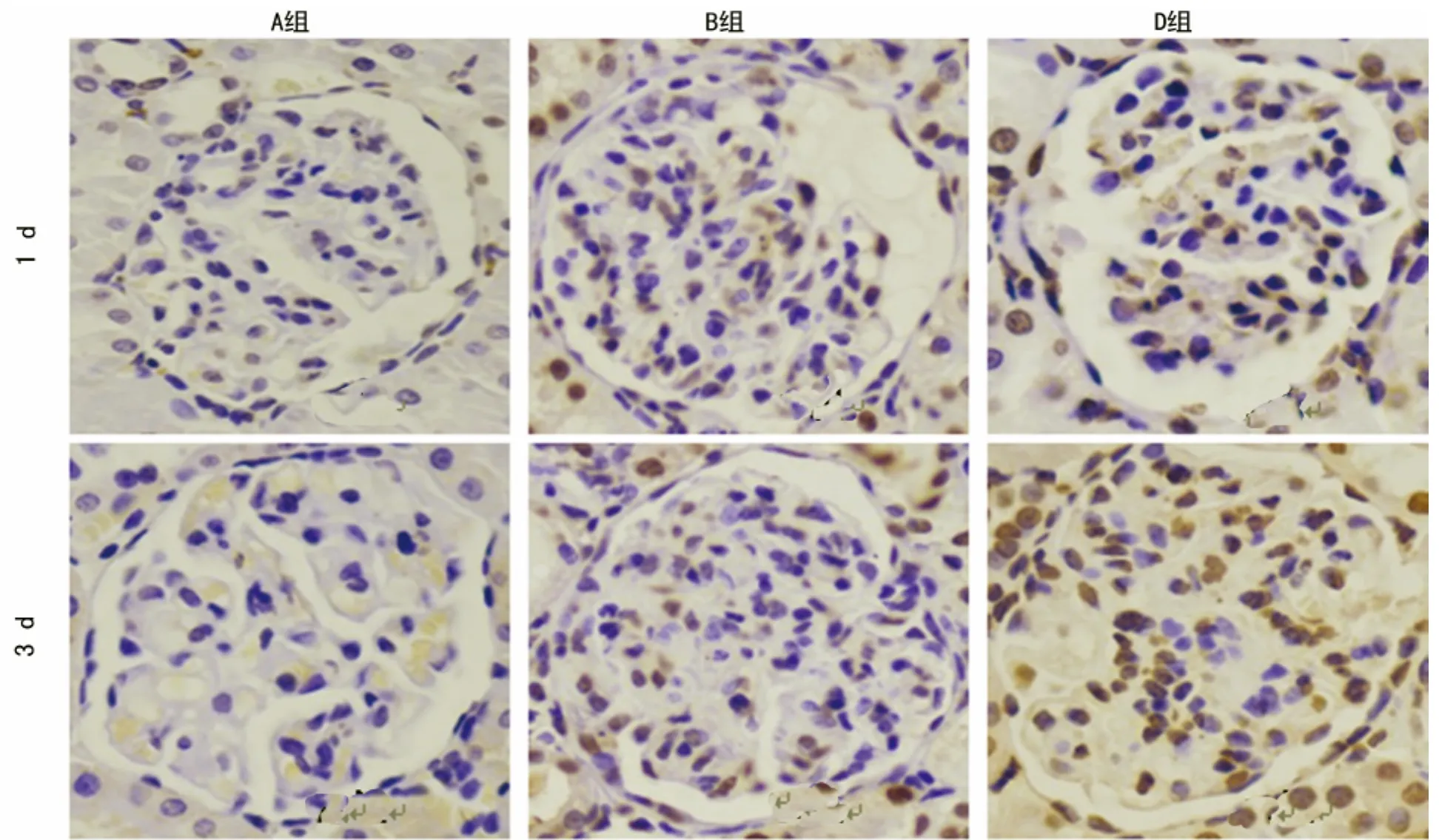
图3 不同组间、不同时段肾小球内凋亡细胞结果

表3 TUNEL测定不同时间段各组间肾小球内凋亡细胞百分数(x±s,n=6)
2.2 Caspase-3在各组肾小球中的表达量比较 Caspase-3为细胞质着色,呈淡黄色或黄色。A组肾小球中无Caspase-3的表达;B组第1天肾小球细胞质内可见Caspase-3的表达,第3天有所下降,在第7天时明显增多,第14天表达再度减少,第21天持续减少,差异有统计学意义(P<0.05);与B组比较,C、D组在各时段均有Caspase-3的表达,趋势与B组相同,且表达量高于B组,但差异均无统计学意义(P>0.05);D组表达较C组更强,C、D组比较差异无统计学意义(P>0.05)。各组肾小球内Caspase-3的表达量,见表2、图2。
2.3 1,25(OH)2D3对肾组织细胞凋亡的影响 A组肾小球内有少量凋亡细胞;B组在不同时间段内均可见阳性凋亡细胞,随着时间延长逐渐增多;与B比较,C、D组在第1天即可见较多的凋亡细胞,3d达高峰,7、14d开始下降,差异有统计学意义(P<0.05);C组细胞凋亡数量3d时较D组高,余各时段均较D组低,但C、D组比较差异无统计学意义(P>0.05),见表3、图3。
3 讨 论
作为肾小球内的固有细胞之一,MC异常增殖及其继发的炎症介质释放、ECM的病理性聚集,是导致肾小球硬化,使各种肾小球肾炎向ESRD发展的中心环节。因此,采用各种干预措施维持MC增生、肥大与凋亡之间的平衡及改善系膜基质代谢是延缓或逆转肾小球硬化的关键。所以,寻找抑制MC增生、诱导MC凋亡的药物对于临床上治疗各种肾小球肾炎具有重要意义。国内外大量研究已经证实1,25(OH)2D3除了经典的钙磷代谢调节功能外,还具有多种生物功能,如抑制多种肿瘤细胞,免疫细胞的增殖等[4-8],1,25(OH)2D3对 MC有无作用及是何种作用,本课题组前期的研究已经证实,1,25(OH)2D3能够有效抑制体外培养的大鼠系膜细胞增殖[9]。
在本实验中,使用TUNEL法测定肾小球内系膜细胞凋亡后发现,肾炎组肾小球内细胞凋亡随时间推移逐渐增多,而使用1,25(OH)2D3干预的实验组在药物干预后第1天开始凋亡细胞就明显增多,并在第3天到达高峰,此后逐渐降低,提示1,25(OH)2D3可早期诱导GCM凋亡,对肾脏具有保护作用。此外,研究结果还提示,1,25(OH)2D3的作用强度与剂量相关,高剂量较低剂量作用更为明显。另外,与B组相比,C、D组大鼠在各时间点的组织形态学改变也明显减轻;第7天肾脏病理显示MC以及ECM明显减少,炎症因子积聚减轻,球囊粘连偶尔可见等,说明1,25(OH)2D3对于Thy1肾炎的调控不仅是在抑制细胞增殖,诱导细胞凋亡方面,而且也体现在组织形态学改变方面。
在细胞凋亡的启动、发展过程中,有许多基因及其产物的参与,其调控过程十分复杂,目前已知的凋亡信号传导通路有死亡受体途径、线粒体途径、内质网途径,均能激活Caspase-3[10-15],并可通过水解各种细胞成分而使细胞凋亡。在本研究中,对照组中肾小球中无Caspase-3的表达,B组在Thy1抗体注射后1d即出现Caspase-3的表达,出现第1个表达高峰,这与注射Thy1抗体后1d内出现系膜细胞核固缩、细胞溶解有关;第3天时有所下降;随着肾炎病程的发展,增生的系膜细胞及浸润的炎细胞通过细胞凋亡途径而清除,Caspase-3在第7天时再次升高,出现第2个表达高峰;在第14天和第21天的检测中持续下降。C、D组总体趋势与B组相同,但表达量更高,其中以D组的表达最强,C组次之,但各组之间差异无统计学意义(P>0.05)。本实验通过使用不同剂量1,25(OH)2D3干预后发现,Caspase-3的表达与药物剂量呈正相关,提示在本实验中1,25(OH)2D3参与了对Caspase-3的调节,具有诱导细胞凋亡的作用,促进Thy1肾炎的转归。
综上所述,本研究证实了1,25(OH)2D3具有诱导细胞凋亡的作用,且受药物剂量影响,高剂量的1,25(OH)2D3在诱导系膜细胞凋亡中的作用最强。1,25(OH)2D3参与了肾小球中Caspase-3的调控,并在Thy1肾炎早期诱导肾小球内系膜细胞凋亡,促进了炎症的修复,从而早期延缓肾小球疾病的进展,保护肾脏。
[1] 张路霞,王梅,王海燕,等.CKD的流行病学研究[J].中华肾脏病杂志,2005,21(7):425-427.
[2] Abdelsamie SA,Li Y,Huang Y,et al.Oxidized LDL immune complexes stimulate collagenⅣproduction in mesangial cell via Fc gamma receptors Ⅰ and Ⅲ [J].Clin Immunol,2011,139(3):258-266
[3] 赵丹,杨晓萍,张春江,等.1,25(OH)2D3对大鼠肾小球系膜细胞凋亡的影响[J].临床与实验医学杂志,2011,10(7):486-487.
[4] Chen D,Li Y,Dai X,et al.1,25-Dihydroxyvitamin D3activates MMP13gene expression in chondrocytes through p38MARK pathway[J].Int J Biol Sci,2013,9(6):649-655.
[5] Hashimoto K,Kamijo Y,Nakajima T,et al.PPARαactivation protects against anti-Thy1nephritis by suppressing glomerular NF-κB signaling[J].PPAR Res,2012,10(10):1-11
[6]Ingraham BA,Bragdon B,Nohe A.Molec ular basis of the potential of vitamin D to prevent cancer[J].Curr Med Res Opin,2008,24(1):139-149.
[7] Mullin GE,Dobs A.Vitamin D and its role in cancer and immune-ty:aprescription for sunlight[J].Nutr Clin Pract,2007,22(3):305-322.
[8] Zhuo L,Fu B,Bai X,et al.NAD blocks high glucose induced mesangial hypertrophy via activation of the Sirtuins-AMPK-mTOR pathway[J].Cell Physiol Biochem,2011,27(6):681-690.
[9] 张春江,杨晓萍,贺德刚,等.1,25(OH)2D3对大鼠系膜细胞增殖的影响及机制探讨[J].山东医药,2011,51(47):32-34.
[10]戴昕,李占全,冀林华.凋亡相关蛋白Caspase研究进展[J].中国现代医药杂志,2010,12(4):130-132.
[11]Scatena R,Bottoni P,Botta G,et al.The role of mitochondria in pharmacotoxicology:a reevaluation of an old,newly emerging topic[J].Am J Physiol Cell Physiol,2007,6(293):C12-21.
[12]Sun Y,Liu G,Song T,et al.Upregulation of GRP78and caspase-12in diastolic failing heart [J].Acta Biochim Pol,2008,55(3):511-516.
[13]Martinou JC,Youle RJ.Mitochondria in apoptosis:Bcl-2 family members and mitochondrial dynamics[J].Dev Cell,2011,21(1):92-101.
[14]Dai Z,Gao J,Ji Z,et al.Matrine induces apoptosis in gastric carcinoma cell via alteration of Fas/FasL and activation of caspase-3[J].J Ethnopharmacol,2009,123(1):91-96.
[15]Kim EM,Shin EJ,Choi JH,et al.Matrix metalloproteinase-3is increased and participates in neuronal apoptotic signaling downstream of caspase-12during endoplasmic reticulum stress[J].J Biol Chem,2010,285(22):16444-16452.
