1例乳腺导管周围间质肉瘤的临床及影像学表现
2015-01-05刘耀文沈训泽
刘耀文,沈训泽
(1.重庆医科大学临床医学七年制,重庆 400016;2.绍兴市人民医院放射科,浙江绍兴 312000)
1例乳腺导管周围间质肉瘤的临床及影像学表现
刘耀文1,沈训泽2△
(1.重庆医科大学临床医学七年制,重庆 400016;2.绍兴市人民医院放射科,浙江绍兴 312000)
目的 探讨乳腺导管周围间质肉瘤(PDSS)的临床特点、钼靶X线及超声检查的影像学特征。方法选择绍兴市人民医院经手术及病检确诊的PDSS患者1例。对该患者的临床、影像表现进行分析,并复习相关文献。结果患者左乳可触及不规则包块,钼靶X线显示左乳外上象限一略高密度团状阴影,形态不规则,边界模糊,伴左侧腋下一肿大淋巴结;彩色多普勒血流显像(CDFI)显示为病变形态不规则低回声结节。文献报道PDSS可为原发性或转移性,钼靶X线与超声表现存在共性。结论PDSS可复发、血行转移,影像学上多表现为不规则、非均质软组织肿块,CDFI肿瘤内可出现血流信号。
乳腺肿瘤;叶状肿瘤,导管周围间质肉瘤,钼靶X线,超声检查,多普勒,彩色
乳腺导管周围间质肉瘤(periductal stromal sarcoma,PDSS),是一种极罕见的低度恶性纤维上皮性肿瘤,属于乳腺叶状肿瘤的一个亚型,目前国内外文献报道的仅有40余例,且多为病理切片分析,文中附有钼靶X线、超声等重要检查图像的国内外文献少见。本文结合临床病例,探讨其临床特点及影像学特征。
1 资料与方法
1.1一般资料 选择绍兴市人民医院2008年7月至2013年12月,因乳腺包块收入乳腺甲状腺外科行手术治疗的患者4 523例,其中3 419例术后病检证实为乳腺肿瘤,其中1例术后病检证实为PDSS。其临床病史资料完整、真实;术前患者进行了彩色多普勒超声、钼钯X线以辅助诊断。
1.2方法 乳腺投照采用美国GE公司的SENOGRAPHE DMR型钼靶X线机,行钼钯X线检查,摄有头尾位(轴位)、内上外下45°侧斜位乳腺钼靶片。并行彩色多普勒血流显像(CDFI)检查,检查仪器为GE Logiq 700型超声仪,探头频率为11 MHz。
2 结 果
2.1临床表现 患者,女,42岁,3 d前感左乳胀满不适,并触及左乳有一核桃大小肿块,局部无红肿,无乳头溢液。专科查体:左乳外上方可触及一约30 mm×30 mm大小肿块,质地中等,边界不清,无压痛,活动欠佳,与表面皮肤无粘连,乳头无凹陷,右乳未及明显肿块,双腋下未及肿大淋巴结。
2.2钼靶X线检查结果 左乳外上象限见一密度略高团状阴影(图1,粗箭),内见条状低密度影,病灶约22 mm×26 mm大小,形态不规则,边界模糊,未见明显成簇钙化灶,数据系统(BI-RADS)分级为5级。左侧腋下见一枚肿大淋巴结(图1,细箭),直径约11 mm,右腋下未见明显肿大的淋巴结。
2.3CDFI结果 左乳外上象限可见大小约29 mm×16 mm、形态不规则的低回声肿块,中央回声增强(图2A);CDFI见有条状血流穿入(图2B);左腋下见9 mm×5 mm低回声结节,边界清,见图2。
2.4手术治疗过程 行左乳肿块切除术,术中见左乳上方大小约30 mm×40 mm肿块,边界不清,无明显包膜,剖面可见坏死组织。术中快切病理检测:左乳叶状肿瘤(交界性或低度恶性)。再予以行左乳单纯切除术,术后恢复良好,术后随访6个月未出现复发或转移。
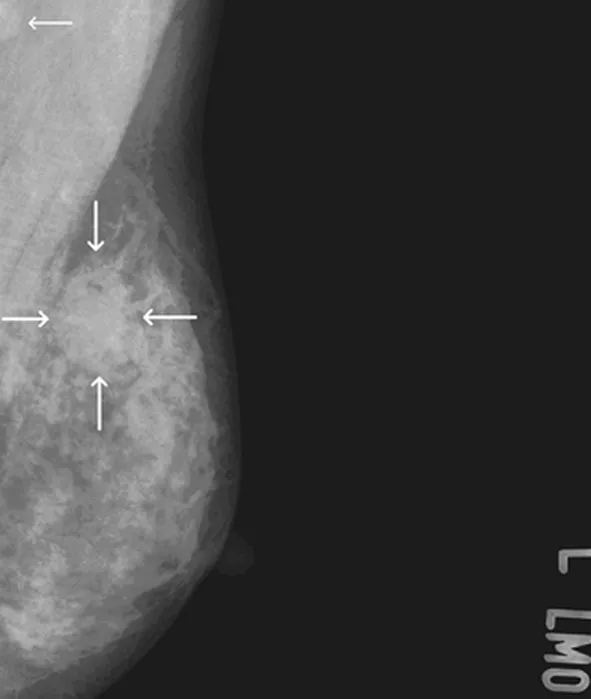
图1 钼靶X线侧斜位片

图2 CDFI图像显示中央回声增强(A)及条状血流穿入(B)
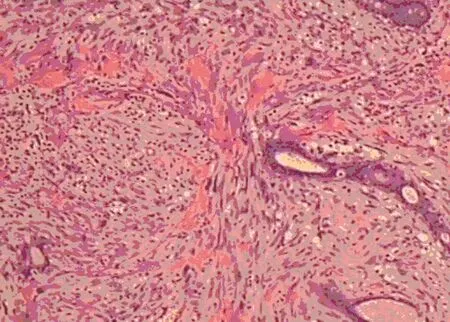
图3 镜下肿瘤细胞核分裂相(HE×100)
2.5术后病理检测 镜下肿瘤由梭形、圆形较幼稚的细胞组成,核深染,核分裂相易见(图3)。免疫组织化学检测:34βE-12(-)、CD10(-)、CD34血管(+)、雌激素受体(ER)(-)、Ki-67(+)<10%、P53(-)、孕激素受体(PR)(-)、S-100(-)、平滑肌肌动蛋白(SMA)(-)、Vim(±)。病理诊断:左乳叶状肿瘤,考虑为导管周围间质肉瘤(低级别)。送检淋巴结3枚均未见转移。
3 讨 论
3.1临床与组织、病理学特点 PDSS是一种起源于导管周间质的、极罕见的低度恶性纤维上皮性肿瘤,好发于乳腺外上象限。PDSS患者多为绝经期前后的女性,发病年龄为37~89岁,中位年龄55.3岁[1];亦有文献报道男性病例[2]。部分患者有乳腺恶性肿瘤的家族史。PDSS是乳腺叶状肿瘤的一个亚型,在组织学上与叶状肿瘤有重叠,主要的区别是无叶状突起[3-4]。该肿瘤并具有特殊双向分化形态表现,由肉瘤样的梭形细胞围绕导管增生,导致导管腔张开,极个别可演化成经典的叶状肿瘤[4]。PDSS组成成分可为纤维成分,也可出现黏液样、脂肪肉瘤样组织成分或上述成分的混杂,故称为间质肉瘤[1-4]。病理显示,在PDSS中,相邻病灶可以逐渐融合成更大的结节样肿块,当此病复发时,病灶可以进展成局部典型的叶状肿瘤,但缺乏小管及叶状结构。叶状肿瘤与纤维腺瘤都是以小叶为中心进展的,而PDSS则是导管旁的病灶[1]。可局部复发,相比于淋巴转移,更易发生血行转移,如转移至肺、纵隔、骨[5-6]。
3.2影像学表现 钼靶X线检查主要检查乳腺的纹理结构和密度,其结果判定依据美国放射协会推荐的“乳腺影像报告和BI-RADS”。超声是乳腺疾病一项重要的辅助检查。乳腺肿瘤术前超声与钼靶摄片联用,以确定手术范围,可显著提高肿瘤的完整切除率,明显降低术后5年内复发率[7]。超声与钼靶摄片联用可以提高20 mm以内的乳腺肿瘤的检出率[8]。Tomas等[9]报道的1例52岁女性PDSS患者,局部皮肤破溃,患者的超声和钼靶片提示侵袭性的边界不清的肿块,不伴钙化,肿瘤最大径达24 cm。Masbah等[2]报道1例14岁男性患者,其右侧乳腺包块在1年内逐渐长大,最后行肿块切除术,病检证实为此病,该患者术前的钼靶X线表现为一大小约1.5 cm×1.0 cm、境界清晰的密度增高结节。Roditi等[10]报道1例65岁女性患者其钼靶X线表现为内下象限境界清晰的分叶状软组织肿块,密度高于邻近乳腺实质,病灶内见不规则块状钙化,提示肿瘤内有骨性成分存在。本例钼靶片上显示为境界不清的浅分叶状稍高密度肿块,内部见条状低密度影,未见钙化。Günhan-Bilgen等[11]报道1例56岁转移性乳腺间质肉瘤患者,其子宫内膜低级别间质肉瘤在行根治术17年后发现转移到乳腺,超声表现为波状不规则外形的、实性为主伴有液性成分的类圆形非均质肿块,后方回声增强;其钼靶X线表现为外下象限直径约2.5 cm不规则肿块,边缘呈波浪状,未见钙化。国内王琳琳等[12]报道1例PDSS,患者发现乳腺肿块后,行超声检查见乳腺等回声肿物,无异常血流信号,并在1个月内迅速增大,大小由2.7 cm×0.8 cm增至3.0 cm×1.1 cm。本例超声上显示为不规则低回声肿块,中央回声增强,术中见肿瘤边界不清,无明显包膜,剖面可见坏死组织。PDSS是叶状肿瘤的一个亚型,其总体影像学表现与交界性及恶性叶状肿瘤鉴别困难,确诊依靠病理。无论原发性还是转移性PDSS,钼靶X线和超声一般都表现为形态不规则的软组织肿块,肿瘤密度或内部回声不均匀,瘤内不出现微钙化。
3.3治疗及预后 到目前为止,报道的PDSS病例数非常有限,所以最佳治疗尚未明确。目前的观点,认为切缘阴性的病灶切除术就足够了,腋窝淋巴结清扫术是没有必要的。本例患者送检淋巴结均未见转移。目前仅有的临床证据,不支持放疗或化疗有效[2]。与叶状肿瘤相似,当切除不完全时,PDSS易局部复发,有发展成特殊软组织肉瘤的潜能,侵袭性肉瘤样变明显的病例更易出现远处转移,因此,广泛扩大手术切除具有必要性[5-6]。PDSS可以合并上皮内瘤变,逐渐从正常的上皮增生演变成导管内癌[13]。
综上所述,PDSS好发于绝经前后女性,原发性多见,偶有源自子宫的转移性PDSS,临床体检可触及乳腺不规则包块,钼靶X线与超声检查缺乏特异性,多表现为不规则、非均质软组织肿块,CDFI肿瘤内可出现血流信号,一般不出现微钙化,确诊依靠病理及免疫组化结果。治疗主要是手术切除,肿瘤可复发、血行转移。
[1]Burga AM,Tavassoli FA.Periductal stromal tumor:a rare lesion with low-grade sarcomatous behavior[J].Am J Surg Pathol,2003,27(3):343-348.
[2]Masbah O,Lalya I,Mellas N,et al.Periductal stromal sarcoma in a child:a case report[J].J Med Case Rep,2011,5(1):249-252.
[3]龚西騟,孟刚,杨枫.乳腺上皮样型管周间质肉瘤病理特征及与叶状肿瘤比较观察[J].临床与实验病理学杂志,2004,19(3):229-235.
[4]Tavassoli FA,Devilee P.World health organization classifcation of tumours.pathology and genetics of tumours of the breast and female genital organs[M].Lyon:IARC Press,2003:101-102.
[5]Chaney AW,Pollack A,Mcneese MD,et al.Primary treatment of cystosarcoma phyllodes of the breast[J].Cancer,2000,89(7):1502-1511.
[6]Hart WR,Bauer RC,Oberman HA.Cystosarcoma phyllodes.A clinicopathologic study of twenty-six hypercellular periductal stromal tumors of the breast[J].Am J Clin Pathol,1978,70(2):211-216.
[7]Akaike G,Tsunoda H,Hayashi N,et al.Ultrasonography mapping combined with mammography before breast-conserving surgery for primary breast cancer with microcalcifications:a novel approach[J].Clin Breast Cancer,2014,5(14):352-357.
[8]Lin H,Lin HS,Liang H.Diagnostic value of ultrasonography in combination with mammography for breast cancer within 2 cm:a meta-analysis[J].Nan Fang Yi Ke Da Xue Xue Bao,2013,33(11):1699-1703.
[9]Tomas D,Jankovic D,Marusic Z,et al.Low-grade periductal stromal sarcoma of the breast with myxoid features:immunohistochemistry[J].Pathol Int,2009,59(8):588-591.
[10]Roditi G,Prasad S.Radiology of stromal sarcoma of the breast with ossifying pleural metastases[J].Br J Radiol,1994,67(794):212-214.
[11]Günhan-Bilgen I,Memis A,Üstün E,et al.Breast metastasis from low-grade endometrial stromal sarcoma after a 17-year period[J].Eur Radiol,2002,12(12):3023-3025.
[12]王琳琳,周晓秋,高虹,等.乳腺导管周围间质肉瘤1例并文献复习[J].临床与实验病理学杂志,2013,29(5):565-566.
[13]Rosen PP.Rosen′s Breast Pathology[M].2nd ed.Baltimore:Lippincott Williams Wilkins,2001:188-191.
刘耀文(1989-),住院医师,在读硕士研究生,主要从事临床医学、神经病学方面研究。
△通讯作者,E-mail:shenxunze@163.com。
验交流·
10.3969/j.issn.1671-8348.2015.11.039
R655.8
B
1671-8348(2015)11-1547-03
2014-02-26
2014-12-28)
