大肠癌组织中VEGF、MIF的表达及临床意义
2015-01-05王苗锋熊茂明李火友龙腾云
王苗锋,熊茂明,李火友,龙腾云
(安徽医科大学第一附属医院普外科,安徽合肥 230032)
大肠癌组织中VEGF、MIF的表达及临床意义
王苗锋,熊茂明△,李火友,龙腾云
(安徽医科大学第一附属医院普外科,安徽合肥 230032)
目的 探讨大肠癌组织中血管内皮生长因子(VEGF)及人巨噬细胞游走抑制因子(MIF)的表达及临床意义。方法选取80份经手术切除并经病理证实为大肠癌的组织蜡块(观察组)及80份距癌肿边缘5 cm以上经病理证实无癌细胞残存的正常大肠组织(对照组),SP法检测VEGF、MIF在大肠癌及正常大肠组织中的表达。结果VEGF,MIF 在观察组中阳性率为77.50%、82.50%,在对照组阳性率为22.50%、27.50%,观察组阳性率明显高于对照组,差异有统计学意义(P<0.05)。VEGF、MIF在大肠癌组织中的表达与肿瘤的浸润深度、淋巴结转移、临床分期相关,与性别、年龄、组织学分化无关。结论VEGF、MIF在大肠癌组织中高表达。
结直肠肿瘤;血管内皮生长因子类;巨噬细胞游走抑制因子;免疫组织化学
大肠癌是常见的消化道恶性肿瘤之一,其发病率逐年上升,目前是位居中国第四的恶性肿瘤,与饮食习惯改变及缺乏运动有一定关系,发病高峰年龄为40~50岁,且有年轻化趋势。手术切除肿瘤及术后化疗是目前治疗大肠癌的主要方法,但大肠癌具有易复发、转移的特点,严重影响术后远期效果。有研究表明,新生血管的形成在恶性肿瘤发生、发展、侵袭、转移中具有重要的作用;血管内皮生长因子(vascular endothelial growth factor,VEGF),早期亦称作血管通透因子(vascular permeability factor,VPF),可在体内诱导血管新生,参与肿瘤的发生、发展,是恶性肿瘤浸润转移的重要原因;人巨噬细胞游走抑制因子(macrophage migration-inhibitory factors,MIF) 是一种多生物学功能的细胞因子,可以促进肿瘤血管的增生、肿瘤的扩散。本实验通过检测大肠癌组织和正常大肠组织中VEGF、MIF的表达,并分析二者与大肠癌临床病理特征之间的关系。
1 资料与方法
1.1一般资料 选取本院2007~2008年病理科存档的80份大肠癌组织蜡块(观察组),其中男48例,女32例,年龄35~85岁,平均58.61岁;患者术前均未行化疗、放疗,术后均行规范的化疗或化疗加放疗;80份正常大肠组织(对照组)取自距离癌肿边缘5 cm以上,且经病理证实无癌细胞残存。其中行右半结肠切除术17例,左半结肠切除术11例,横结肠切除术9例,Dixon术25例,Miles术15例,Hartmann术3例;术后病理证实伴淋巴结转移者45例,其中远处转移9例;低分化者30例,中分化者19例,高分化者31例;TNM 临床分期按国际抗癌联盟(UICC) 2002 年制定的标准进行:Ⅰ期9例,Ⅱ期17例,Ⅲ期35例,Ⅳ期19例。
1.2方法
1.2.1检测方法 存档石蜡标本4 μm 厚连续切片,采用免疫组化SP法染色,其步骤严格按照试剂盒说明书进行。用已知阳性结果作为阳性对照,PBS液代替一抗作为阴性对照。主要试剂:单克隆抗体和免疫组化试剂盒自北京中山金桥生物科技有限公司购买。
1.2.2结果评价标准 所有切片均随机选取5 个高倍视野进行结果判定。按照染色强度、阳性细胞数占肿瘤细胞总数的百分比计分。染色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞数:小于总数的10%为0分,10%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。将染色强度得分与阳性细胞数得分相乘计算,<4分为阴性,≥4分为阳性。
1.3统计学处理 应用SPSS17.0统计软件进行分析,计数资料用率表示,组间比较采用χ2检验,分类变量间相关性检验采用Pearson等级相关分析,以P<0.05为差异有统计学意义。
2 结 果
2.1两组VEGF和MIF表达比较 VEGF和MIF的表达主要定位于细胞质(图1)。观察组中VEGF、MIF的阳性表达率显著高于对照组,差异有统计学意义(P<0.05),见表1。
2.2大肠癌中VEGF、MIF的表达与临床病理参数间的相关性 VEGF、MIF与大肠癌浸润深度、淋巴结转移、临床分期呈显著正相关,差异有统计学意义(P<0.05);而与性别、年龄、分化程度无关,差异无统计学意义(P>0.05),见表2。
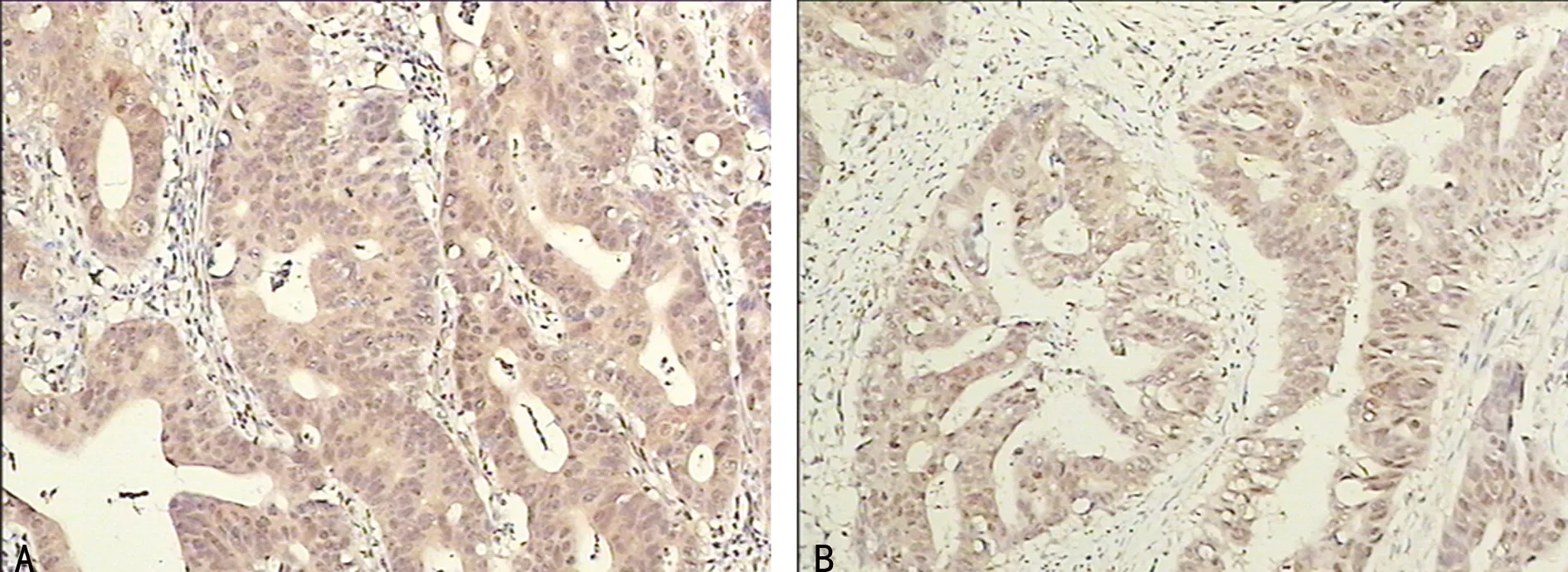
A:VEGF;B:MIF。
图1 VEGF及MIF在大肠癌组织中的表达(SP×400)
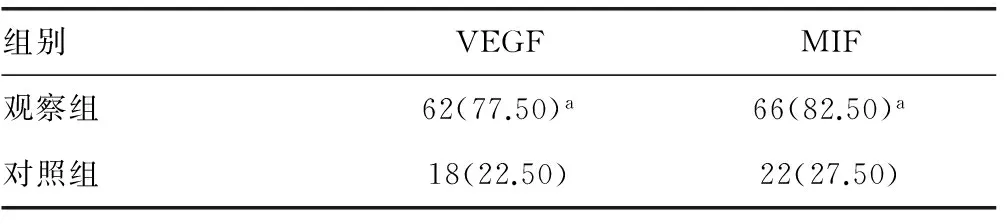
表1 两组VEGF、MIF阳性表达率比较[n(%),n=80]
a:P<0.05,与对照组比较。

表2 VEGF、MIF在大肠癌中表达与临床病理参数的相关性[n(%)]
2.3大肠癌组织中VEGF与MIF表达的相关性 经Pearson相关分析,结直肠癌组织中VEGF与MIF表达呈显著正相关,差异有统计学意义(r=0.889,P<0.05),见表3。
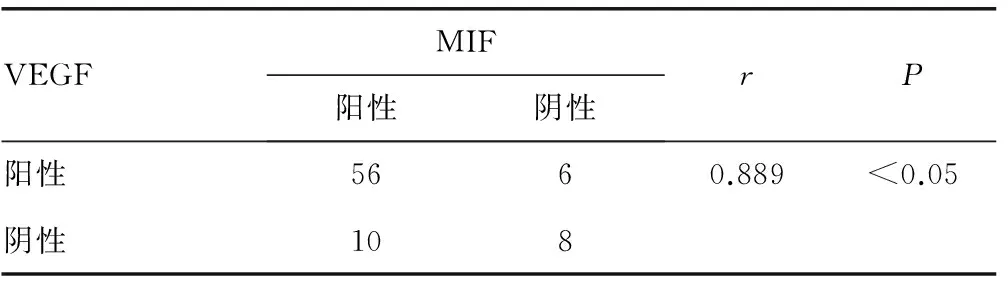
表3 大肠癌组织中VEGF与MIF表达的相关性
2.4VEGF、MIF表达与大肠癌患者生存期的关系 80例患者成功随访69例,生存5年以上患者42例,生存率60.87%(42/69),其中8例复发,复发率19.05%(8/42);8例复发患者VEGF阳性率为87.50%(7/8),MIF阳性率为100.00%(8/8);大肠癌组织中VEGF与MIF阳性患者与阴性患者比较,生存率显著降低,差异有统计学意义(P<0.05),见表4。

表4 VEGF及MIF阳性与阴性表达患者生存率比较(%)
a:P<0.05,与VEGF阴性比较;b:P<0.05,与MIF阴性比较。
3 讨 论
恶性肿瘤的发生、发展、复发、转移是一个复杂过程涉及多个因素,其中新生血管形成是关键步骤。有研究表明,新血管的产生对肿瘤的发生至关重要[1-2],抑制肿瘤血管可以抑制肿瘤的生长。VEGF是一种多功能细胞因子,正常情况下,人体的血管代谢会保持在某种动态平衡状态,因此VEGF在人体血管内的水平是相对恒定的;而肿瘤血管期时,血液中VEGF水平会升高,并通过受体的介导发挥作用,促进肿瘤内皮细胞增殖,并阻止内皮细胞凋亡,VEGF的抗细胞凋亡活性部分是通过磷脂酰肌醇-3羟基酶/蛋白激酶B(PI3K/Akt)途径的活化所介导,同时VEGF也可抑制血管内皮细胞凋亡的诱导凋亡调节蛋白如B淋巴细胞瘤-2基因相关蛋白(Bcl-2A1)的存活和表达[3]。VEGF还能增加肿瘤血管的通透性,从而促进肿瘤细胞进入血液而发生转移。当肿瘤的生长受到抑制或者肿瘤病灶缩小,则相应地会出现VEGF在血液中的浓度下降。VGEF在肿瘤血管生成中具有重要的调控作用,是现阶段已知的作用最强的促血管形成因子之一,VEGF及其受体过度表达与肿瘤的生长、侵袭、 转移密切相关。大量研究证明抑制VEGF可抑制肿瘤血管形成,从而进一步抑制肿瘤生长[4-5]。VEGF及其受体靶向治疗癌症的药物是目前一个热门的研究,其重要性越来越受到重视。本结果显示,大肠癌组织中VEGF阳性率显著高于大肠正常组织,T1/2的阳性率为32.26%,T3/4的阳性率为67.74%;伴淋巴结转移者的阳性率为64.52%,无淋巴结转移者的阳性率为35.48%;Ⅲ/Ⅳ期患者阳性率为79.03%,Ⅰ/Ⅱ期患者阳性率为28.97%;由此看出大肠癌患者浸润程度越深、伴淋巴结转移、临床分期越晚的患者其VEGF的阳性率越高,故VEGF表达水平可作为反映大肠癌生物学行为的参考指标之一。
MIF由活化的T淋巴细胞分泌,早期被认为主要在机体炎性反应中发挥作用,近年来发现MIF在癌症的发生、发展中亦是一个关键因素,它通过促进肿瘤血管生成、细胞分裂增殖发挥作用,并抑制细胞凋亡。有研究显示,MIF在大肠癌、胃癌、肝癌、乳腺癌、卵巢癌、膀胱癌等多种恶性肿瘤中有过度表达[6-8]。本结果显示,MIF在大肠癌组织中高表达,且伴淋巴结转移者阳性率高于无转移者,提示MIF可能在大肠癌肝转移中发挥一定的作用,何兴祥等[9]研究显示,MIF在大肠癌肝转移中有重要作用。相关研究还表明,MIF可促进VEGF表达上调[10-11],本研究结果显示,二者的表达有相关性,说明MIF和其他促肿瘤因子间存在一定的协同作用。MIF除促进肿瘤的血管生成和细胞增殖外,还通过多种途径促进肿瘤的浸润转移。有研究发现,MIF对P53有一定的抑制作用,进一步从分子水平阐明了MIF有促进肿瘤发生、发展的机制[12]。MIF作为一种肿瘤标记物,不管是在大肠癌还是胃癌等其他恶性肿瘤,其重要性越来越受到重视[13-15]。随着对MIF研究的深入,把MIF作为分子标记物用于对恶性肿瘤的早期诊断及肿瘤的靶向性治疗将成为治疗肿瘤的一条新途径。
综上所述,大肠癌组织中VEGF、MIF的表达阳性率显著高于大肠正常组织。VEGF、MIF主要通过促进肿瘤血管生成,导致肿瘤侵袭、转移,且VEGF、MIF间可能存在某种协同关系,共同促进肿瘤的发生、发展。所以在诊断和治疗大肠癌患者时,应密切关注VEGF、MIF的表达情况,这对指导制订手术后的治疗方案有重要指导作用。
[1]Hsu AW,Sodhi A,Eberhart C,et al.Regression of choroidal neovascularization in response to systemic chemotherapy for cancer [J].Canadian J Ophthalmol,2013,48(4):e80-82.
[2]Nunez-Cruz S,Gimotty PA,Guerra MW,et al.Genetic and pharmacologic inhibition of complement impairs endothelial cell function and ablates ovarian cancer neovascularization[J].Neoplasia,2012,14 (11):994-1004.[3]Gerber HP,Dixit V,Ferrara N.Vascular endothelial growth factor induces expression of the antiapoptotic proteins Bcl-2 and A1 in vascular endothelial cells[J].J Biol Chem,1998,273(21):13313-13316.
[4]Hicklin DJ,Ellis LM.Role of the vascular endothelial growth factor pathway in tumor growth and angiogenesis [J].J Clin Oncol,2005,23(5):1011-1027.
[5]Ferrara N,Kerbel RS.Angiogenesis as a therapeutic target [J].Nature,2005,438(7070):967-974.
[6]He XX,Yang J,Ding YW,et al.Increased epithelial and serum expression of macrophage migration inhibitory factor(MIF) in gastric cancer:potential role of MIF in gastric carcinogenesis[J].Gut,2006,55(6):797-802.
[7]Agarwal R,Whang DH,Alvero AB,et al.Macrophage migration inhibitory factor expression in ovarian cancer [J].Am J Obstet Gyneco,2007,196(4):348.e1-5.
[8]Krockenberger M,Dombrowski Y,Weidler C,et al.Macrophage migration inhibitory factor contributes to the immune escape of ovarian cancer by down-regulating NKG2D[J].J Immunol,2008,180(11):7338-7348.
[9]何兴祥,李晓宇,郝元涛,等.巨噬细胞移动抑制因子与大肠癌肝转移的关系[J].中华普通外科杂志,2007,22(11):855-858.
[10]蔡施霞,余细勇,林秋雄,等.MIF促进新生微血管生成及其相关基因表达的研究[J].中国心血管杂志,2007,12(3):169-171.
[11]Zernecke A,Bernhagen J,Weber C.Macrophage migration inhibitory factor in cardiovascular disease[J].Circulation,2008,117(12):1594-602.[12]Fingerle-Rowson G,Petrenko O.The p53-dependent effects of macrophage migration inhibitory factor revealed by gene targeting[J].Proc Natl Acad Sci USA,2003,100 (16):9354-9359.
[13]Gerrit G,Melanie M,Bernhagen J,et al.Macrophage migration inhibitory factor:a promising biomarker [J].Drug News Persp,2010,23(4):257-264
[14]Camlica H,Duranyildiz D,Oguz H,et al.The diagnostic value of macrophage migration inhibitory factor (MIF) in gastric cancer [J].Pathol Oncol Res,2008,14(1):79-83
[15]Mohri Y,Mohri T,Wei W,et al.Identification of macrophage migration inhibitory factor and human neutrophil peptides 1-3 as potential biomarkers for gastric cancer[J].Br J Cancer,2009,101(2):295-302.
Expression and significance of VEGF,MIF in colorectal cancer*
WangMiaofeng,XiongMaoming△,LiHuoyou,LongTengyun
(DepartmentofGeneralSurgery,FirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei,Anhui230032,China)
Objective To detect the expression of vascular endothelial growth factor(VEGF) and migration inhibitory factor(MIF) in colorectal cancer.Methods The immunohistochemical staining (SP method) was used to measure the expression of VEGF and MIF in 80 samples of colorectal cancer and 80 samples of normal colorectal tissues at 5 cm apart from the tumor edge.The relationship between VEGF and MIF with the clinical pathologic characteristics of colorectal cancer was anlyzed.Results The positive rates of VEGF and MIF in the colorectal cancer tissues were 77.50% and 82.50% respectively,but which in the normal colorectal tissues were 22.50% and 27.50% respectively,the positive rate of VEGF and MIF expression in the colorectal cancer tissues were higher than that in the normal colorectal tissue with statistical difference(P<0.05).The expression of VEGF and MIF had correlation with the tumor infiltration depth,lymph node metastasis,and clinical stage,but no correlation with gender,age and histodifferentiation.Conclusion VEGF and MIF are highly expressed in the colorectal cancer tissues.
colorectal neoplasms;vascular endothelial growth factors;macrophage migration-inhibitory factors;immunohistochemistry
·临床研究
10.3969/j.issn.1671-8348.2015.11.012
安徽省高等学校省级自然科学研究重点项目(KJ2011A155);安徽省卫生厅医学科学研究基金(2010B007)。
王苗锋(1988-),医师,在读硕士研究生,主要从事消化道恶性肿瘤研究。
△通讯作者,Tel:(0551)62922813;E-mail:xiongmd@aliyun.com。
R735.3+4
A
1671-8348(2015)11-1478-03
2014-10-08
2015-01-15)
