沉默Nek2基因对卵巢癌SKOV3细胞周期的影响
2015-01-05范婷婷唐良萏
范婷婷,唐良萏
(1.重庆市合川区人民医院妇科,重庆合川 401520;2.重庆医科大学附属第一医院妇产科,重庆 400016)
沉默Nek2基因对卵巢癌SKOV3细胞周期的影响
范婷婷1,唐良萏2△
(1.重庆市合川区人民医院妇科,重庆合川 401520;2.重庆医科大学附属第一医院妇产科,重庆 400016)
目的 研究RNA干扰NIMA相关激酶2(Nek2)表达对卵巢癌细胞SKOV3细胞周期的影响及其相关的分子机制。方法将针对Nek2基因的siRNA转染至SKOV3细胞中,采用流式细胞技术检测SKOV3细胞周期变化,并用Western blot技术检测Nek2-siRNA转染入卵巢癌SKOV3细胞48 h后,与细胞周期相关的因子cyclinB1、CDK1及P27蛋白表达水平以及ERK1/2磷酸化水平的变化。结果空白对照组、阴性对照组和RNA干扰组中处于G2/M期的细胞比例分别为13.72%、12.27%和1.56%,与两对照组比较,处于G2/M期的干扰组细胞明显减少(P<0.05)。Nek2基因沉默后,与两对照组比较,SKOV3细胞内cyclinB1和CDK1的蛋白表达水平明显下降,P27的蛋白表达水平明显上调,SKOV3细胞内ERK1/2磷酸化水平明显下降(P<0.05)。结论沉默Nek2基因,可阻止卵巢癌SKOV3细胞启动有丝分裂,从而抑制其增殖。
RNA干扰;卵巢肿瘤;细胞周期;NIMA相关激酶
近年来,抗体芯片技术为肿瘤的早期诊断、肿瘤标志物的筛选鉴定以及药物治疗等方面提供了新的研究平台,尤其在对肿瘤标志物的筛选和鉴定中运用最为广泛。在前期实验中,本课题组通过反向捕获抗体芯片技术筛查发现NIMA相关激酶2(NIMA-related kinase2,Nek2)在卵巢癌中高表达,且NEK2-siRNA能有效抑制SKOV3细胞中Nek2的表达。由于Nek2是细胞周期Nek家族成员之一,在细胞周期中,其表达及活性高度保守。因此,本实验将利用NEK2-siRNA进一步研究Nek2基因与卵巢癌SKOV3细胞周期的关系。
1 材料与方法
1.1材料 卵巢浆液性乳头状囊腺癌细胞株SKOV3由第三军医大学大坪医院野战外科研究所馈赠。Nek2、P27、cyclinB1、CDK1一抗均购自Abcam公司。Trizol、Lipofectamine 2000购自Invitrogen公司。根据Nek2基因序列,由上海吉玛公司设计合成Nek2-siRNA序列,上游引物:5′-GGC ACA CCU UAU UAC AUG UTT-3′,下游引物:5′-ACA UGU AAU AAG GUG UGC CTT-3′。
1.2方法
1.2.1细胞转染及分组 (1)细胞转染:在37 ℃、5%CO2饱和湿度的条件下,用含10%胎牛血清的RPMI1640培养液培养SKOV3细胞。用胰酶消化对数生长期细胞,制备成细胞悬液,将细胞按30%~50%密度接种于6孔板,培养过夜。转染过程:首先制备siRNA/脂质体复合物,于室温放置20 min;然后转染细胞,混匀后放入培养箱中培养,24 h后观察转染情况。(2)细胞分组:将实验细胞分为3组,转染Nek2-siRNA的SKOV3细胞为干扰组,转染阴性对照序列的为阴性对照组,未经任何处理的为空白对照组。转染48 h后,用胰酶消化收集细胞,进行以下实验。
1.2.2流式细胞仪检测细胞周期 转染48 h后收集细胞,使每个样本细胞约为1×106个。弃上清液,于离心管中加入70%的预冷乙醇1 mL,吹打均匀,4 ℃固定12 h以上。检测前1 000 r/min离心5 min,吹散细胞后用30D尼龙滤过膜过滤,减少聚在一起的细胞。用0.5 mL PBS重悬细胞,加入RNA酶,使其终浓度为50 μg/mL,37 °C孵育30 min,冰浴终止酶作用。加入5 μL 浓度为100 μg/mL碘化丙啶(PI)溶液,室温中避光染色30 min,最后采用流式细胞仪检测细胞周期,实验重复3次。
1.2.3Western blot法检测转染后的SKOV3细胞中P27、cyclinB1、CDK1及pERK1/2蛋白表达的变化 提取各组总蛋白,进行蛋白定量,取等量样本30 μg上样于10%的聚丙烯酰胺凝胶电泳,然后转膜。取出转移好的PVDF膜,确定转膜成功后,封闭,加一抗(1∶200)或β-actin抗体(1∶1 000),4 ℃孵育过夜。加入二抗(1∶5 000),室温下脱色摇床上摇动封闭90 min,化学发光显影。最后利用柯达数字科学图像分析软件测定蛋白印迹条带净灰度值,以β-actin为内参照,计算二者的比值即为目的蛋白的相对表达水平。

2 结 果
2.1Nek2-siRNA干扰后对卵巢癌SKOV3细胞周期的影响 转染Nek2-siRNA 48 h后,用流式细胞仪检测SKOV3细胞周期结果表明,抑制Nek2的表达后,空白对照组、阴性对照组和干扰组处于G2/M期的细胞比例分别为:13.72%、12.27%和1.56%,干扰组细胞在S→G2转换时受到抑制,处于G2/M期的干扰组细胞明显减少,(P<0.05),见图1。

1.空白对照组;2.阴性对照组;3.干扰组。
图1 流式细胞仪检测细胞周期(n=3)
1.空白对照组;2.阴性对照组;3.干扰组;a:P<0.05,与干扰组比较。
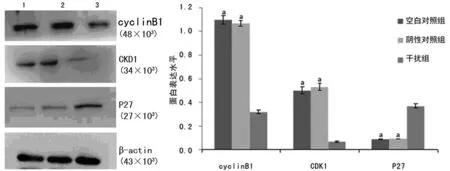
图2 3组SKOV3细胞中cyclinB1等表达比较(n=3)
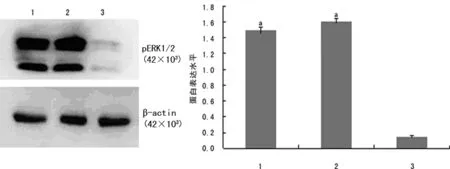
1:空白对照组;2:阴性对照组;3:干扰组;a:P<0.05,与干扰组比较。
图3 3组SKOV3细胞中pERK1/2表达比较(n=3)
2.2NEK2-siRNA干扰后SKOV3细胞中cyclinB1、CDK1和P27蛋白表达的变化 Nek2-siRNA转染SKOV3细胞48 h后,cyclinB1、CDK1的表达明显下调,P27的表达明显上调(P<0.05),见图2。
2.3NEK2-siRNA干扰后SKOV3细胞中磷酸化ERK1/2(pERK1/2)表达的变化 Nek2-siRNA转染SKOV3细胞48 h后,与空白、阴性对照组比较,pERK1/2的表达水平明显降低(P<0.05),见图3。
3 讨 论
Nek2是Nek家族成员之一,目前该家族拥有11个家族成员(Nek1~11),它们具有相似的催化序列,其中因Nek2与NIMA的同源性最高而备受关注。Nek2属于丝氨酸/苏氨酸蛋白激酶,定位于中心体,有着激酶区域的氨基末端以及未催化调节区域的羧基末端,并通过磷酸化C-Nap1、rootletin、Nlp等底物调节纺锤体的形成和分离[1-2]。
近年来的研究表明,Nek2是协调中心体结构和功能的重要因子,其通过与中心体蛋白的相互作用参与微管组装并维持微管稳定,进而维持中心体的稳定[3];通过磷酸化C-Nap1、rootletin、Nlp等底物调节纺锤体的形成和分离[1-2];通过磷酸化高迁移率族蛋白(high-mobility group protein A2,HMGA2)参与染色质的凝集;通过与Hec1、Mad1、Mda2的相互作用控制纺锤体检查点[4-5]。Nek2表达水平具有周期依赖性,G1期时Nek2表达水平很低,但在G1/S间期其表达水平迅速上升3~4倍,并且在整个S期和G2期都保持这种高表达水平,一旦进入M期,Nek2的表达水平迅速降低[6]。由于Nek2的表达与细胞周期进程密切相关,本实验利用流式细胞技术来探索Nek2基因沉默后对SKOV3细胞周期的影响。本检测结果发现,与两对照组比较,Nek2表达的下降导致细胞周期分布出现异常,干扰组细胞在S→G2转换时受到抑制,处于G2/M期细胞明显减少。本结果表明,基因沉默Nek2可使SKOV3 细胞进入G2/M期受阻,导致细胞最后不能顺利通过有丝分裂期,进入下一个细胞周期,从而使细胞增殖能力降低。
有研究发现,Nek2定位于中心体并参与调节有丝分裂[7],其在S期和G2期保持高表达水平,具有明显的周期依赖性[6]。结合流式检测结果可知,抑制Nek2的表达对SKOV3细胞进入G2/M期有明显影响。因此,本实验选择cyclinB1、CDK1和P27进行Western blot检测,初步探讨Nek2影响细胞周期的有关机制。实验结果表明,Nek2-siRNA转染SKOV3细胞48 h后,cyclinB1和CDK1的蛋白表达水平较空白对照组明显下降,P27的蛋白表达水平明显上调。根据结果可推测,Nek2基因沉默后,通过对G2/M检查点关键因子cyclinB1和CDK1以及对抑癌基因P27的调控,抑制SKOV3细胞进入G2/M期,从而不能启动有丝分裂,无法进入下一个细胞周期,因此抑制了细胞增殖。Scott等[8]对浆液性卵巢肿瘤组织进行研究发现,cyclinB1的表达水平随着卵巢肿瘤恶性程度的增加而增加。有研究证明,cyclinB1在多种恶性肿瘤中高表达,如胃癌、乳腺癌、淋巴瘤等[9-11],由此可知cyclinB1与肿瘤的发生、发展密切相关。因此,本实验认为可通过Nek2基因沉默使SKOV3细胞中cyclinB1的表达水平下降,从而达到抑制肿瘤细胞生长的目的。
细胞外信号调节激酶(extrallular signal regulated protein kinase,ERK)是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族成员之一,细胞内许多信号因子最终都是通过磷酸化ERK来发挥作用,可以说ERK是调节细胞生长发育的信号网络核心,调控着细胞的增殖、分化和凋亡等重要的生物学过程[12]。近年来的研究证明ERK信号通路不仅参与对细胞周期G1/S的调节,而且参与对G2/M期调控[13-14]。为研究Nek2通过何种信号转导通路来调控SKOV3细胞的各种生物学行为,本实验对ERK1/2的磷酸化水平进行检测,结果表明,Nek2-siRNA转染入SKOV3细胞48 h后,与空白对照组比较,pERK1/2的表达水平明显降低,说明Nek2依赖ERK信号通路发挥作用。
综上所述,使用RNAi技术特异性沉默Nek2基因能够有效抑制细胞周期相关因子cyclinB1和CDK1的蛋白表达,同时使P27蛋白表达增加,从而抑制SKOV3细胞进入G2/M期,使其无法启动有丝分裂,因此抑制了细胞增殖。根据以上研究结果可推测,通过对Nek2基因进一步的深入研究,使其有望成为临床上监测卵巢癌发生、发展以及评估预后的新的标记物。Nek2基因及其信号转导通路中的相关因子可作为抑制卵巢癌转移和复发的重要靶点。
[1]Bahe S,Stierhof YD,Wilkinson CJ,et al.A Rootletin forms centriole-associated filaments and functions in centrosome cohesion[J].J Cell Biol,2005,171(1):27-33.
[2]Rapley J,Baxter JE,Blot J,et al.Coordinate regulation of the mother centriole component Nlp by Nek2 and Plk1 protein kinases[J].Mol Cell Biol,2005,25(4):1309-1324.
[3]Jeong Y,Lee J,Kim K,et al.Characterzation of NIP2/centrobin,a novel substrate of Nek2,and its potential role in microtubule stabilization[J].J Cell Sci,2007,120(Pt 12):2106-2116.
[4]Di Agostino S,Fedele M,Chieffi P,et al.Phosphorylation of high-mobility group protein A2 by Nek2 kinase during the first meiotic division in mouse spermatocytes[J].Mol Biol Cell,2004,5(3):1224-1232.
[5]Chen Y,Riley DJ,Zheng L,et al.Phosphorylation of the mitotic regulator protein Hec1 by Nek2 kinase is essential for faithful chromosome segregation[J].J Biol Chem,2002,277(51):49408-49416.
[6]Hames RS,Fry AM.Alternative splice variants of the human centrosome kinase Nek2 exhibit distinct patterns of expression in mitosis[J].Biochem J,2002,361(Pt 1):77-85.
[7]Hayward DG,Newbatt Y,Pickard L,et al.Identification by high-throughput screening of viridin analogs as biochemical and cell-based inhibitors of the cell cycle-regulated Nek2 kinase[J].J Biomol Screen,2010,15(8):918-927.
[8]Scott IS,Heath TM,Morris LS,et al.A novel immunohistochemical method for estimating cell cycle phase distribution in ovarian serous neoplasms:implications for the histopathological assessment of paraffin-embedded specimens[J].Br J Cancer,2004,90(8):1583-1590.
[9]Yasuda M,Takesue F,Inutsuka S,et al.Overexpression of cyclin B1 in gastric cancer and its clinicopathological significance:an immunohistological study[J].J Cancer Res Clin Oncol,2002,128(8):412-416.
[10]Suzuki T,Urano T,Miki Y,et al.Nuclear cyclin B1 in human breast carcinoma as a potent prognostic factor[J].Cancer Sci,2007,98(5):644-651.
[11]Bai M,Vlachonikolis J,Agnantis NJ,et al.Low expression of P27 protein combined with altered p53 and Rb/p16 expression status is associated with increased expression of cyclin A and cyclin B1 in diffuse large B-cell lymphomas[J].Mod Pathol,2001,14(11):1105-1113.
[12]Murphy LO,Blenis J.MAPK signal specificity:the right place at the right time[J].Trends Biochem Sci,2006,31(5):268-275.
[13]Pan TL,Wang PW,Leu YL,et al.Inhibitory effects of Scutellaria baicalensis extract on hepatic stellate cells through inducing G2/M cell cycle arrest and activating ERK-dependent apoptosis via Bax and caspase pathway[J].J Ethnopharmacol,2012,139(3):829-837.
[14]Xu Y,Liu L,Qiu X,et al.CCL21/CCR7 promotes G2/M phase progression via the ERK pathway in human non-small cell lung cancer cells[J].PLoS One,2011,6(6):e21119.
Effect of silencing Nek2 gene on cell cycle of ovarian cancer SKOV3 cells*
FanTingting1,TangLiangdan2△
(1.DepartmentofGynecology,HechuanDistrictPeople′sHospital,Chongqing401520,China;2.DepartmentofGynecologyandObstetrics,FirstAffilliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China)
Objective To study the effect of silencing Nek2 via RNAi on cell cycle of ovarian cancer SKOV3 cells and the related molecular mechanism.Methods The Nek2-siRNA was transfected into the ovarian cancer SKOV3 cells.The change of cell cycle of SKOV3 cells at 48 h after transfection was examined by the flow cytometry technique;Western blot assay was used to determine the change of level of the cell cycle related factors cyclinB1,CDK1,P27 and the phosphorylation level of the ERK1/2 after Nek2-siRNA transfection for 48 h.Results The flow cytometry detection results showed that the proportion of the cells in G2/M stage in the blank control group,negative control group and RNAi group was 13.72%,12.27% and 1.56% respectively.Compared with the control group,the number of the cells in G2/M stage in the transfected group was reduced obviously(P<0.05).The Western blot detection results showed that compared with the control group,the expression of cyclinB1 and CDK1 protein in SKOV3 cells was significantly reduced,the expression of P27 was increased after silencing Nek2 and the phosphorylation level of ERK1/2 in SKOV3 cells was significantly reduced after silencing Nek2 gene(P<0.05).Conclusion Silencing Nek2 gene might block the ovarian cancer cell line SKOV3 initiating mitosis,thus inhibit their proliferation.
RNA interference;ovarian neoplasms;cell cycle;NIMA-related kinase
·基础研究
10.3969/j.issn.1671-8348.2015.11.007
教育部博士点基金资助项目(20080631001);重庆市卫生局重点项目(2009-1-59)。
范婷婷(1979-),主治医师,博士研究生,主要从事妇科肿瘤的诊治研究。
△通讯作者,Tel:(023)89011092;Email:ldtang2002@yahoo.com.cn。
R737.31
A
1671-8348(2015)11-1463-03
2014-11-13
2014-12-28)
