皮肤黑色素瘤细胞中TGF-βRⅠ型和Ⅱ型受体表达的研究
2015-01-05陈宏泉
郁 博,张 斌,苏 磊,潘 敏,陈宏泉△
(1.青岛大学附属医院皮肤科,山东青岛266003;2.第三军医大学新桥医院皮肤科,重庆 400037)
皮肤黑色素瘤细胞中TGF-βRⅠ型和Ⅱ型受体表达的研究
郁 博1,张 斌2,苏 磊1,潘 敏1,陈宏泉1△
(1.青岛大学附属医院皮肤科,山东青岛266003;2.第三军医大学新桥医院皮肤科,重庆 400037)
目的 探讨转化生长因子β受体(TGF-βR)Ⅰ、Ⅱ型在皮肤黑色素瘤细胞中的表达情况。方法应用反转录-实时荧光定量PCR(RT-PCR)和蛋白免疫印迹(Western blot)方法,对TGF-βRⅠ、Ⅱ型的mRNA及其蛋白在人皮肤黑色素瘤A375细胞和人正常黑素细胞中的表达进行检测。结果A375细胞中TGF-βRⅠ、Ⅱ型的mRNA和蛋白表达均显著低于正常人黑素细胞。结论在黑色素瘤细胞的TGF-β/Smad信号通路中出现TGF-βR表达的下调,可能是皮肤黑色素瘤发病机制之一。
黑色素瘤;受体,转化生长因子β;黑素细胞
在皮肤肿瘤的致死率排名中,皮肤黑色素瘤一直高居首位。过去的50年间,其发病率增加超出6倍,黑色素瘤一旦发生转移,则预后极差,总体5年生存率小于5%,中位生存期为6~10个月。其病理变化表现为黑素细胞失控性增殖。转化生长因子β (transforming growth factor-β,TGF-β)是一种具有多项生物学作用的细胞因子。它广泛存在于体内,对大多数上皮细胞具有生长抑制作用。TGF-β通过其受体(TGF-βR)来发挥重要生物学作用。有研究显示,在眼葡萄膜黑色素瘤组织中存在TGF-βR的表达异常[1-2],提示TGF-β信号转导途径的改变与黑色素瘤的发生和发展有较为密切的关系。在人黑色素瘤组织中是否存在TGF-βR的表达异常?本实验以体外培养的人恶性黑色素瘤A375细胞为研究对象,采用反转录-实时荧光定量PCR(RT-PCR)和蛋白免疫印迹(Western blot)方法对其TGF-βRⅠ、Ⅱ的mRNA及其蛋白在人皮肤黑色素瘤A375细胞和人正常黑素细胞中的表达分别进行检测,现报道如下。
1 材料与方法
1.1材料 (1)细胞:人黑色素瘤细胞A375细胞系(以下简称A375细胞)购自中国科学院上海细胞生物研究所。(2)主要试剂及仪器:DMEM培养液和胎牛血清购自美国Gibco公司,PrimeScriptTMRT Reagent Kit试剂盒、SYBR®Premix Ex TaqTM购自日本TaKaRa Bio株式会社,抗TGF-βRⅠ、Ⅱ多克隆抗体购自Santa Cruz公司,Chemi ImagerTM5500型凝胶成像分析仪购自美国Alpha Innotech公司,7500 Real Time 荧光定量PCR反应扩增仪购自美国Applied Biosystems公司,半干电转仪购自美国Bio-Rad公司。
1.2方法
1.2.1细胞培养 人皮肤黑素细胞提取参照文献[3]取健康成年人包皮(取自包皮环切术患者)进行消化、分离提取。黑素细胞、A375细胞培养条件为:5%CO2孵箱 37 ℃饱和湿度环境下孵育,含10%胎牛血清的DMEM培养,每2天更换1次培养液。
1.2.2RT-PCR检测 细胞总RNA提取参照Trizol(Invitogen公司)说明书操作步骤进行,并对所抽提的细胞总RNA质量进行验证。引物设计根据荧光定量PCR引物设计原则[4]。TGF-βRⅠ引物:上游为5′-GCA GTA AGA CAT GAT TCA GCC ACA G-3′,下游为5′-CAA TGG AAC ATC GTC GAG CAA-3′,扩增片段为190 bp;TGF-βRⅡ引物,上游为5′-TCG TCC TGT GGA CGC GTA TC-3′,下游为5′-GAA ACT TGA CTG CAC CGT TGT TG-3′,扩增片段为102 bp;内参校准基因GAPDH引物:上游为5′-GCA CCG TCA AGG CTG AGA AC-3′,下游为5′-ATG GTG GTG AAG ACG CCA GT-3′,扩增片段:142 bp。反转录合成cDNA:根据RT Reagent Kit反转录试剂盒说明书,温度设定为42 ℃ 15 min,然后95 ℃ 2 min使反转录酶失活,所得cDNA产物保存备用于-20 ℃冰箱中。RT-PCR反应:50 μL反应体系内含模板cDNA 200 ng,扩增条件为95 ℃预变性10 s,95 ℃变性 5 s,60 ℃退火30 s,72 ℃延伸45 s,共40个循环。分别设置融解曲线检测自65~95 ℃的融解温度,以验证产物的特异性。
1.2.3Western blot检测 参照文献[5]常规进行。分别取A375细胞(A375组)和正常黑素细胞(黑素细胞组)的总蛋白40 μg,上样至10%SDS-聚丙烯酰胺凝胶进行电泳后,电转到PVDF膜上,再用5%的脱脂奶粉室温下封闭60 min,TBS洗膜,分别加入用0.5%的BSA稀释的一抗(工作浓度为1∶200),4 ℃孵育过夜后,TBS洗膜,加入辣根过氧化酶标记的羊抗兔二抗(1∶1 000)孵育1 h,TBST(TBS+0.1%Tween20) 洗膜。此后按DAB显色试剂盒说明书操作显色。

2 结 果
2.1细胞中TGF-βRⅠ、Ⅱ型mRNA的表达检测 与A375组(设为100%)相比,黑素细胞组TGF-βRⅠ、Ⅱ型mRNA的2-△△CT值分别为2.126±0.130、4.282±0.226。黑素细胞组的TGF-βRⅠ、Ⅱ型mRNA表达量分别是A375细胞的(2.126±0.130)、(4.282±0.226)倍,A375组的TGF-βRⅠ、Ⅱ型mRNA表达水平显著低于黑素细胞组(P<0.05),见图1、2。
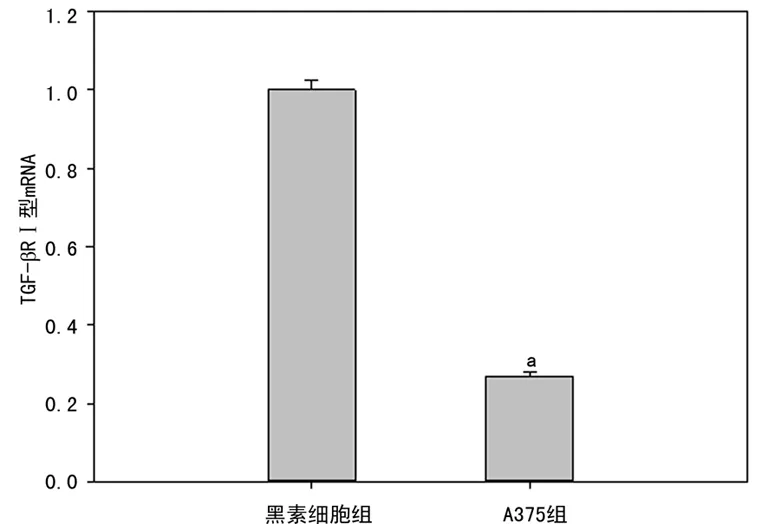
a:P<0.05,与黑素细胞组比较。
图1 两组细胞TGF-βRⅠ型mRNA相对表达量比较
2.2细胞中TGF-βRⅠ、Ⅱ型蛋白质的表达检测 黑素细胞组、A375组TGF-βRⅠ型蛋白质相对表达量分别为0.669±0.078、0.413±0.067(t=2.654,P<0.05)。黑素细胞组、A375组TGF-βRⅡ型蛋白质相对表达量分别为0.831±0.167、0.212±0.056(t=5.668,P<0.01)。A375组中TGF-βRⅠ、TGF-βRⅡ蛋白质表达量明显低于黑素细胞组,见图3。
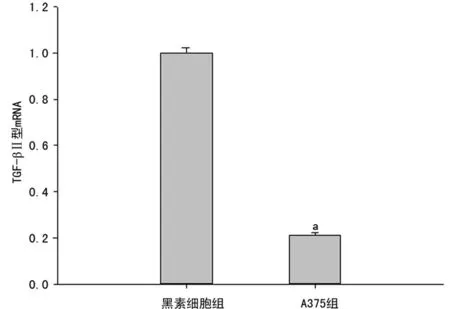
a:P<0.05,与黑素细胞组比较。
图2 两组细胞TGF-β RⅡ型mRNA相对表达量比较

图3 两组细胞TGF-βRⅠ、Ⅱ型蛋白质表达图
3 讨 论
TGF-β是一种多功能蛋白,可以影响多种细胞的生长,分化、细胞凋亡及免疫调节等功能。TGF-β包括3个亚型,TGF-β1、TGF-β2和TGF-β3[6-7]。TGF-β可以与细胞表面的TGF-βR结合而激活其受体,从而启动了信号传导级联而导致多种生物化学变化。TGF-β具有Ⅰ型和Ⅱ型两种跨膜信号传递受体,其受体内部含有丝氨酸/苏氨酸激酶活性。TGF-βR在机体组织、细胞中广泛分布。皮肤作为人体组织的最大器官,是TGF-β发挥作用的重要靶器官。
对于多种肿瘤的形成与发展,TGF-β可表现出截然相反的两种作用,在肿瘤发生的早期阶段表现抑制作用,而在肿瘤侵袭、转移及扩散的晚期阶段表现为促进及加剧的作用[8-9]。通过细胞处于G1期以其保持在非增殖状态,从而对肿瘤细胞发挥抑制作用。这种抑制功能是通过TGF-β/Smad信号通路转导TGF-βR和多种Smad蛋白来发挥的[10-11]。此外,激活某些重要的细胞周期关键基因会导致肿瘤细胞的生长抑制,也是因为这些关键基因是TGF-β/Smad信号通路的下游靶点[11-13]。另外,在正常上皮细胞中几种促进细胞周期停滞的基因的表达,也能被TGF-β所调控。肿瘤细胞趋于丧失TGF-β对肿瘤抑制作用的反应能力,从而加速了肿瘤的发生与进展。通过加速肿瘤新生血管的形成、免疫逃逸/抑制、增进肿瘤细胞与细胞外基质的相互作用来促进肿瘤的侵袭、扩散和转移,是TGF-β在促进肿瘤发生机制方面主要的作用[14]。
目前研究发现在恶性黑色素瘤组织中TGF-β/Smad信号通路中的多种重要成分-TGF-β、TGF-βR及部分Smad蛋白出现表达异常[1-2],提示在黑色素瘤的发生和发展过程中,TGF-β/Smad信号转导途径的多个环节的改变可能是其发病机制的重要原因之一。本研究通过比较体外培养的人黑色素瘤A375细胞及人正常黑素细胞中TGF-βRⅠ、Ⅱ型基因及蛋白质的表达,发现A375细胞的TGF-βRⅠ、Ⅱ型的表达均出现明显降低。由于TGF-β信号是通过其受体-TGF-βR来介导的,TGF-βR的存在是TGF-β/Smads信号下传的必要条件,如果TGF-βR表达水平降低或丧失,则TGF-β信号传导受阻,无法发挥TGF-β维持细胞内环境稳定性。在癌基因启动和抑癌基因功能丧失等多种相关因素的共同作用下,黑色素瘤细胞自身出现TGF-β抑制作用缺失,可导致黑色素瘤细胞的特征性病理改变,出现异常黑素细胞的失控性异常增殖及浸润、扩散。因此,本实验为黑色素瘤细胞出现异常增殖的机制研究提供了一定的依据。
通过本实验研究,说明TGF-βR表达水平的降低可能既存在于机体的黑色素瘤组织中,也出现在体外培养的人黑色素瘤细胞株中。推测TGF-βR的异常表达可能参与了黑色素瘤的发生和发展过程中,也或许为黑色素瘤细胞本身内在所固有的表现。因此在体外培养条件下,人黑色素瘤A375细胞仍然持续表达此信号通路异常的特质。但机体黑色素瘤中TGF-βR表达降低的原因并不清楚,是否可以推测:黑色素瘤组织中存在多种促使或抑制黑素细胞生长、增殖、凋亡及分化的基因发生改变,而TGF-βR表达的降低可能是其中原因之一。在多种促癌基因和抑癌基因异常调节的协同作用下,异常黑素细胞出现失控性异常增殖。研究黑色素瘤细胞中的TGF-β/Smad信号转导的表达,是为进一步深入系统了解黑色素瘤的发病机制奠定基础。
[1]李鹏程,张虹,丁正平,等.TGF-βR和Smad4蛋白在葡萄膜黑色素瘤中的表达[J].肿瘤防治研究,2005,32(1):35-36.
[2]武犁,邢怡桥,李鹏程,等.TGF-β1/TGF-βRⅡ和Smad4在葡萄膜黑色素瘤中的表达[J].眼科新进展,2005,25(3):240-241.
[3]徐前喜,杜娟,朱铁君,等.体外培养正常人黑素细胞TGF-β1及其I型受体的表达[J].中国麻风皮肤病学杂志,2006,22(5):353-355.
[4]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and 2 (-Delta Delta C (T)).Methods[J].Methods,2001,25(4):402-408.
[5]郁博,何威,张斌,等.肿瘤坏死因子-α对角质形成细胞株HaCaT细胞糖皮质激素受体表达的影响[J].临床皮肤科杂志,2010,39(5):279-282.
[6]Perrot CY,Javelaud D,Mauviel A.Insights into the transforming growth factor-β signaling pathway in cutaneous melanoma[J].Ann Dermatol,2013,25(2):135-144.
[7]Peng WM,Maintz L,Allam JP,et al.Attenuated TGF-β1 responsiveness of dendritic cells and their precursors in atopic dermatitis[J].Eur J Immunol,2013,43(5):1374-1382.
[8]Oshimori N,Fuchs E.The harmonies played by TGF-β in stem cell biology[J].Cell Stem Cell,2012,11(6):751-764.
[9]朱冰,张新定.TGF-β/Smads信号转导通路与脑胶质瘤的研究进展[J].重庆医学,2011,40(24):2457-2459.
[10]Smith AL,Robin TP,Ford HL.Molecular pathways:targeting the TGF-β pathway for cancer therapy[J].Clin Cancer Res,2012,18(17):4514-4521.
[11]Lan HY,Chung AC.TGF-β/Smad signaling in kidney disease[J].Semin Nephrol,2012,32(3):236-243.
[12]Zi Z,Chapnick DA,Liu X.Dynamics of TGF-β/Smad signaling[J].FEBS Lett,2012,586(14):1921-1928.
[13]Hneino M,François A,Buard V,et al.The TGF-β/Smad repressor TG-interacting factor 1 (TGIF1) plays a role in radiation-induced intestinal injury independently of a Smad signaling pathway[J].PLoS One,2012,7(5):e35672.
[14]Yamada Y,Mashima H,Sakai T,et al.Functional roles of TGF-β1 in intestinal epithelial cells through Smad-dependent and non-Smad pathways[J].Dig Dis Sci,2013,58(5):1207-1217.
Research of expression of TGF-β receptorⅠ/TGF-β receptor Ⅱin skin malignant melanoma cells*
YuBo1,ZhangBin2,SuLei1,PanMin1,ChenHongquan1△
(1.DepartmentofDermatology,AffiliatedHospitalofQingdaoUniversity,Qingdao,Shandong266003,China;2.DepartmentofDermatology,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China)
Objective To investigate the expression and significance of TGF-β receptor Ⅰ/TGF-β receptor Ⅱ(TGF-β Ⅰ/TGF-β Ⅱ) in human skin malignant melanoma A375 cell line.Methods The reverse transcription-real time polymerase chain reaction (RT-PCR) and Western blot were utilized to assess the expressions of TGF-βR Ⅰ/TGF--βR Ⅱ in A375 cell line and human normal melanocytes.Results The expressions of TGF-βR Ⅰ/TGF--βR Ⅱ mRNA and protein of A375 cells line were significantly lower than those of human normal melanocytes.Conclusion The down-regulated expression of TGF-βR in the TGF-β/Smad signal pathway of human skin malignant melanoma may be one of the pathogenesis of skin malignant melanoma.
melanoma;receptors,transforming growth factor beta;melanocytes
·基础研究
10.3969/j.issn.1671-8348.2015.11.006
山东省科技发展计划资助项目(2011YD18012);山东省自然科学基金资助项目(ZR2010HM022);山东省中医药科技资助项目(2011-199)。
郁博(1976-),副主任医师,博士后,主要从事黑色素瘤发病机制与TGF-β/Smad信号通路的研究工作。
△通讯作者,Tel:(0532)82911215;E-mail:chhq6198@163.com。
R332 R322.61
A
1671-8348(2015)11-1460-03
2014-07-11
2015-01-24)
