胃癌组织中TGF-β1、Smad2与CyclinD1的表达及其相关性的研究
2015-01-05潘理会李春辉刘海旺
潘理会,李春辉,刘海旺,程 玉
(1.承德医学院;2.承德医学院附属医院病理科,河北承德 067000)
胃癌组织中TGF-β1、Smad2与CyclinD1的表达及其相关性的研究
潘理会1,李春辉2△,刘海旺2,程 玉2
(1.承德医学院;2.承德医学院附属医院病理科,河北承德 067000)
目的 探讨胃癌组织中转化生长因子β1(TGF-β1)、Smad2与细胞周期蛋白D1(CyclinD1)的表达及三者之间的相关性。方法选择2007年1月至2012年1月腔镜活检正常胃黏膜20份(正常胃组织)作为对照组,手术切除胃癌标本60份(高-中分化、低分化)作为胃癌组,用免疫组化法检测TGF-β1、Smad2、CyclinD1正常胃组织及胃癌组织中的表达。结果TGF-β1及CyclinD1在胃癌组织中的表达高于对照组,Smad2在胃癌组中的表达低于对照组;TGF-β1及CyclinD1在低分化胃癌组中的表达高于高-中分化胃癌组;TGF-β1及CyclinD1在无淋巴结转移的胃癌组中的表达低于有淋巴结转移的胃癌组;TGF-β1、CyclinD1在胃癌组中的表达随着TNM分期的提高而升高,高-中分化胃癌组Smad2较低分化胃癌组表达升高,Smad2的表达在无淋巴结转移的胃癌组中的表达高于有淋巴结转移的胃癌组;Smad2在胃癌中的表达随TNM分期的提高而降低,TGF-β1、Smad2及CyclinD1的表达与患病年龄、性别无关;TGF-β1与Smad2呈负相关,TGF-β1与CyclinD1呈正相关,CyclinD1与Smad2呈负相关。结论TGF-β1、Smad2与CyclinD1的表达与胃癌的发病有关。
胃肿瘤;转化生长因子β1;Smad2蛋白质;细胞周期蛋白D1;基因表达;相关性
转化生长因子β1(transforming growth factor-β,TGF-β1)的生长抑制作用是通过其信号转导通路完成的,TGF-β1首先与其对应的受体结合形成复合物,该复合物可活化下游的细胞信号传导物质Smad2蛋白,活化的Smad2与Smad4结合后形成转录复合物进入细胞核,而人类细胞周期蛋白 D1 (cell cycle proteinD1,Cyclin D1)是G1期细胞增殖信号的关键蛋白,其在细胞核中过表达可使细胞过快进入细胞周期造成恶性增殖,而TGF-β1、Smad2与CyclinD1在胃癌组织中的表达及相关性的研究尚少见报道,本实验收集承德医学院附属医院2007年1月至2012年1月手术切除的胃癌组织标本60份,采用免疫组化的方法检测胃癌组织中TGF-β1、Smad2与CyclinD1蛋白的表达及相关性,为胃癌的发病机制研究提供理论依据。
1 资料与方法
1.1一般资料 收集承德医学院附属医院2007年1月至2012年1月腔镜活检正常胃黏膜20份(正常胃组织)为对照组,手术切除的胃癌组织标本60份(高-中分化、低分化)为胃癌组,运用免疫组化Elivision法检测TGF-β1、Smad2、CyclinD1在正常胃组织及胃癌组织中的表达,胃癌组患者均未作任何放化疗治疗。
1.2方法
1.2.1主要试剂 鼠抗人TGF-β1、Smad2、CyclinD1抗体即用型免疫组化试剂盒由武汉博士德生物技术公司提供。
1.2.2检测方法 两组组织标本常规石蜡包埋后,连续切片4 μm常规脱蜡至水,以3%H2O2室温孵育10 min,在微波炉中进行抗原修复,加正常山羊血清工作液进行封闭,分别加TGF-β1、Smad2、CyclinD1抗体在37 ℃湿盒中温育60 min后,在湿盒中4 ℃过夜,DAB显色,苏木素复染核,封片,观察,另外,组织切片用PBS替代TGF-β1、Smad2、CyclinD1抗体作为阴性对照,阳性对照为已知TGF-β1、Smad2、CyclinD1阳性的胃癌组织标本及已知阳性的正常胃组织标本。
1.2.3结果判定 应用CMIAS真彩色医学图象分析系统,每张切片随机选择5个高倍(×200)视野,分别对5个不同视野中的各组免疫组化结果进行积分光密度(integral optical density,IOD)测定,然后计算平均IOD值。

2 结 果
2.1两组TGF-β1、Smad2、CyclinD1表达比较 TGF-β1及CyclinD1在胃癌组织中的表达高于对照组,两组比较差异有统计学意义(P<0.05);Smad2蛋白在胃癌组中的表达低于对照组,两组比较差异有统计学意义(P<0.05),见表1。
2.2TGF-β1 Smad2、CyclinD1在不同分化程度胃癌组织中的表达及与临床特征的关系 TGF-β的表达在胃癌低分化组高于高-中分化组(P<0.05),在无淋巴结转移的胃癌组织中的表达低于有淋巴结转移的胃癌组织(P<0.05),在胃癌组的IOD值随着TNM分期的提高而升高,Ⅰ~Ⅱ期为16.01±5.33,Ⅲ~Ⅳ期为22.24±4.42,组间比较差异有统计学意义(P<0.05)。Smad2的表达在高-中分化胃癌组织中IOD值高于低分化胃癌组织(P<0.05),在无淋巴结转移的胃癌组织中的IOD值高于有淋巴结转移的胃癌组织(P<0.05),在胃癌组的IOD值随着TNM分期的提高而降低,Ⅲ~Ⅳ期为13.13±3.07,Ⅰ~Ⅱ期为19.23±4.12,组间比较差异有统计学意义(P<0.05)。CyclinD1的表达在低分化胃癌组织中IOD值高于高-中分化胃癌组织(P<0.05),在无淋巴结转移胃癌组织中的IOD值低于有淋巴结转移的胃癌组织(P<0.05),在胃癌组的IOD值随着TNM分期的提高而升高,Ⅰ~Ⅱ期与Ⅲ~Ⅳ期比较,差异有统计学意义(P<0.05)。TGF-β1、Smad2、CyclinD1蛋白表达均与患者年龄、性别无关(P>0.05),见图1、表2。
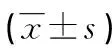
表1 两组TGF-β1、Smad2、CyclinD1的IOD值比较
a:P<0.05,与对照组比较。
2.3TGF-β1、Smad2、CyclinD1之间相关关系 TGF-β1与Smad2呈显著负相关(r=-0.782,P<0.05),与CyclinD1呈低度正相关(r=0.496,P<0.05);CyclinD1与Smad2呈显著负相关(r=-0.789,P<0.05)。


图1 TGF-β1、Smad2、CyclinD1蛋白在各组组织标本中表达(IHC×200)
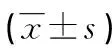
表2 TGF-β1、Smad2、CyclinD1在胃癌组织中的表达及与临床特征的关系
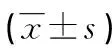
续表2 TGF-β1、Smad2、CyclinD1在胃癌组织中的表达及与临床特征的关系
3 讨 论
在正常细胞中,TGF-β1通过阻断细胞从G1期进入S期而抑制细胞增殖。因此,具有肿瘤抑制因子的作用,若阻断对细胞的这种生长抑制作用,可导致细胞增殖促进肿瘤的发生、发展。肿瘤细胞自身会反馈性的增加TGF-β1的分泌,一定程度上促进肿瘤细胞与细胞外基质的相互作用,导致血管内皮细胞增生和肿瘤内血管的形成给肿瘤的生长和转移提供合适的微环境[1],TGF-β1可依赖Smad2/3的作用抑制Bcl-xl表达进而抑制细胞增长[2-3]。本结果显示,TGF-β1在正常胃组织中弱表达,在胃癌中表达上调,且随着胃癌分化程度的降低、淋巴结转移、TNM分期增高而表达增强,其表达与患者的年龄及性别无关,表明TGF-β1与胃癌的发生、发展有关[4-7]。
当TGF-β1信号通路改变,其对靶细胞失去效应,可促进肿瘤的演进[8]。TGF-β1调控的基因通常依赖于即Smad2,Smad2在细胞核中形成转录活化复合体,可用来调控TGF-β1对下游基因的表达[9-12],研究发现Smad2主要通过干扰活化的TGF-β1型受体对其磷酸化水平的调节,从而进一步阻断TGF-β1生长抑制信号的传导。本实验结果发现,Smad2蛋白在正常胃黏膜中高表达,在胃癌中Smad2低表达,而高-中分化胃癌Smad2的表达比低分化者高,同样,在有淋巴结转移者中Smad2的表达低于无淋巴结转移者,TNM分期Ⅲ~Ⅳ期的Smad2的表达低于TNM分期Ⅰ~Ⅱ期,以上结果表明,随着胃癌的发生、发展Smad2的表达呈现下降的趋势,说明Smad2在胃癌的发生、发展过程中起到一定作用。
TGF-β1与其对应的受体结合形成复合物,该复合物可活化下游的细胞信号传导物质Smad2蛋白,活化的Smad2与Smad4结合后形成转录复合物进入细胞核,Cyclin D1是G1期细胞增殖信号的关键蛋白其在核中过表达可使细胞过快进入细胞周期造成恶性增殖,目前对CyclinD1与胃癌发生、发展关系的研究并不明确,Cyclin D1的过度增殖可能是胃癌发生的重要因素[13-15],本研究发现,CyclinD1在胃癌中的表达明显高于正常胃黏膜,低分化胃癌的表达低于高中分化胃癌,而且在分化程度越低的癌肿表达率越高,该研究结果揭示CyclinD1与胃癌的分化程度、浸润深度及淋巴结转移密切相关,同时研究发现TGF-β1与Smad2呈负相关,提示Smad2对TGF-β1有抑制作用,CyclinD1与Smad2呈负相关,提示Smad2对CyclinD1可能具有负调节作用,TGF-β1与CyclinD1之间呈正相关,提示TGF-β1对CyclinD1有正调节作用,即TGF-β1/Smad2信号通路可能通过调节CyclinD1导致胃癌的发生、发展,而TGF-β1/Smads信号通路中TGF-β1,Smad2在胃癌发生、发展中的作用机制仍需进一步研究。
[1]Massague J,Wotton D.Transcriptional control by the TGF-beta/Smad signaling system[J].EMBO J,2000,19(8):1745-1754.
[2]Wrana JL,Attisano L,Wieser R,et al.Mechanism of activation of theTGF-beta receptor[J].Nature,1994,370(6488):341-347.
[3]Ten Dijke P,Hill CS.New insights into TGF-beta signaling[J].Trends Biochem Sci,2004,29(5):265-273.
[4]Laverty HG,Wakefield LM,Occleston NL,et al.TGF-beta3 and cancer:a review[J].Cytokine Growth Factor Rev,2009,20(4):305-317.
[5]Li Z,Miao Z,Jin G,et al.βig-h3 supports gastric cancer cell adhesion,migration and proliferation in peritoneal carcinomatosis[J].Mol Med Rep,2012,6(3):558-564.
[6]Nadauld LD,Ford JM.Family history as a positive prognostic factor in gastric cancer[J].J Clin Oncol,2012,30(7):683-684.[7]Yu JX,Zhang XT,Liao YQ,et al.Relationship between expression of CD105 and growth factors in malignant tumors of gastrointestinal tract and its significance[J].World J Gastroenterol,2003,9(12):2866-2869.
[8]NaD,LvZD,LiuFN,etal.Transforminggrowthfactorβ1producedinautocrine/paracrinemanneraffects the morphology and function of mesothelial cells and promotes peritoneal carcinomatosis[J].Int J Mol Med,2010,26(3):325-332.
[9]Ananiev J,Gulubova M,Tchernev G,et al.Relation between transforming growth factor-β1 expression,its receptor and clinicopathological factors and survival in HER2-negative gastric cancers[J].Wien Klin Wochenschr,2011,123(21/22):668-673.
[10]Li X,Yue ZC,Zhang YY,et al.Elevated Serum Level and Gene Polymorphisms of TGF-β1 in Gastric Cancer[J].J Clin Lab Anal,2008,22(3):164-171.
[11]Matsuzaki K,Kitano C,Murata M,et al.Smad2 and Smad3 phosphorylated at both linker and COOH-terminal regions transmit malignant TGF-beta signal in later stages of human colorectal cancer[J].Cancer Res,2009,69(13):5321-5330.
[12]张勇,秦娜,于斌.TGF-β/Smads信号转导通路的研究进展[J].广西医科大学学报,2009,26(1):155-157.
[13]Stelow EB,Mills SE,Jo VY,et al.Adenocarcinoma of the upper aerodigestive tract[J].Adv Anat Pathol,2010,17(4):262-269.
[14]García-González MA,Nicolás-Pérez D,Lanas A,et al.Prognostic role of host cyclooxygenase and cytokine genotypes in a Caucasian cohort of patients with gastric adenocarcinoma[J].PLoS One,2012,7(9):e46179.
[15]Neal JT,Peterson TS,Kent ML,et al.H.pylori virulence factor CagA increases intestinal cell proliferation by Wnt pathway activation in a transgenic zebrafish model[J].Dis Model Mech,2013,6(3):802-810.
Expression of TGF-β1,Smad 2 and CyclinD1 in gastric carcinoma tissue and their correlation*
PanLihui1,LiChunhui2△,LiuHaiwang2,ChengYu2
(1.ChengdeMediecalCollege;2.AffiliatedHospitalofChengdeMediecalCollege,Chengde,Hebei067000,China)
Objective To explore the expression of TGF-β1,Smad2 and CyclinD1 protein in gastric carcinoma tissue and their correlation.Methods 20 specimens of normal gastric tissue by the endoscopic biopsy (control group) and 60 surgical specimens(high-middle differentiation,low differentiation) of gastric carcinoma(gastric cancer group) were collected from January 2007 to January 2012.The immunohistochemical method was used to detect the expression of TGF-β1,Smad2 and CyclinD1 in gastric cancer tissues and normal gastric mucosal tissues.Results The expression of TGF-β1 and CyclinD1 in the gastric cancer group was significantly higher than that in the normal gastric tissue group,while the expression of Smad2 in the gastric cancer group was significantly lower than that in the normal gastric tissue group;the expression of TGF-β1 and CyclinD1 in the low differentiation group was higher than that in the high-middle differentiation group,the expression of TGF-β1 and CyclinD1 in the non lymph node metastasis group was lower than that in the lymph node metastasis group;the expression of TGF-β1 and CyclinD1 protein in gastric cancer was increased with the increase of the TNM staging.The expression of Smad2 in the high-middle differentiation group was higher than that in the low differentiation group,the expression of Smad2 in the non-lymph node metastasis group was higher than that in the lymph node metastasis group;the expression of Smad2 in gastric cancer was decreased with the increase of the TNM staging.The expression of TGF-β1,Smad2 and CyclinD1 in the gastric cancer group had no relation with age and gender.TGF-β1 was negatively correlated with Smad2,TGF-β1 was positively correlated with CyclinD1,CyclinD1 was negatively correlated with Smad2.Conclusion TGF-β1 and Smad2 are related with the CyclinD1 expression and pathogenesis of gastirc carcinoma.
stomach neoplasms;transforming growth factor beta1;smad2 protein;CyclinD1;gene expression;correlation
·临床研究
10.3969/j.issn.1671-8348.2015.11.013
河北省医学科学研究重点课题计划资助项目(ZL20140103)。
潘理会(1965-),高级实验师,大学本科,主要从事胃癌的基础与临床研究。
△通讯作者,Tel:15633142839;E-mail:chli612@126.com。
R735.2
A
1671-8348(2015)11-1481-03
2014-11-10
2015-01-25)
