胶质细胞对Aβ诱导的阿尔茨海默病大鼠脑神经损伤的影响
2015-01-05狄婷婷王秋杰王瑞婷
狄婷婷,王秋杰,张 美,王瑞婷△
(1.承德医学院研究生2012级;2.承德护理职业学院;3.承德市医学情报站;4.承德医学院,河北承德 067000)
胶质细胞对Aβ诱导的阿尔茨海默病大鼠脑神经损伤的影响
狄婷婷1,2,王秋杰3,张 美4,王瑞婷4△
(1.承德医学院研究生2012级;2.承德护理职业学院;3.承德市医学情报站;4.承德医学院,河北承德 067000)
目的 探讨神经胶质细胞对β-淀粉样蛋白(Aβ)诱导的阿尔茨海默病(AD)大鼠脑神经损伤的作用。方法将雄性Wistar大鼠20只,分为对照组和模型组,每组10只;模型组双侧海马注射凝胶态Aβ(10 μg),对照组注射生理盐水;行水迷宫实验;硫堇染色观察皮层神经元形态变化及数量;酶联免疫吸附试验(ELISA)法检测大鼠血清中肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)水平;免疫组化检测胶质细胞及神经胶质原纤维酸性蛋白质(GFAP)表达。结果模型组大鼠水迷宫各项指标均明显低于对照组(P<0.05);皮层神经元数量较对照组明显减少(P<0.01);血清中TNF-α、IL-1β明显高于对照组(P<0.05);海马GFAP阳性细胞数明显多于对照组(P<0.05)。结论Aβ可激活胶质细胞及促炎因子释放,引起大鼠脑神经元损伤,导致大鼠学习、记忆能力降低。
阿尔茨海默病;淀粉样蛋白;胶质细胞;炎症反应;神经胶质原纤维酸性蛋白质
阿尔茨海默病(Alzheimer disease,AD)是一种以认知功能障碍及记忆减退或缺失为主要特征的退行性病变[1]。其发病机制复杂,β-淀粉样蛋白(amyloid β-protein,Aβ)作为AD发病的始动因子现已得到公认[2]。AD患者脑内持续存在慢性炎性反应,参与炎性反应的细胞主要是神经胶质细胞[3-5]。有研究认为,长期使用非甾体类抗炎药可使AD的发病率降低[6],支持炎性反应参与了AD的发病。本实验采用大鼠双侧海马注射Aβ的方法制作痴呆模型,观察Aβ诱导的大鼠神经元损伤及神经胶质细胞的变化,探讨神经胶质细胞在Aβ引起神经元损伤中的作用,为寻找AD治疗新的靶点提供实验依据。
1 材料与方法
1.1材料 实验动物:选择雄性Wistar大鼠20只,10~12周,体质量(280±20)g,SPF级,购自北京华阜康生物技术科技有限公司(动物合格证号为0289310)。实验试剂:Aβ25~35购自Sigma公司,高效液相色谱法(HPLC)检测纯度大于或等于97%,Aβ25~351 mg干粉溶于500 μL无菌生理盐水(2 g/L),-20 ℃保存,临用前置于37 ℃温箱孵育3~5 d成凝胶态。大鼠血清肿瘤坏死因子-α(TNF-α)(RRA00),白细胞介素-1β(IL-1β)(RTA00)酶联免疫吸附试验(ELISA)试剂盒由R&D研发中心提供,通用型SP工作液SP-9000免疫组化试剂盒、山羊抗兔神经胶质原纤维酸性蛋白质(GFAP)多抗(G9269)、山羊抗兔IgG/辣根过氧化物酶标记(ZB2301,Lot:73399)购自北京中杉金桥生物技术有限公司,其他试剂为分析纯。
1.2方法
1.2.1实验动物分组及处理 将20只大鼠分为模型组和对照组,每组10只。分笼饲养,自然光照,自由食水,标准饲料。适应性饲养7 d后,模型组大鼠双侧海马各注射 5 μL凝胶态Aβ25~35(10 μg),对照组大鼠双侧海马各注射5 μL 0.9%生理盐水溶液。14 d后行Morris水迷宫行为学实验,21 d后将大鼠全部处死,心脏采血,大鼠脑组织固定,石蜡包埋。
1.2.2动物痴呆模型制作 大鼠腹腔注射4%的水合氯醛溶液(1 mL/100 g)麻醉后,固定于脑立体定位仪上,参照大鼠脑立体定位图谱,定位海马(hippocampus)CA1区,按预试验确定进针点进针:前囟后(anteroposterior,AP)3.50 mm,中缝左或右(mediolateral,ML)±2.00 mm,颅骨硬脑膜平面向下(dorsoventral,DV)2.70 mm,微量注射器向双侧海马缓慢注入Aβ25~35,留针5 min,缓慢拔针,缝合伤口,术后给予青霉素10万U/只,每天1次,共3 d。
1.2.3Morris水迷宫行为学实验 取高为60 cm的圆形不锈钢水池,直径为120 cm,将该水池等分为4个象限,在目标象限的正中间放置一个高为23.50 cm,直径为10.00 cm的圆形平台,水温为(21±1)℃;实验期间迷宫周围参照物不变,迷宫上方安置摄像机,同步记录大鼠运动轨迹。实验前需让大鼠自由游泳2 min后,每天将大鼠从池壁4个象限点面向池壁放入水中,测验2次,6 d后撤去平台,观察大鼠在2 min内通过平台区的次数,并记录大鼠在平台象限内停留的时间及所游路程等数据。
1.2.4血清制备及指标检测 取Wistar大鼠,每组10只,水合氯醛麻醉后,心脏取血,室温下放置30 min,于4 ℃,4 000 r/min离心10 min,取上清液,冻存于低温冰箱。应用ELISA检测大鼠血清TNF-α、IL-1β水平,严格按照试剂盒说明书操作。
1.2.5灌注取材 取血后,大鼠左心室快速灌注生理盐水250 mL,然后灌注含4%多聚甲醛的磷酸盐缓冲液(PBS-T)250 mL,先快后慢,1 h后断头取脑,左右半脑各在海马注射部位沿冠状面切开,4%多聚甲醛固定过夜,经脱水、透明、浸蜡,将两块组织的切面朝下包埋,行冠状切片,片厚5 μm,以备用于染色和免疫组化。
1.2.6硫堇尼氏体染色法 从石蜡标本连续切片中每间隔4张抽取一张,经二甲苯脱蜡,梯度乙醇水合,蒸馏水冲洗,0.2%硫堇60 ℃水浴30~60 min,冷却后梯度乙醇脱水,二甲苯透明,中性树胶封片。
1.2.7细胞计数法 每组选取3只大鼠,每个标本选取大鼠大脑皮层细胞损伤严重段2张切片,光镜下观察,每张随机抽取大鼠大脑皮层切片的2个400倍视野,进行神经细胞计数。
1.2.8免疫组织化学技术检测胶质细胞及GFAP表达 石蜡切片,经二甲苯脱蜡,梯度乙醇水合,蒸馏水冲洗,PBS清洗3次;3%甲醇-H2O2去除过氧化物酶;95 ℃水浴抗原修复10~15 min,冷却后PBS清洗;10%山羊血清封闭,37 ℃ 15 min;滴加GFAPⅠ抗(1∶80),4 ℃过夜,PBS洗;滴加Ⅱ抗37 ℃ 孵育15 min,PBS洗;滴加亲和素―生物素―过氧化物酶(ABC)复合物,37 ℃ 孵育15 min,PBS洗;二氨基联苯胺(DAB)辣根过氧化物酶显色;终止显色;苏木素复染;脱水,透明,封片,用PBS液代替Ⅰ抗作为阴性对照。GFAP是胶质细胞特异性分泌的一种酸性蛋白,切片中见到胶质细胞突起呈棕黄色为GFAP蛋白表达。

2 结 果
2.1两组大鼠水迷宫实验结果比较 水迷宫实验6 d两组大鼠各项指标比较,结果显示,对照组的大鼠2 min内穿越平台区域的次数、在平台象限停留的时间、在平台象限所游路程与总路程比值,均明显高于模型组(P<0.05),见表1。

表1 水迷宫实验6 d两组大鼠各项指标比较
a:P<0.05,与对照组比较。
2.2Aβ对大鼠皮层神经元的影响 硫堇尼氏体染色,对照组大鼠皮层神经元较多,神经元形态清晰、完整,核仁清晰,突起明显,胶质细胞少;模型组大鼠皮层神经元少,突起减少、断裂,细胞体不完整,局部区域神经元死亡(图1),胶质细胞增多,可见胶质细胞吞噬神经元现象。模型组皮层神经元(105.80±15.61)个明显少于对照组(516.19±65.32)个,两组比较差异有统计学意义(P<0.05)。
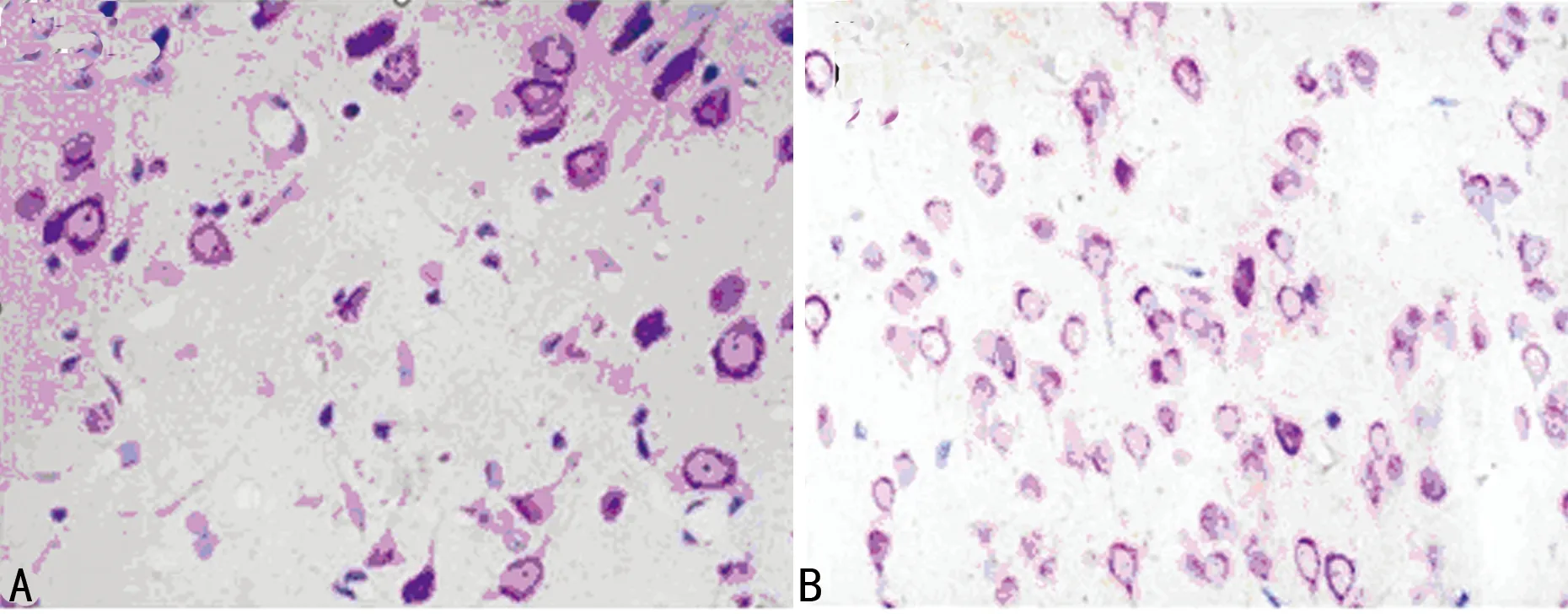
A:模型组;B:对照组。
图1 硫堇尼氏体染色大鼠皮层(×400)
2.3两组大鼠血清TNF-α和IL-1β水平比较 模型组大鼠血清中TNF-α、IL-1β水平明显高于对照组,两组比较差异有统计学意义(P<0.05),见表2。

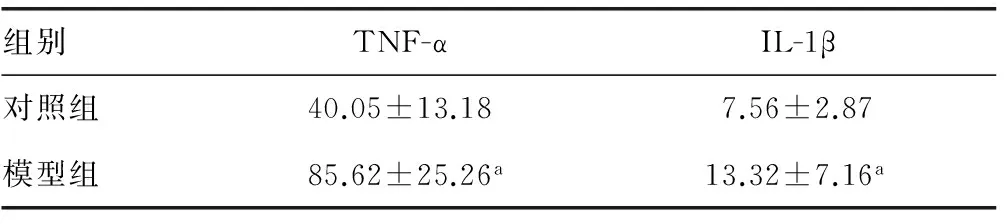
组别TNF-αIL-1β对照组40.05±13.187.56±2.87模型组85.62±25.26a13.32±7.16a
a:P<0.05,与对照组比较。
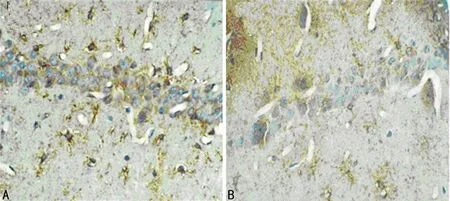
A:模型组;B:对照组。
图2 两组大鼠海马CA1区GFAP表达(×400)
2.4两组大鼠海马GFAP表达结果比较 镜下见模型组海马胶质细胞GFAP蛋白阳性表达明显强于对照组,同时模型组的胶质细胞数量(17.50±8.62)个明显高于对照组(8.21±6.10)个,两组比较差异有统计学意义(P<0.05)。两组大鼠海马GFAP表达,见图2。
3 讨 论
体外凝聚状态的Aβ与AD患者脑内的Aβ结构相似,有研究表明Aβ25~35能引起神经元损伤、学习、记忆能力下降[7-8]。本实验大鼠双侧海马注射凝胶态Aβ25~35,发现模型组大鼠皮层神经元损伤、学习记忆能力降低,与文献[9-10]的研究结果一致。有研究报道,AD患者脑内变性的神经元周围有大量胶质细胞增生[11],GFAP在激活的胶质细胞中表达增加,其表达与胶质细胞活性成正比,表达增强标志中枢神经系统损害时反应性胶质细胞增生[12-14]。本实验发现,模型组大鼠皮层局部区域神经元死亡,胶质细胞明显增多,可见胶质细胞吞噬神经元现象。模型组GFAP蛋白阳性表达明显强于对照组,提示Aβ激活了胶质细胞,胶质细胞参与了Aβ引起的神经元损伤。
AD是老年人常见的一种多因异质性疾病,其病理表现多样,涉及多种病理机制。其中老年斑形成是AD最具特征性的病理改变,有研究显示,AD患者脑内老年斑周围存在大量活化的神经胶质细胞和炎性因子,考虑AD患者脑内持续存在慢性炎性反应[3-5],这种炎性反应可能是导致机体神经退行性病变的主要因素之一。宴燕等[15]研究发现AD患者血清TNF-α、IL-1β水平显著高于正常对照组,有研究报道,活化的胶质细胞可释放炎症因子,引起神经元损伤,本研究发现模型组大鼠血中TNF-α、IL-1β水平明显高于对照组[16-17]。Takeuchi等[18]研究发现TNF-α诱导神经毒性是通过激活的胶质细胞自分泌谷氨酸盐实现的,TNF-α、IL-1β一定程度上可反映痴呆严重程度,可能成为临床辅助诊断的生物学指标,高水平的TNF-α不仅对神经元具有毒性作用,并且可协同IL-1强烈诱导IL-6产生,加速病程的发展[19]。
综合本实验神经元损伤、GFAP表达和TNF-α、IL-1β水平,证实Aβ激活胶质细胞,导致炎症因子释放,损伤神经元。慢性激活状态的胶质细胞所产生的细胞因子在AD发病的不同环节可能起放大炎症过程和细胞毒性作用。因此,AD患者通过抗炎药物抑制脑内炎性反应,可能延缓病程的发展。
[1]王维治.神经病学[M].北京:人民卫生出版社,2002:249.
[2]Hardy J,Selkoe DJ.The amyloid hypothesis of Alzheimer′s disease:progress and problems on the road to therapeutics[J].Science,2002,297(5580):353-356.
[3]庄丽英,张志珺.神经炎症与阿尔茨海默病[J].中华行为医学与脑科学杂志,2012,21(7):664-665.
[4]朱飞奇,钱采韵.神经炎症与阿尔茨海默病的迷茫与前景[J].中国神经精神疾病杂志,2009,35(1):50-52.
[5]官杰,李浩,刘剑刚,等.炎症反应及抗炎药物与阿尔茨海默病的研究进展[J].中华神经医学杂志,2012,11(12):1282-1285.
[6]Conti P,Varvara G,Murmura G,et al.Comparison of beneficial actions of non-steroidal anti-inflammatory drugs to flavonoids[J].Biol Regul Homeost Agents,2013,27(1):1-7.
[7]Berson A,Knobloch M,Hanan M,et al.Changes in readthrough acetylcholinesterase expression modulate amyloid-beta pathology[J].Brain,2008,131(1):109-119.
[8]PanYF,Chen XR,Wu MN,et al.Arginine vasopressin prevents against amyloid beta(25-35) induced impairment of spatial learing and memory in rats[J].Horm Behav,2010,57(4/5):448-454.
[9]张晓红,余焕玲,肖荣,等.β淀粉样肽31-35和25-35对培养大鼠皮质神经元的毒性作用[J].中华预防医学杂志,2009,43(12):1081-1085.
[10]汪保华,袁华,吕志华,等.灵芝多糖对模拟AD学习记忆障碍大鼠海马白细胞介素-6表达的影响[J].卒中与神经疾病,2007,14(4):206-213.
[11]周晓辉,程新春.炎性细胞因子在Alzheimer病发病中的作用[J].临床神经病学杂志,2007,20(5):397-398.
[12]Kuegler PB,Baumann BA,Zimmer B,et al.GFAP-independent inflammatory competence and trophic functions of astrocytes generated from murine embryonic stem cells[J].Glia,2012,60(2):218-228.
[13]Luna G,Lewis GP,Banna CD,et al.Expression profiles of nestin and synemin in reactive astrocytes and Müller cells following retinal injury:a comparison with glial fibrillar acidic protein and vimentin[J].Mol Vision,2010,16(269):2511-2523.
[14]熊鹏,吴秋霞,王继才,等.精神分裂症患者血清GFAP与MBP水平的变化[J].中国神经精神疾病杂志,2013,39(1):44-47.
[15]宴燕,王萍.阿尔茨海默病血浆中IL-6、Aβ1-40、MCSF、IL-1β、TNF-α的临床诊断意义[J].中国当代医药,2012,19(34):17-18.[16]Block ML,Hong JS.Chronic microglial activation and progressive dopaminergic neurotoxicity[J].Biochem Soc Trans,2007,35(5):1127-1132.
[17]Lee CY,Tse W,Smith JD.Apolipoprotein E promotes Aβ trafficking and degradation by modulating microglial cholesterol levels[J].Biol Chem,2012,287(3):2032-2044.
[18]Takeuchi H,Jin S,Wang J,et al.Tumor necrosis factor-alpha induces neurotoxicity via glutamate release from hemichannels of activated microglia in an autocrine manner[J].J Biol Chem,2006,281(30):21362-21368.
[19]邬烈铭,朱文芳,裴瑜,等.老年性痴呆患者认知功能与血清炎性细胞因子浓度的相关研究[J].中华临床医师杂志:电子版,2012,6(11):2970-2973.
Effect of glial cell on neuron damage induced by Aβ in Alzheimer′s disease rat*
DiTingting1,2,WangQiujie3,ZhangMei4,WangRuiting4△
(1.PostgraduateGrade2012,ChengdeMedicalUniversity;2.ChengdeNursingVocationalCollege;3.ChengdeMunicipalMedicalInformationStation;4.ChengdeMedicalUniversity,Chengde,Hebei067000,China)
Objective To explore the effect of glial cells on cerebral neuron damage induced by amyloid beta protein(Aβ) in Alzheimer′s disease rat.Methods 20 male Wistar rats were randomly divided into the control group and the model group,10 cases in each group The gel state Aβ(10 μg) was injected into the rat′s bilateral hippocampus in the model group,while the control group was injected with normal saline;the Morris water maze test was performed to assess the rat′s learning and memory ability;the thionine stain was used for observing the morphology and quantity of cerebral cortex neurons;the enzyme linked immunosorbent assay (ELISA) was adopted to detect the serum tumor necrosis factor alpha(TNF-α) and interleukin 1 beta(IL-1β) levels;the immunohistochemical was used to detect the expression of glial cell and glial fibrillary acidic protein (GFAP).Results The various indexes in the model group were significantly lower than those in the control group(P<0.05);the quantity of cerebral cortex neurons in the model group was significantly decreased compared with that in the control group(P<0.01);the ELISA results showed that the levels of TNF-α and IL-1β in the model group were significantly higher than those in the control group(P<0.05);the immunohistochemistry showed that the number of GFAP positive cells in the hippocampus in the model group was significantly more than that in the control group(P<0.05).Conclusion Aβ might activate the glial cells and promote the release of inflammatory cytokines,which causes the damage of rat cerebral neurons and leads to decrease the rat′s learning and memory ability.
Alzheimer disease;amyloid;glial cells;inflammation;glial fibrillary acidic protein
·基础研究
10.3969/j.issn.1671-8348.2015.11.008
河北省高校省级重点学科资助项目(20130337);河北省教育厅重点资助课题(ZD20131051)。
狄婷婷(1981-),讲师,硕士研究生,主要从事阿尔茨海默病发病机制研究。
△通讯作者,Tel:(0314)2290069;E-mail:wrtwrt8324@sina.com。
R363.2
A
1671-8348(2015)11-1466-03
2014-08-24
2015-01-10)
